
- •О. А. Голубчиков
- •Органический практикум
- •Санкт-Петербург
- •Нии химии сПбГу – 2012
- •Оглавление
- •Предисловие
- •1. Общие правила и методы работы
- •1.1. Планирование работ и ведение рабочего журнала
- •1.1.1. Форма ведения записей в лабораторном журнале
- •1.1.2. Пояснения к составлению таблиц
- •1.1.3. План экспериментальной работы. Отчет о выполнении работы
- •1.2. Правила техники безопасности в лаборатории органического синтеза
- •1.2.1. Общие правила работы
- •1.2.2. Правила обращения с ядовитыми и едкими веществами
- •1.2.3. Правила при работе с огнеопасными веществами
- •1.2.4. Правила при работах, которые могут сопровождаться взрывами или выбросами веществ
- •1.2.5. Правила обращения со стеклом
- •1.3. Основные методы выделения и очистки органических соединений
- •1.3.1 Перекристаллизация Принцип метода
- •Подбор растворителя
- •Практика проведения перекристаллизации
- •Обесцвечивание горячих насыщенных растворов
- •Фильтрование с отсасыванием
- •Сушка органических веществ
- •Определение температуры плавления вещества
- •Контрольные вопросы
- •1.3.2. Перегонка органических жидкостей
- •1.3.2. Простая перегонка при атмосферном давлении
- •Перегонка при уменьшенном давлении (под вакуумом)
- •Перегонка с водяным паром
- •Фракционная перегонка и перегонка с дефлегматором
- •Контрольные вопросы
- •1.3.3. Хроматография
- •Газо-жидкостная хроматография
- •Тонкослойная и бумажная хроматография
- •Нуклеофильное замещение у sp3-гибридизованного атома углерода
- •Нуклеофильное замещение у sp2-гибридизованного карбонильного углерода
- •Контрольные вопросы
- •2.1.2. Бромистый изопропил
- •Примечания:
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.3. Ацетанилид (метод а)
- •2.1.4. Ацетанилид (метод б)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.5. Ацетилсалициловая кислота (аспирин)
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •2.2. Электрофильное замещение в ароматическом ряду
- •2.2.1. Основные теоретические положения
- •2.2.2. Нитротолуолы (смесь изомеров)
- •Хроматографическое определение изомерного состава нитротолуолов
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.2.4. Cульфаниловая кислота
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.3. Восстановление нитросоединений
- •2.3.1. Основные теоретические положения
- •Восстановление металлами в присутствии растворов электролитов
- •Восстановление в кислой среде металлами
- •Пути восстановления нитросоединений в зависимости от pH среды Восстановление в кислой среде
- •Восстановление в щелочной среде
- •Восстановление в щелочной среде растворами сульфидов. Селективное восстановление полинитросоединений
- •Определение конца реакции
- •Выделение продуктов реакции
- •Меры предосторожности при работе с ароматическими аминами
- •2.3.2. Анилин
- •Выделение анилина из реакционной смеси
- •2.3.3. Выделение и идентификация аминов
- •Пояснения к синтезу
- •Экстракция органических веществ из водных растворов
- •Контрольные вопросы
- •2.3.4. Мета-Нитроанилин
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4. Получение и превращения диазосоединений
- •2.4.1. Основные теоретические положения
- •Получение ароматических диазосоединений
- •Механизм диазотирования
- •Факторы, влияющие на скорость диазотирования
- •Контроль диазотирования
- •Формы диазосоединений
- •Превращения диазосоединений Азосочетание
- •Реакции солей диазония с выделением азота
- •2.4.2. Йодбензол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4.5. Метилоранж
- •Примечания к синтезу
- •Метиловый оранжевый:
- •2.4.6. Кислотный оранжевый (-нафтолоранж)
- •Азосочетание
- •2.4.7. Резорциновый желтый (тропеолин)
- •Азосочетание
- •2.4.8. Спектрофотометрическое определение содержания красителя в растворе
- •2.4.9. Пояснения к синтезам азокрасителей
- •Контрольные вопросы
- •2.5. Окисление
- •2.5.1. Основные теоретические положения
- •2.5.2. Бензойная кислота (из толуола)
- •Примечание
- •2.5.3. Бензойная кислота (из бензилового спирта)
- •Пояснения к синтезам бензойной кислоты (2.5.2 и 2.5.3)
- •Контрольные вопросы
- •2.5.4. Масляный альдегид (бутаналь)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.5.5. Бензальдегид
- •Пояснения к синтезу
- •Контрольные вопросы
- •3. Синтез гетероциклических соединений
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Бензимидазол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Хинолин (синтез Скраупа)
- •Пояснения к синтезу
- •Фенилизоиндолизин
- •Пояснения к синтезу
- •Фенотиазин
- •Пояснения к синтезу
- •5,10,15,20-Тетрафенилпорфирины
- •5,10,15,20-Тетрафенилпорфирин
- •Пояснения к синтезу
- •Хроматографическая очистка тетрафенилпорфирина
- •5,10,15, 20-Тетракис(4-нитрофенил)порфирин
- •Пояснения к синтезу
- •5,10,15,20-Тетракис(4-бромфенил)порфирин
- •Приложение
- •Список рекомендуемой литературы
Восстановление в кислой среде металлами
Восстановление нитросоединений металлами в среде кислот как промышленный метод производства аминов в настоящее время не используется, т.к. восстановление чугунными стружками в присутствии электролитов более экономично. Однако этот способ сохранил значение как лабораторный метод получения аминов, а также как аналитический прием, позволяющий определить количество нитрогрупп в соединении.
Наиболее часто для целей восстановления в кислой среде пользуются цинком (в виде цинковой пыли) и соляной кислотой:
ArNO2
+ 3 Zn + 7 HCl![]() ArNH2·HCl
+ 3 ZnCl2
+ 2 H2O
ArNH2·HCl
+ 3 ZnCl2
+ 2 H2O
Большое значение как аналитический метод имеет восстановление нитросоединений двухлористым оловом в соляной кислоте:
ArNO2 + 3SnCl2 + 7 HCl ArNH2·HCl + 3 SnCl4 + 2 H2O
Эта реакция протекает количественно и дает возможность установить число нитрогрупп в соединениях.
Восстановление в концентрированной соляной кислоте металлами (кроме железа) приводит обычно к образованию побочных продуктов – хлорзамещенных аминов. Высокая концентрация кислоты и повышенная температура благоприятствуют вхождению галогена в ядро, вероятно, по схеме:
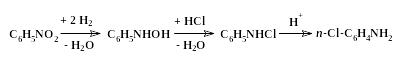
Применение железа исключает образование этих продуктов даже при работе в концентрированной соляной кислоте. Эта особенность железа как восстановителя обусловлена способностью Fе2+ легко и полностью восстанавливать образующиеся хлорамины:
C6H5NHCl + 2 FeCl2 + HCl C6H5NH2 + 2 FeCl3
Восстановление железом в кислой среде ведут при 90 – 100 С, постепенно добавляя соляную кислоту и постоянно встряхивая колбу. Так можно восстановить нитробензол в анилин, п-нитротолуол в толуидин и т.д.
Своеобразные результаты дает восстановление нитросоединений в среде серной кислоты.
Так, при действии цинковой пыли на нитробензол получается пара-аминофенол. Этот неожиданный результат объясняется образованием в качестве промежуточного продукта фенилгидроксиламина C6H5NHOH, который в момент образования под влиянием концентрированной серной кислоты перегруппировывается в аминосоединение:

Пути восстановления нитросоединений в зависимости от pH среды Восстановление в кислой среде
В каждом конкретном случае путь реакции и ее конечный продукт зависят от используемого восстановителя и от рН среды.
В кислой среде восстановление проходит через стадии 1, 2, 3, причем процесс идет настолько быстро, что промежуточные соединения: нитрозобензол и фенилгидроксиламин не могут быть выделены:
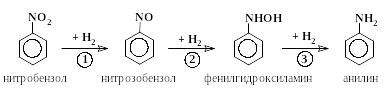
При восстановлении нитробензола цинком в водном растворе хлористого аммония может быть получен фенилгидроксиламин (уравнение 5 на стр. 111).
Восстановление в щелочной среде
Экспериментально доказано, что в щелочной среде промежуточными продуктами восстановления нитросоединений также являются нитрозобензол и фенилгидроксиламин. Однако стадия (3) сильно замедляется и ускоряется реакция (4), представляющая собой не восстановительный процесс, а конденсацию нитрозобензола и фенилгидроксиламина с выделением воды и образованием двухядерного продукта – азоксибензола. Далее в щелочной среде продолжается восстановление уже двухядерных азопроизводных (стадии 5 и 6). Превращение гидразобензола в анилин (стадия 7) в щелочной среде проходит медленно:
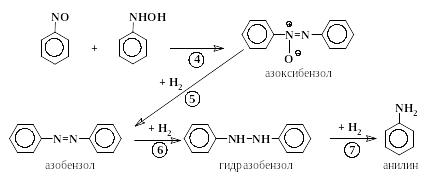
При применении цинковой пыли в щелочной среде восстановление нитросоединения проходит до гидразопроизводного:
2 ArNO2 + 5 Zn + 6H2O Ar-NH-NH-Ar + 5 Zn(OH)2
Цинковую пыль обычно берут в количестве на 10 – 15 % больше теоретически необходимого. Как следует из уравнения реакции, едкий натр в процессе восстановления не расходуется. Он необходим для поддержания щелочной реакции среды, поэтому количество его берут равным 0,1 – 0,2 моля на 1 моль нитросоединения.
Ввиду того, что исходные нитросоединения и продукты их восстановления, а также и сам восстановитель нерастворимы в водном растворе едкого натра, реакцию ведут при энергичном размешивании с той целью, чтобы реагенты могли приходить в достаточно тесное со-
прикосновение друг с другом. Для ускорения реакции иногда вводят растворители, способные растворять продукты реакции, индифферентные к участвующим в процессе веществам (спирт, бензол, толуол и др.)
Гидразосоединение выпадает в виде осадка вместе с гидроксидом цинка. Реакционную массу обычно разбавляют водой и осторожно обрабатывают разбавленной кислотой в количестве, необходимом для нейтрализации едкого натра и растворения гидроксида цинка. После этого отделяют осадок гидразосоединения фильтрованием и, если это требуется, подвергают обработке минеральной кислотой с целью проведения бензидиновой перегруппировки.

Из реакционной массы бензидин и его производные выделяют в виде хлоргидрата поваренной солью. Свободное основание получают действием на хлоргидрат щелочи.
Восстановление нитросоединений в щелочной среде с целью получения азокси- и гидразосоединений проходит с хорошим выходом и при применении электролиза. В качестве среды применяют водные или водно-спиртовые растворы едких щелочей. Этот метод имеет ряд технических преимуществ.
