
- •Химический состав нефтей
- •Классификация нефтей
- •Химические классификации.
- •Геохимические и генетические классификации.
- •Технологические классификации.
- •СВОЙСТВА НЕФТЕЙ
- •Физико-химические свойства нефтей
- •Плотность.
- •Молекулярная масса.
- •Вязкость*.
- •Теплопроводность.
- •Теплоемкость.
- •Теплота испарения.
- •Энтальпия (теплосодержание).
- •Оптическая активность.
- •Электрические свойства.
- •Коллоидные свойства нефтей
- •Коллоидно-дисперсное строение нефтяных систем.
- •ПРОИСХОЖДЕНИЕ НЕФТИ
- •ЛИТЕРАТУРА
- •Перегонка и ректификация
- •Азеотропная ректификация.
- •Экстракция и экстрактивная ректификация.
- •Адсорбционная хроматография
- •Термодиффузия
- •Диффузия через мембраны
- •Кристаллизация и экстрактивная кристаллизация
- •Образование аддуктов и комплексов
- •МЕТОДЫ ВЫДЕЛЕНИЯ И РАЗДЕЛЕНИЯ НЕУГЛЕВОДОРОДНЫХ КОМПОНЕНТОВ
- •Экологические и технологические аспекты выделения
- •Выделение гетероатомных соединений средних фракций
- •Серусодержащие соединения.
- •Образование солей и комплексов.
- •Азотсодержащие соединения.
- •Нейтральные кислородсодержащие соединения.
- •Выделение смолисто-асфальтеновых веществ
- •Разделение смолисто-асфальтеновых веществ
- •ЛИТЕРАТУРА
- •СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА НЕФТЯНЫХ ФРАКЦИЙ
- •МЕТОДЫ АНАЛИЗА ИНДИВИДУАЛЬНОГО СОСТАВА
- •Газовая хроматография
- •МЕТОДЫ АНАЛИЗА ГРУППОВОГО СОСТАВА
- •Масс-спектрометрия и хромато-масс-спектрометрия
- •Спектральный анализ
- •МЕТОДЫ АНАЛИЗА МИКРОЭЛЕМЕНТОВ
- •МЕТОДЫ СТРУКТУРНО-ГРУППОВОГО АНАЛИЗА
- •Анализ легких и средних фракций
- •Анализ смолисто-асфальтеновых веществ
- •Определение молекулярной массы асфальтенов и смол.
- •Рентгеноструктурный анализ.
- •Структура ароматических фрагментов.
- •Структура циклоалкановых фрагментов.
- •Структура алифатических фрагментов.
- •Структура фрагментов, содержащих гетеро атомы и микроэлементы.
- •Интегральный структурный анализ.
- •ЛИТЕРАТУРА
- •АЛКАНЫ
- •Физические свойства
- •Теплофизические свойства.
- •Фазовые превращения.
- •Физико-химические свойства
- •Химические превращения
- •ЦИКЛОАЛКАНЫ
- •Физические свойства
- •Химические превращения
- •АРЕНЫ
- •Состав аренов нефтей различных месторождений
- •Физико-химические свойства
- •Химические превращения
- •ГЕТЕРОАТОМНЫЕ СОЕДИНЕНИЯ СРЕДНИХ ФРАКЦИИ
- •Серусодержащие соединения
- •СМОЛИСТО-АСФАЛЬТЕНОВЫЕ ВЕЩЕСТВА
- •Физические свойства .
- •Физико-химические свойства
- •Химические превращения
- •МИКРОЭЛЕМЕНТЫ
- •ЛИТЕРАТУРА
- •АЛКАНЫ
- •Природные горючие газы.
- •Жидкие алканы.
- •Твердые алканы.
- •Белки биологического синтеза.
- •ЦИКЛОАЛКАНЫ
- •Циклогексан и продукты его химических превращений.
- •Другие циклоалканы и продукты их химических превращений.
- •АРЕНЫ
- •ГЕТЕРОАТОМНЫЕ СОЕДИНЕНИЯ СРЕДНИХ ФРАКЦИИ
- •Серусодержащие соединения.
- •Азотсодержащие соединения.
- •СМОЛИСТО-АСФАЛЬТЕНОВЫЕ ВЕЩЕСТВА
- •ЛИТЕРАТУРА

связей С—H взаимно компенсируются, независимо от симметричности углеводородного радикала. Взаимодействие двух неполярных молекул алканов происходит под действием дисперсионных сил, возникающих при взаимном обмене электронами (энергией) между молекулами.
Неполярная молекула может иметь отличающийся от нуля мгновенный дипольный момент, среднее значение которого во времени равно нулю [10]. Дисперсионная энергия 4,2 кДж/моль (энергия водородной связи 8,4—63 кДж/моль).
Низко- и высокомолекулярные алканы вступают в межмолекулярные взаимодействия, но в отличие от последних при обычных температурах ассоциатов не дают, так как прочность связей в ассоциатах из низкомолекулярных соединений мала. Для их разрушения достаточно незначительной растворяющей силы среды. Поэтому для бензиновых фракций (н.к. — 200 °C) образование ассоциатов наблюдается при низких температурах — (70 -:- 100°С).
В сопоставимых условиях алканы имеют самую низкую плотность, сравнительно с плотностью углеводородов иного строения и гетероатомных соединений нефти с таким же числом углеродных атомов в молекуле. Плотность алканов изменяется с молекулярной массой и зависит не только от числа углеродных атомов, но и от их расположения в молекуле (табл. 50).
Изменение плотности изоалканов C11H24 в зависимости от строения показано ниже:
2,3,7-Триметилоктан |
744,4 |
2,3-Диметилнонан, |
748 |
2,2,3,3-Тетраметилгептан |
768,9 |
2,6-Диметилнонан |
737 |
2,2,4-Триметилоктан |
737,9 |
3,3-Диметилнонан |
746 |
4-Метилдекан |
742,2 |
5-Этилнонан |
748 |
Теплофизические свойства.
Важнейшей характеристикой алканов является их энергоемкость (теплота сгорания). Обладая максимально возможным для углеводородов содержанием водорода в молекуле, алканы характеризуются самой большой массовой теплотой сгорания. Так, массовая теплота сгорания метана 50207, гексана 45276, эйкозана 44386 кДж/кг. Из-за низкой плотности объемная теплота сгорания алканов меньше, чем у углеводородов иного строения с таким же числом углеродных атомов в молекуле; с ростом числа атомов массовая теплота сгорания алканов падает.
Ниже показаны пределы отклонения теплоты сгорания 50-градусных фракций алканов моторных топлив в расчете на 1 кг (I), на 1 л (II) (в кДж) [11] перегонки:
180
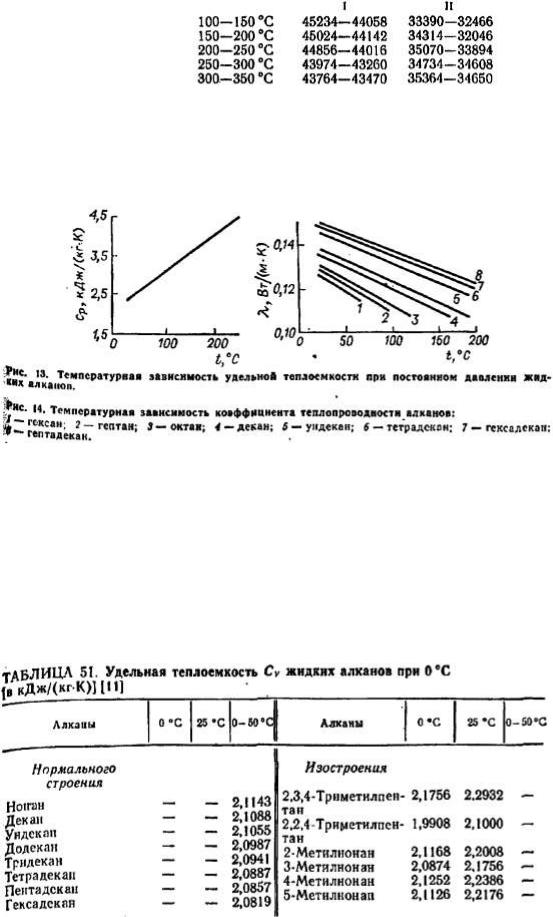
При одинаковой температуре и нормальном давлении алканы имеют более высокую теплоемкость, чем углеводороды иного строения. Так, при 80—90°C теплоемкость декана на 21 % больше, чем циклоалкана, 1,1'-бициклогексана и на 32% больше, чем у apeнбифенила, содержащих то же число углеродных атомов (табл. 5 рис. 13).
Из всех углеводородов формальные алканы характеризуются наибольшей теплопроводностью (рис. 14). При близкой молекулярной массе теплота испарения
алканов будет |
меньше |
теплоты |
испарения углеводородов иного строения в |
||
аналогичных условия. Однако разница эта мала и составляет 40—60 кДж/кг: |
|||||
Пределы |
Пределы |
|
Теплота |
|
|
перегонки, °C |
замера, °С |
|
испарения, кДж/кг |
|
|
117-160 |
50-150 |
|
281,4 |
|
|
170-200 |
100-200 |
|
268.8 |
|
|
Выше 200 |
140-200 |
|
244.9 |
|
|
Для углеводородов, кипящих в области близких температур, критические температуры алканов самые низкие. В самом гомологическом ряду критические температуры алканов изостроения ниже, чем критические температуры нормальных алканов. Эти
181
различия могут достигать 5—10°С. Критические параметры для смесей углеводородов не могут быть удовлетворительно подсчитаны по формулам, предназначенным для индивидуальных соединений. В этом случае получаются псевдокритические значения, не всегда соответствующие экспериментальным. Так, для нормальных алканов псевдокритический объем составляет 0,0043 молекулярной массы.
Vкp ≈ 0,0043м
В сопоставимых условиях алканы имеют меньшие значения поверхностного натяжения по сравнению с углеводородами иного строения и составляют 18—28 мН/м.
Весьма важная эксплуатационная и технологическая характеристика углеводородов — вязкость. При постоянной температуре вязкость растет с молекулярной массой, разветвленностью и компактностью расположения изомерных структур алканов.
Ниже представлена кинематическая вязкость алканов при (в мм2/с):
Алканы нормального строения |
Алканы изостроения |
|
||
3-Метилгептан |
0,708 |
|||
Пентан |
|
0,366 |
3,4-Диметилгексан |
0,686 |
Гептан |
|
0,601 |
2,3,3-Триметилпентан |
0,933 |
Октан |
|
0,768 |
2,2,3-Триметилпентан |
0,849 |
Нонан |
|
0,988 |
2-Метил-3-этилпентан |
0,678 |
Декан |
|
1,261 |
6-Метилнонан |
1,170 |
Додекан |
|
1.987 |
2,3-Диметилоктан |
0,984 |
Тетрадекан |
|
3,040 |
2,3,4,4-Тетраметилгексан |
1,060 |
|
|
|
2,2,4,5-Тетраметилгексан |
1,22 |
|
|
|
2,3,3,4-Тетраметилгексан |
1,063 |
Из всех углеводородов алканы отличаются наиболее низкой вязкостью в сопоставимых условиях. При понижении температуры в нормальных алканах начинается структурообразование (кристализация).
Для изоалканов эта температура намного ниже.
Фазовые превращения.
С изменением температуры алканы подвергаются фазовым превращениям. Это плавление, кристаллизация, переход из одной кристаллической модификации в другую, растворение одной фазы в другой, насыщение или пересыщение одной фазы другой. Они определяются характером сил межмолекулярного взаимодействия. Для длинноцепочечных и слабо paзветвленных алканов это аддитивные дисперсионные силы, направленные перпендикулярно, оси цепи нормального строения, что o6ycлавливает возможность сближения молекул.
При одном и том же содержании углеродных атомов в молекуле наиболее высокой температурой плавления обладают нормальные алканы, где дисперсионному взаимодействию подвергаются все углеродные атомы соседних молекул. С разветвлением структуры молекул такая возможность, вследствие их иной ориентации понижается, что объясняет более низкую температуру кристаллизации. В твердом состоянии молекула алкана расположена упорядочено, образуя кристаллы различной структуры, преимущественно большие агрегаты достаточно гибких кристаллов.
182
Процесс кристаллизации складывается из двух стадий: стадия образования центра кристаллизации (или зародышей) и стадия роста этих центров. Вторая стадия кристаллизации — многоступенчатый процесс, который по различным причинам (например, вследствие возникновения механических напряжений) может останавливаться на любой промежуточной стадии. Монокристаллы образуются только в ocoбых условиях. Обе стадии кристаллизации сильно зависят от температуры. Понижение температуры благоприятствует образованию зародышей кристаллизации, но в то же время уменьшает молекулярную подвижность, а вместе с ней и скорость роста кристаллов. Поэтому температурная зависимость скорости кристаллизации проходит через максимум.
Большинство |
алканов имеет |
несколько |
аллотропических модификаций, |
кристаллизуясь |
в гексагональных |
триклинной, |
моноклинной и орторомбичесцой |
формах. Некоторые изоалканы, преимущественно с симметричным и компактным расположением боковых цепей в молекуле, при охлаждении застывают в стекловидную массу. Все нормальные алканы с нечетным числом атомов (нечетные) углерода, начиная с C9, и с четным (четные), начиная с С36, относящиеся к полиморфным соединениям, могут кристаллизоваться во всех четырех формах [12].
При температуре большей, чем температура полиморфного перехода, все нечетные нормальные алканы образуют кристаллы гексагональной формы, а ниже этой температуры — ромбической. Для четных нормальных алканов, начиная с С24, в высокотемпературной области характерна гексагональная кристаллическая структура, которая при понижении температуры переходит в триклинную (для C18-C26) и моноклинную (для С25—С36).
Как всякий фазовый переход, преобразование кристаллической структуры сопровождается тепловым эффектом. Например, переход кристаллов из гексагональной структуры в ромбическую сопровождается тепловым эффектом в 25—29 кДж/моль, что значительно меньше теплового эффекта плавления нормальных алканов. При температуре перехода кристаллов нормальных алканов из одной модификации в другую резко изменяются их теплофизические, оптические, физико-механические а некоторые другие свойства, что имеет большое значение для практики их применения.
Нефтяной парафин, представляющий собой сложную смесь высокомолекулярных нормальных алканов, в твердом состоянии может существовать в двух аллотропических формах: гексагональной и орторомбической [13].
Для низкомолекулярных алканов температура перехода одной кристаллической структуры в другую на десятки градусов ниже температуры плавления, в то время как для высокомолекулярных алканов этот температурный интервал составляет всего 3—16 °C, а для некоторых вообще не обнаруживается. При кристаллизации из неполярных растворителей, в том числе из нефтяных фракций, образуются кристаллы орторомбической формы. Характерна ступенчатая слоистость кристаллов, т. е. каждый новый слой кристаллизуется на предыдущем, образуя пирамиду из параллельных ромбических плоскостей [14]. Из всех углеводородов наибольшие размеры кристаллов и число ромбических плоскостей имеют нормальные алканы. При кристаллизации из растворов с полярным растворителем только алканы образуют кристаллы правильной ромбической формы.
183
На примере пентаконтана (т. пл. 93 °C) на рис. 6 показаны стадии роста кристаллов в неполярном растворителе.
Скорость выделения твердой фазы из раствора на образовавшихся центрах кристаллизации в значительной мере зависит от вязкости среды, средней длины диффузионного пути молекул к центрам кристаллизации, среднего радиуса молекул твердых углеводородов и разности между концентрацией раствора и растворимостью выделившейся твердой фазы при температуре кристаллизации.
Температура кристаллизации алканов сильно различается в зависимости от их химического строения даже в пределах одного гомологического ряда при одинаковой молекулярной массе:
|
Т кип. °С |
Т кип. °С |
|
|
|
Додекан |
216,3 |
-9,6 |
2-Метилундекан |
210,5 |
-46,0 |
З-Метилундекан |
211,0 |
-58,0 |
4-Метилундекан |
207,1 |
-69,0 |
5-Метилундекан |
206,7 |
-75,0 |
Изоалканы кристаллизуются при более низкой температуре, чем их аналоги нормального строения. Разница между температурой образования первых кристаллов и плавления (исчезновения последних кристаллов в жидкости) составляет 2—20 °C [11].
Такой распространенный показатель, как температура помутнения, для алканов может служить температурой начала выделения твердой фазы или пересыщения раствора углеводородами, начинающими кристаллизоваться при данной температуре. Таким образом, температура помутнения будет одновременно и температурой начала образования двухфазной системы алканов (табл. 52) и их изомеров, но с одинаковой разветвленностью.
Из данных таблицы видно, что при одинаковой молекулярной массе изоалканы отличаются более низкими температурами кипения и особенно кристаллизации.
Алканы практически нерастворимы в воде и сами ее не растворяют. Так, в воде при 20 °C растворяется 2,065 % (по объему) бутана. В 100 г воды при 25°C растворяется 0,005 г гептана, а в 100 г гептана в таких же условиях растворяется 0,0151 г воды. Алканы растворяют хлор, бром, йод, некоторые соли, например фторид бора (Ш), хлорид кобальта (II), хлорид никеля (II), некоторые, модификации серы, фосфора, хорошо
184
