
- •Химический состав нефтей
- •Классификация нефтей
- •Химические классификации.
- •Геохимические и генетические классификации.
- •Технологические классификации.
- •СВОЙСТВА НЕФТЕЙ
- •Физико-химические свойства нефтей
- •Плотность.
- •Молекулярная масса.
- •Вязкость*.
- •Теплопроводность.
- •Теплоемкость.
- •Теплота испарения.
- •Энтальпия (теплосодержание).
- •Оптическая активность.
- •Электрические свойства.
- •Коллоидные свойства нефтей
- •Коллоидно-дисперсное строение нефтяных систем.
- •ПРОИСХОЖДЕНИЕ НЕФТИ
- •ЛИТЕРАТУРА
- •Перегонка и ректификация
- •Азеотропная ректификация.
- •Экстракция и экстрактивная ректификация.
- •Адсорбционная хроматография
- •Термодиффузия
- •Диффузия через мембраны
- •Кристаллизация и экстрактивная кристаллизация
- •Образование аддуктов и комплексов
- •МЕТОДЫ ВЫДЕЛЕНИЯ И РАЗДЕЛЕНИЯ НЕУГЛЕВОДОРОДНЫХ КОМПОНЕНТОВ
- •Экологические и технологические аспекты выделения
- •Выделение гетероатомных соединений средних фракций
- •Серусодержащие соединения.
- •Образование солей и комплексов.
- •Азотсодержащие соединения.
- •Нейтральные кислородсодержащие соединения.
- •Выделение смолисто-асфальтеновых веществ
- •Разделение смолисто-асфальтеновых веществ
- •ЛИТЕРАТУРА
- •СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА НЕФТЯНЫХ ФРАКЦИЙ
- •МЕТОДЫ АНАЛИЗА ИНДИВИДУАЛЬНОГО СОСТАВА
- •Газовая хроматография
- •МЕТОДЫ АНАЛИЗА ГРУППОВОГО СОСТАВА
- •Масс-спектрометрия и хромато-масс-спектрометрия
- •Спектральный анализ
- •МЕТОДЫ АНАЛИЗА МИКРОЭЛЕМЕНТОВ
- •МЕТОДЫ СТРУКТУРНО-ГРУППОВОГО АНАЛИЗА
- •Анализ легких и средних фракций
- •Анализ смолисто-асфальтеновых веществ
- •Определение молекулярной массы асфальтенов и смол.
- •Рентгеноструктурный анализ.
- •Структура ароматических фрагментов.
- •Структура циклоалкановых фрагментов.
- •Структура алифатических фрагментов.
- •Структура фрагментов, содержащих гетеро атомы и микроэлементы.
- •Интегральный структурный анализ.
- •ЛИТЕРАТУРА
- •АЛКАНЫ
- •Физические свойства
- •Теплофизические свойства.
- •Фазовые превращения.
- •Физико-химические свойства
- •Химические превращения
- •ЦИКЛОАЛКАНЫ
- •Физические свойства
- •Химические превращения
- •АРЕНЫ
- •Состав аренов нефтей различных месторождений
- •Физико-химические свойства
- •Химические превращения
- •ГЕТЕРОАТОМНЫЕ СОЕДИНЕНИЯ СРЕДНИХ ФРАКЦИИ
- •Серусодержащие соединения
- •СМОЛИСТО-АСФАЛЬТЕНОВЫЕ ВЕЩЕСТВА
- •Физические свойства .
- •Физико-химические свойства
- •Химические превращения
- •МИКРОЭЛЕМЕНТЫ
- •ЛИТЕРАТУРА
- •АЛКАНЫ
- •Природные горючие газы.
- •Жидкие алканы.
- •Твердые алканы.
- •Белки биологического синтеза.
- •ЦИКЛОАЛКАНЫ
- •Циклогексан и продукты его химических превращений.
- •Другие циклоалканы и продукты их химических превращений.
- •АРЕНЫ
- •ГЕТЕРОАТОМНЫЕ СОЕДИНЕНИЯ СРЕДНИХ ФРАКЦИИ
- •Серусодержащие соединения.
- •Азотсодержащие соединения.
- •СМОЛИСТО-АСФАЛЬТЕНОВЫЕ ВЕЩЕСТВА
- •ЛИТЕРАТУРА

С помощью методов масс-спектрометрии, УФ-, ИК- и ПМРспектроскопии исследовался структурно-групповой состав аренов средних и высококипящих фракций усинской (Коми АССР) [122] западно-сургутской [123], татарских [124], арланской [125], белорусских и прибалтийских [126], мангышлакской и самотлорской [127], западно-туркменской нефтей [128].
Высоким содержанием циклоалканов и гибридных циклоалка- но-аренов отличается нафталанская нефть, известная своими целебными свойствами [129]. Так, алкилбензолы фракции н. к.— 450 °C составляют 0,33% на нефть, а содержание инданов и тетралинов — 2,0 %, циклоалканобензолов — 3,0 %.
Физико-химические свойства
Арены имеют более высокую плотность и показатель преломления по сравнению с алканами и циклоалканамн. Силовые поля молекул аренов, выражаемые в виде отношений теплот испарения к объему или к площади поверхности молекул значительна выше, чем у алканов. Поэтому арены лучше адсорбируются полярными адсорбентами и избирательно растворяются в полярных растворителях.
Температура плавления аренов зависит не только от молекулярной массы, но и от формы молекул. Чем более симметричны молекулы, тем компактнее они могут упаковываться в кристалической решетке и тем выше температура кристаллизации. Taк, наиболее симметричный из изомеров ксилола — n-ксилол — имеет наибольшую температуру кристаллизации, дурол плавится значительно выше, чем другие тетраметилбензолы. Конденсированные арены с линейно аннелированными бензольными кольцами типа антрацена имеют более высокие температуры плавления, чем ангулярные изомеры типа фенантрена. Температуры кипения изомерных аренов различаются незначительно. Наиболее высокую температуру кипения имеют, как правило, изомеры с расположенными рядом алкильными группами (о-ксилол, гемимеллитол, пренитол), имеющие наибольшие значения дипольных моментов.
224
Вязкость и плотность алкилбензолов возрастает с увеличением числа метильных групп, а индекс вязкости падает [130]. Вязкость углеводородов ряда циклогексана при наличии в молекуле длинных алкильных заместителей, а также 1—2 метильных групп выше, чем у бензольных производных. Однако для триметил-производных закономерность оказывается обратной — вязкость бензольных углеводородов выше, а индекс вязкости ниже, чем у циклогексановых углеводородов. Таким образом, полиметилбензолы по вязкостным свойствам подобны конденсированным аренам.
Как известно, при гидрировании масляных фракций вязкость снижается, а индекс вязкости растет, что принималось как доказательство преобладания в масляных фракциях конденсированных аренов. Результаты работы [130] свидетельствовали о возможности высокого содержания в масляных фракциях не конденсированных, а бензольных углеводородов с одним длинным алкильным радикалом и несколькими метальными группами.
Был синтезирован ряд бензольных, бициклических аренов и их гидрированиых аналогов С12—С28 и исследованы их вязкостные свойства [131], Установлено, что арены с метилированными бензольными кольцами, имеют аномально высокие вязкость, плотность, показатель преломления, что объясняется их повышенным молекулярным взаимодействием.
Арены обладают высокой детонационной стойкостью. Значения октановых чисел для них превышают 100, поэтому их детонационную стойкость определяют методом смешения, т. е. находят октановое число или сортность смешения (табл. 73).
ТАБЛИЦА 73. Детонационная стойкость аренов [132]
|
Октановое |
|
|
Октановое |
|
|
|
Сортн |
|
число |
|
||
|
число смешения |
|
Сортность |
|||
Углеводороды |
по |
ость |
Углеводороды |
смешения |
||
смеше |
(по |
смешения |
||||
|
температурному |
|
||||
|
методу) |
ния |
|
температурн |
|
|
|
|
|
ому методу) |
|
||
|
|
|
|
|
||
Бензол |
97 |
220 |
Изопронилбензол |
100 |
280 |
|
|
|
|
|
|
|
|
Толуол |
98 |
250 |
Пропилбензол |
98 |
330 |
|
Этилбензол |
102 |
250 |
1,3,5-Триметилбензол |
105 |
360 |
|
о-Ксилол |
85 |
-15 |
трет-Бутилбензол |
94 |
365 |
|
м-Ксилол |
105 |
265 |
втор-Бутилбензол |
98 |
270 |
|
n-Ксилол |
105 |
265 |
|
|
||
|
|
|
||||
|
|
|
|
|
|
Как следует из таблицы, увеличение молекулярной массы аренов незначительно влияет на их детонационную стойкость. Увеличение числа метильных групп в мета- и параположениях ведет к повышению детонационной стойкости, в орто-положении — к ее снижению. Учитывая высокие значения октановых чисел аренов, при компаундировании бензинов используют индивидуальные соединения (толуол, изопропилбензол, этилбензол) или нефтепродукты с высоким их содержанием, в частности катализаты риформинга.
Арены характеризуются иаихудшей воспламеняемостью, наименьшими значениями цетановых чисел. Например, цетановое число 1-метилнафталина 0, гексаметилбензола
225
26 [132]. Поэтому, газойлевые фракции и продукты вторичного происхождения с высоким содержанием аренов в быстроходных дизелях не применяют.
Арены способны образовывать достаточно стабильные комплексы с рядом полярных соединений.
Исследовалась ассоциация индивидуальных аренов — гомологов нафталина [91], бифенила, их смесей [133], а также смесей с сераорганическими соединениями [134]. Установлено образование π-комплексов между аренами и сераорганическими соединениями, содержащими π-электронную систему. Образование подобных ассоциатов затрудняет разделение аренов и сераорганических соединений.
Полициклические арены способны к образованию иглоподобных или пластинчатых, структурных элементов. Надмолекулярные структуры, образующиеся на первом этапе (мезофаза), отличаются от изотропной массы большей упорядоченностью, плотностью, характером растворимости в растворителях.
Для аренов характерна совокупность ряда физических свойств и структурных особенностей [135]: 1) характер связей С—С промежуточный между простыми и двойными; 2) равноценность всех С—С-связей в незамещенных моноциклических, системах; 3) плоское или почти плоское строение цикла; 4) поглощение света при сравнительно больших длинах волн; 5) легкая поляризуемость; 6) анизотропия диамагнитной восприимчивости.
Химические превращения
Химический критерий ароматичности определяется также совокупностыо ряда свойств: 1) легкость образования ароматических колец в различных реакциях; 2) стабильность ароматических систем, в частности труднее протекают реакции присоединения по кратным связям; 3) легкость замещения водорода на различные группы в реакциях электрофильного замещения; 4) характерные свойства некоторых заместителей в аренах (кислые свойства ароматического гидроксила, ослабленная основность аминогруппы, малая реакционная способность галогена и др.)..
История развития представлений об ароматичности рассмотрена в обзорах [136, 137].
Хюккель впервые применил метод молекулярных орбиталей и сформулировал правило ароматичности [138]: относительно стабильны моноциклические плоские sр2-гибридизованиые соединения с числом делокализованных π-электронов 4n + 2 (где n 0, 1, 2 и т. д.).
Предложены различные критерии ароматичности [139—141]: энергия делокализации или энергия резонанса; энергия резонанса, отнесенная к числу π-электронов [142]; энергия резонанса, рассчитанная методом молекулярных орбиталей в самосогласованном поле (ССП МО) [143]; длина углерод-углеродной связи [144]; делокализация электронов в виде анизотропии диамагнетизма (кольцевых токов в спектрах ПМР) [145].
В обзорной работе [146] отмечается, что ни один из предложенных индексов ароматичности не избегает противоречия с химическим понятием об ароматичности,
226

как склонности к реакциям замещения, а не присоединения. Эти противоречия связаны с определением индексов ароматичности из свойств основного состояния молекул. Поэтому предложено разделить понятия ароматичности, и стабильности молекул и определять ароматичность, основываясь на разности в энергиях исходных молекул и продуктов реакции.
Как отмечалось выше, для аренов наиболее характерны реакции электрофильного замещения.
Механизм электрофильного ароматического замещения может быть представлен следующим образом [147]:
Электрофильному замещению, предшествует кислотно-основная реакция, генерирующая атакующую электрофильную частицу E+ (табл. 74).
К реакциям электрофильного замещения в ароматическом ядре относятся:
227
1)нитрование азотной кислотой или ее смесями с серной кислотой [148];
2)галогенирование молекулярными галогенами или в присутствии кислот Льюиса (AlCl3, FeCl3, и т. д.), а также гипогалокислотами в кислом растворе [149, 150];
3)сульфирование серной кислотой, серным ангидридом, хлорили фторсульфоновой кислотой [151];
4)алкилирование [152, 153] и ацилирование [154] по Фриделю — Крафтсу. К реакциям этого типа относят хлорметилирование [155], формилирование оксидом углерода (II), ацилирование цианидами металлов или нитрилами, ацилирование амидами кислот по Вильсмейеру — Хааку [156], металлирование, в частности меркурирование солями ртути [157]. Такие слабо электрофильные реагенты, как ионы диазония реагируют с образованием азосоединений только при наличии в ароматическом кольце сильных электронодонорных заместителей, например аминоили гидроксигрупп [158].
Образовавшийся электрофил Е+ взаимодействует с ароматическим соединением, причем на первой стадии, быстрой и обратимой, получается π-комплекс. На следующей стадии — образовании несколько более стабильного σ-комплекса — определяется место замещения по отношению к имеющимся в кольце заместителям. Превращение σ-комплекса в продукт или в исходные вещества зависит от относительной легкости отщепления электрофила и протона. Для большинства электрофилов скорость отщепления ниже, чем протона, при этом образование σ-комплекса практически необратимо.
При исследовании механизма реакции электрофильного замещения применялся изотопный метод [159]. Оказалось, что соединения, меченные дейтерием и тритием, замещаются с такой же скоростью, как и водородсодержащие аналоги, т. е. заметного изотопного кинетического эффекта для большинства реакций не наблюдается. Учитывая, что энергия разрыва связей углерод — дейтерий и углерод — третий выше, чем энергия связи С—Н, можно заключить, что последняя стадия реакций электрофильного замещения — отрыв протона — не должна быть лимитирующей. Поскольку образование π-комплексов — быстрый процесс, то в качестве лимитирующей стадии остается изомеризация π-комплекса в σ-комплекс.
Однако для ряда реакций электрофильного замещения (например, сульфирования) обнаружен первичный изотопный эффект — отношение Kн/KD = 1,2 -:- 2 [160].
Реакции нуклеофильного ароматического замещения характерны для активированных ароматических соединений. При этом нуклеофильные реагенты, такие, как Br-, SR-, или NR3 замещают ранее содержавшиеся заместители типа Cl, NO2 или N2+.
Арены значительно менее склонны и к реакциям присоединения по сравнению с алкенами и циклоалкенами. Однако при достаточно жестких условиях даже бензол способен присоединять водород, хлор, бром, озон, превращаясь соответственно в циклогексан, гексахлорили гексабромциклогексан, триозонид. Реакция присоединения диазоуксусного эфира к бензолу протекает с отщеплением азота и образованием эфира норкарадиенкарбоновой кислоты:
228
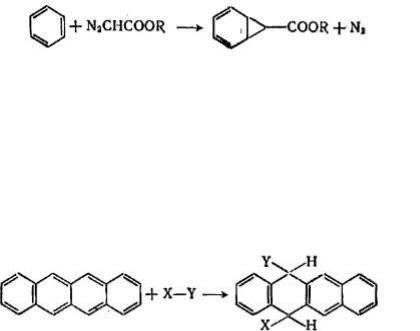
В отличие от бензола углерод-углеродные связи в молекулах нафталина и полициклических конденсированных аренов неравноценны, поэтому они легче вступают в реакции присоединения. Так, в молекуле нафталина связи 1—2, 3—4, 5—6 и 7—8 имеют более высокий порядок и меньшую длину, чем связи 2—3 и 6—7. В молекуле фенантрена наибольшая электронная плотность отмечается для связи 9—10 и т. д. Естественно, что реакции присоединения идут по связям с более высоким порядком и с большей скоростью, чем для бензола. Такие полициклические арены как антрацен, нафтацен легко вступают в реакции присоединения по центральным циклам:
Причина легкого протекания реакций присоединения в этих случаях состоит в том, что получающиеся соединения с разделенными-ароматическими циклами могут иметь примерно такую же или даже более высокую энергию стабилизации, чем исходные конденсированные углеводороды.
В связи с тем, что химические свойства аренов подробно рассмотрены во многих монографиях и учебных пособиях, в данной главе этот вопрос изложен кратко.
Важное значение для получения, очистки и использования нефтепродуктов имеют вопросы окисляемости углеводородов кислородом воздуха в жидкой фазе [161, 162]. Определенные закономерности окисления аренов отмечены в работах [160, 161],
Арены, лишенные боковых цепей, окисляются труднее, чем циклоалканы и алканы. С увеличением числа колец в молекуле арены становятся более реакционноспособными. Окисление этих углеводородов в основном протекает с образованием фенолов и продуктов уплотнения, и лишь в незначительной степени происходит расщепление колец.
Арены с короткими алифатическими боковыми цепями и полициклические углеводороды, циклы которых соединены промежуточной цепочкой углеродных атомов (дифенилметан и т. п.) менее стойки к окислительному воздействию кислорода. При их окислении образуются также в основном фенолы и продукты конденсации (смолы).
С увеличением числа боковых цепей и их длины способность соединений к окислению молекулярным кислородом возрастает, при этом содержание продуктов уплотнения падает и увеличивается содержание кислот.
Усложнение структуры молекулы арена, несимметричность ее строения, наличие третичного углеродного атома ведут к уменьшению стойкости ее против воздействия молекулярного кислорода.
229
