
- •Химический состав нефтей
- •Классификация нефтей
- •Химические классификации.
- •Геохимические и генетические классификации.
- •Технологические классификации.
- •СВОЙСТВА НЕФТЕЙ
- •Физико-химические свойства нефтей
- •Плотность.
- •Молекулярная масса.
- •Вязкость*.
- •Теплопроводность.
- •Теплоемкость.
- •Теплота испарения.
- •Энтальпия (теплосодержание).
- •Оптическая активность.
- •Электрические свойства.
- •Коллоидные свойства нефтей
- •Коллоидно-дисперсное строение нефтяных систем.
- •ПРОИСХОЖДЕНИЕ НЕФТИ
- •ЛИТЕРАТУРА
- •Перегонка и ректификация
- •Азеотропная ректификация.
- •Экстракция и экстрактивная ректификация.
- •Адсорбционная хроматография
- •Термодиффузия
- •Диффузия через мембраны
- •Кристаллизация и экстрактивная кристаллизация
- •Образование аддуктов и комплексов
- •МЕТОДЫ ВЫДЕЛЕНИЯ И РАЗДЕЛЕНИЯ НЕУГЛЕВОДОРОДНЫХ КОМПОНЕНТОВ
- •Экологические и технологические аспекты выделения
- •Выделение гетероатомных соединений средних фракций
- •Серусодержащие соединения.
- •Образование солей и комплексов.
- •Азотсодержащие соединения.
- •Нейтральные кислородсодержащие соединения.
- •Выделение смолисто-асфальтеновых веществ
- •Разделение смолисто-асфальтеновых веществ
- •ЛИТЕРАТУРА
- •СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА НЕФТЯНЫХ ФРАКЦИЙ
- •МЕТОДЫ АНАЛИЗА ИНДИВИДУАЛЬНОГО СОСТАВА
- •Газовая хроматография
- •МЕТОДЫ АНАЛИЗА ГРУППОВОГО СОСТАВА
- •Масс-спектрометрия и хромато-масс-спектрометрия
- •Спектральный анализ
- •МЕТОДЫ АНАЛИЗА МИКРОЭЛЕМЕНТОВ
- •МЕТОДЫ СТРУКТУРНО-ГРУППОВОГО АНАЛИЗА
- •Анализ легких и средних фракций
- •Анализ смолисто-асфальтеновых веществ
- •Определение молекулярной массы асфальтенов и смол.
- •Рентгеноструктурный анализ.
- •Структура ароматических фрагментов.
- •Структура циклоалкановых фрагментов.
- •Структура алифатических фрагментов.
- •Структура фрагментов, содержащих гетеро атомы и микроэлементы.
- •Интегральный структурный анализ.
- •ЛИТЕРАТУРА
- •АЛКАНЫ
- •Физические свойства
- •Теплофизические свойства.
- •Фазовые превращения.
- •Физико-химические свойства
- •Химические превращения
- •ЦИКЛОАЛКАНЫ
- •Физические свойства
- •Химические превращения
- •АРЕНЫ
- •Состав аренов нефтей различных месторождений
- •Физико-химические свойства
- •Химические превращения
- •ГЕТЕРОАТОМНЫЕ СОЕДИНЕНИЯ СРЕДНИХ ФРАКЦИИ
- •Серусодержащие соединения
- •СМОЛИСТО-АСФАЛЬТЕНОВЫЕ ВЕЩЕСТВА
- •Физические свойства .
- •Физико-химические свойства
- •Химические превращения
- •МИКРОЭЛЕМЕНТЫ
- •ЛИТЕРАТУРА
- •АЛКАНЫ
- •Природные горючие газы.
- •Жидкие алканы.
- •Твердые алканы.
- •Белки биологического синтеза.
- •ЦИКЛОАЛКАНЫ
- •Циклогексан и продукты его химических превращений.
- •Другие циклоалканы и продукты их химических превращений.
- •АРЕНЫ
- •ГЕТЕРОАТОМНЫЕ СОЕДИНЕНИЯ СРЕДНИХ ФРАКЦИИ
- •Серусодержащие соединения.
- •Азотсодержащие соединения.
- •СМОЛИСТО-АСФАЛЬТЕНОВЫЕ ВЕЩЕСТВА
- •ЛИТЕРАТУРА
ЦИКЛОАЛКАНЫ
В настоящее время наибольшее практическое применение получили циклогексан и продукты его химических превращений, а также адамантан, которому в последние годы уделяется все возрастающее внимание.
Циклогексан и продукты его химических превращений.
Наибольшее промышленное значение в качестве химического сырья приобрел циклогексан. На его основе получают важные промежуточные продукты для производства полиамидных волокон и химических реагентов [28]. До 90% циклогексана используется в производстве волокон, выпуск которых только в капиталистических странах превысил 2,5 млн. т/год (США производят более 1 млн. т/год). Среднегодовые темпы роста потребления циклогексана до 1985 г. прогнозируются по странам Западной Европы — 3%, США — 4—7%.
Ниже приведены потребности в циклогексане развитых капиталистических стран (в млн. т/год):
|
1976 г. |
1980 г. |
1985 г. |
США |
0,99 |
1,3 |
1,7-1,8 |
Страны Западнoй Европы |
0,93 |
1,0 |
1,1-1,2 |
Япония |
0,50 |
0,6 |
0,6 - 0,7 |
|
|
|
|
Основной источник получения циклогексана — нефть. Главный метод — гидрирование бензола (95% общего объема производства), остальное количество циклогексана выделяют из бензиновых фракций нефтей, богатых циклоалканами. Гидрирование бензола позволяет получать наиболее чистый циклогексан (99,9 %). Для выделения циклогексана из нефтепродуктов получают узкие фракции нефти, обогащенные углеводородами C6 и содержащие 10—14 % циклогексана. Затем производят четкую ректификацию на фракции, являющиеся концентратами с содержанием до 85 % циклогексана. При использовании дополнительных промежуточных стадий каталитического превращения аренов возможно получение фракций с содержанием 99 % циклогексана.
Основное использование циклогексана — в производстве мономеров для синтеза волокон (адипиновой кислоты и капролактама). Некоторое количество циклогексана применяют в качестве растворителя в производстве пластмасс и синтетического каучука. Производные циклогексана (циклогексанон, циклогексанол, нитроциклогексан) используются в небольшом количестве в производстве красителей, лаков, смол, смазок (из нефтяных остатков) и инсектицидов. Примерная структура потребления циклогексана в США: производство адипиновой кислоты — 60%, капролактама — 30 %, остальные производства — 10 %.
Получаемый на основе циклогексана капролактам является сырьем для получения найлона-6, суммарные мощности по производству которого в капиталистических странах более 2 млн. т/год. Найлон-6 применяют для производства кордной ткани, ковров и других предметов широкого потребления.
Адипиновую кислоту получают окислением циклогексана в две стадии:
313
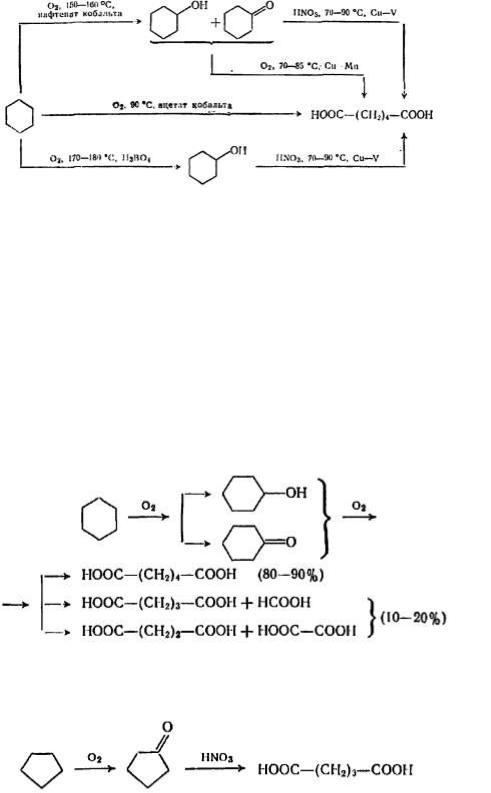
Наиболее перспективны для получения адипиновой кислоты одностадийные методы окисления, базирующиеся на использовании кобальтовых катализаторов. При 90 °C циклогексан окисляют в течение 8—10 ч кислородом воздуха в среде уксусной кислоты. При этом достигается степень превращения циклогексана 80— 90 % и 70—80 % выход кислоты.
Получаемая из циклогексана адипиновая кислота на 90 % используется как промежуточный продукт для синтеза мономера гексаметилендиамина и далее найлона-66 (продукт конденсации адипиновой кислоты и гексаметилендиамина).
Побочными продуктами окисления циклогексана являются ценные дикарбоновые кислоты [28]:
Глутаровую кислоту также получают окислением циклопентана по способу, аналогичному производству адипиновой кислоты [28]:
Другие циклоалканы и продукты их химических превращений.
Окислением циклоалканов получают большое число ценных химических продуктов. Степень превращения обычно составляет 10— 15% для циклогексана, 35% для циклододекана, суммарный выход спиртов и кетонов составляет 80—95 %.
Селективность процесса окисления и регулирование степени превращения исходного углеводорода достигается добавлением в реакционную смесь борной кислоты и ее производных [31].
314
Окислением соответствующих по числу углеродных атомов циклоалканов можно получать и другие дикарбоновые кислоты: пимелиновую (C7), пробковую (C8), себациновую (С10), декандикарбоновую (C12). Однако в отличие от нефтяного циклогексана другое циклоалкановое сырье получают многостадийными синтезами, обусловливающими высокую стоимость конечных продуктов.
Производство дикарбоновых кислот относится к малотоннажным. Эфиры дикарбоновых кислот применяются для получения синтетических смазочных масел, диметиловые эфиры адипиновой, глутаровой и янтарной кислот — для получения лакокрасочных материалов н пластификаторов пластмасс [28].
Окислительным дегидрированием циклогексана на природных цеолитах получают циклогексен [29]. Процесс осуществляют в проточной установке с неподвижным слоем катализатора при 400—450 °C, отношении O2:C2H12 — 1,0÷1,5. Селективность реакции по циклогексену 68—83 %, выход — более 20 %.
На базе производных циклогексана и циклопентана получают фосфорорганические ПАВ циклоалканового ряда, содержащие в молекуле амидо- и дитиофосфорные группы [30]. ПАВ — продукты конденсации нефтяных кислот с этаноламином, взаимодействия получаемых оксиамидов нефтяных кислот с пентасульфидом фосфора и нейтрализации дитиофосфорных кислот едким натром. Оксиамиды получают при взаимодействии нефтяных кислот с избытком аминоспирта при 150—180 °C в течение 4 ч. Оксиамиды обрабатывают в течение 5 ч пентасульфидом фосфора при соотношении реагирующих веществ 4:1 и 100—120 °С. Использование ПАВ, как добавки в скважины и трубопроводы при добыче и транспортировании парафинистых нефтей снижает отложение твердых парафинов на 86—95 %.
Селективным окислением циклододекана в присутствии метаборной кислоты или ее ангидрида в промышленности получают циклододеканол и циклогексанол [32, 33]. Недостатком борной кислоты является необходимость использования сложного процесса для регенерации сухой кислоты. Поэтому предпочтительнее использование ее эфиров, растворимых в углеводородах. Окисление циклододекана осуществляют чистым кислородом или воздухом в течение 1 ч при 168 °C в присутствии борной кислоты, эфиров метаборной кислоты. В присутствии 12 % добавок возможно превращение 70—95 % циклододекана в циклододеканол и циклододеканон.
Фотонитрозированием циклододекана получают хлоргидрат циклододеканоноксима, применяемого в производстве додекалактама. Процесс осуществлялся в фотореакторе (ССl4, облучение УФ-светом, 20°С) при пропускании хлороводорода, нитрозилхло-
рида [34].
На основе производных циклопентаиа и циклогексана получены новые соединения с активными функциональными группами в молекуле [35]. Например, конденсация циклопентанона и циклогексанона при 20°С, в присутствии 10— 15%-ного раствора едкого кали с альдегидами приводит к образованию галогенпроизводных циклоалкано-аренов по схеме:
315
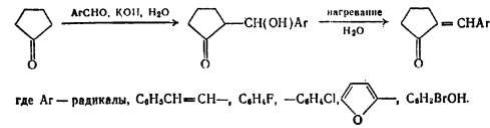
При использовании для конденсации альдегидов типa коричного, о-фтор-, м-хлор-, 2-гидрокси-3,5-дибромбензальдегидов и фурфурола были получены соединения 2-(β-фенилпропенилиден)цикло-гексанон, 2-(β-фенилпропенилиден) циклопентанон, 2-(о-фторбен- зилиден)циклогексанон с выходом 74—81,5%, которые находят применение как физиологически активные соединения и медицинские препараты
[35—37].
Предложена технологическая схема получения нефтяных кислот и сложноэфирных пластификаторов окислением циклоалканового концентрата (250—350°С), содержащего циклопентаны и циклогексаны с боковыми углеводородными радикалами C6—C15 [40]. Полученные эфиры являются пластификаторами, близкими к дибутилфталату и дибутилсебацинату.
Получают нефтяные кислоты для замены мылонафта, асидола и асидол-мылонафта, применяемых в производстве олифы, консистентных смазок, моющих средств, анилиновых красителей, используемых при флотации руд и как технические заменители животных и растительных жиров.
Циклоалканы обладают оптимальными характеристиками в качестве компонентов авиационных и ракетных топлив. Углеводородные топлива с точки зрения обеспечения наибольшей дальности полета летательных аппаратов должны иметь максимально возможную плотность, массовую и объемную теплоту сгорания. Желательно, чтобы при этом разница между значениями массовой и объемной теплоты сгорания была наименьшей. Этим условиям в наилучшей степени удовлетворяют циклоалканы нефтяных фракций (табл. 116) [41].
ТАБЛИЦА 116. Низшая теплота сгорания углеводородов различных классов
|
Моноциклоарены |
Циклоалканы |
Алканы |
||||
Фракция |
|
|
|
|
|
|
|
МДж/кг |
МДж/л |
МДж/кг |
МДж/л |
МДж/кг |
МДж/л |
||
|
|||||||
|
|
|
|
|
|
|
|
100-150 °C |
41,3-41,7 |
34,4-35,4 |
42,8-43,4 |
31,0-35.6 |
43,9-45,2 |
32,4-33.4 |
|
|
|
|
|
|
|
|
|
150-200 °C |
40,5-42,0 |
34,8-37.4 |
42,4-43,8 |
31,8-36,1 |
44,1-45,0 |
32,0-34,3 |
|
200-250 °C |
41,2-41,7 |
36,1-38,7 |
42,3-43,6 |
32,3-36,4 |
43,9-44,8 |
33,8-35,0 |
|
250-300 °C |
41,0-41,8 |
36,3-39,2 |
42,3-43,4 |
32,9-37,1 |
43,2-43,9 |
34,5-34,7 |
|
300-350 °C |
41,7-41,8 |
36,8-38,4 |
42,3-43.0 |
34,0-36,8 |
43,4-43,7 |
34,6-35,3 |
|
Большой интерес в качестве перспективных топлив представляют полициклические индивидуальные циклоалканы нефтяного или синтетического происхождения, характеризующиеся высокой плотностью, повышенными теплотами сгорания (массовой и объемной) и благоприятными физическими показателями, например диэтилциклогексан и др. [41].
316
