
- •Химический состав нефтей
- •Классификация нефтей
- •Химические классификации.
- •Геохимические и генетические классификации.
- •Технологические классификации.
- •СВОЙСТВА НЕФТЕЙ
- •Физико-химические свойства нефтей
- •Плотность.
- •Молекулярная масса.
- •Вязкость*.
- •Теплопроводность.
- •Теплоемкость.
- •Теплота испарения.
- •Энтальпия (теплосодержание).
- •Оптическая активность.
- •Электрические свойства.
- •Коллоидные свойства нефтей
- •Коллоидно-дисперсное строение нефтяных систем.
- •ПРОИСХОЖДЕНИЕ НЕФТИ
- •ЛИТЕРАТУРА
- •Перегонка и ректификация
- •Азеотропная ректификация.
- •Экстракция и экстрактивная ректификация.
- •Адсорбционная хроматография
- •Термодиффузия
- •Диффузия через мембраны
- •Кристаллизация и экстрактивная кристаллизация
- •Образование аддуктов и комплексов
- •МЕТОДЫ ВЫДЕЛЕНИЯ И РАЗДЕЛЕНИЯ НЕУГЛЕВОДОРОДНЫХ КОМПОНЕНТОВ
- •Экологические и технологические аспекты выделения
- •Выделение гетероатомных соединений средних фракций
- •Серусодержащие соединения.
- •Образование солей и комплексов.
- •Азотсодержащие соединения.
- •Нейтральные кислородсодержащие соединения.
- •Выделение смолисто-асфальтеновых веществ
- •Разделение смолисто-асфальтеновых веществ
- •ЛИТЕРАТУРА
- •СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА НЕФТЯНЫХ ФРАКЦИЙ
- •МЕТОДЫ АНАЛИЗА ИНДИВИДУАЛЬНОГО СОСТАВА
- •Газовая хроматография
- •МЕТОДЫ АНАЛИЗА ГРУППОВОГО СОСТАВА
- •Масс-спектрометрия и хромато-масс-спектрометрия
- •Спектральный анализ
- •МЕТОДЫ АНАЛИЗА МИКРОЭЛЕМЕНТОВ
- •МЕТОДЫ СТРУКТУРНО-ГРУППОВОГО АНАЛИЗА
- •Анализ легких и средних фракций
- •Анализ смолисто-асфальтеновых веществ
- •Определение молекулярной массы асфальтенов и смол.
- •Рентгеноструктурный анализ.
- •Структура ароматических фрагментов.
- •Структура циклоалкановых фрагментов.
- •Структура алифатических фрагментов.
- •Структура фрагментов, содержащих гетеро атомы и микроэлементы.
- •Интегральный структурный анализ.
- •ЛИТЕРАТУРА
- •АЛКАНЫ
- •Физические свойства
- •Теплофизические свойства.
- •Фазовые превращения.
- •Физико-химические свойства
- •Химические превращения
- •ЦИКЛОАЛКАНЫ
- •Физические свойства
- •Химические превращения
- •АРЕНЫ
- •Состав аренов нефтей различных месторождений
- •Физико-химические свойства
- •Химические превращения
- •ГЕТЕРОАТОМНЫЕ СОЕДИНЕНИЯ СРЕДНИХ ФРАКЦИИ
- •Серусодержащие соединения
- •СМОЛИСТО-АСФАЛЬТЕНОВЫЕ ВЕЩЕСТВА
- •Физические свойства .
- •Физико-химические свойства
- •Химические превращения
- •МИКРОЭЛЕМЕНТЫ
- •ЛИТЕРАТУРА
- •АЛКАНЫ
- •Природные горючие газы.
- •Жидкие алканы.
- •Твердые алканы.
- •Белки биологического синтеза.
- •ЦИКЛОАЛКАНЫ
- •Циклогексан и продукты его химических превращений.
- •Другие циклоалканы и продукты их химических превращений.
- •АРЕНЫ
- •ГЕТЕРОАТОМНЫЕ СОЕДИНЕНИЯ СРЕДНИХ ФРАКЦИИ
- •Серусодержащие соединения.
- •Азотсодержащие соединения.
- •СМОЛИСТО-АСФАЛЬТЕНОВЫЕ ВЕЩЕСТВА
- •ЛИТЕРАТУРА
Всего идентифицировано 14 стеранов и 34 тритерпана.
В мангышлакской нефти методом хромато-масс-спектрометрии идентифицированы моноциклоалканы С10—C22, принадлежащие к гомологическому ряду транс-1,1,3-метил-2-алкилциклогексана [64]. Алкильные заместители в углеводородах, начиная с С14, имели изопреноидный тип строения:
Углеводороды подобного строения содержались во фракции 180—400°C, выход которой на нефть составил 40%. По данным масс-спектрометрических исследований во фракции циклоалканоизоалканов содержалось (в %): 31,4 изоалканов, 26,4 моноциклоалканов, 23,7 би-, 11,9 три-, 6,6 тетрациклоалканов.
Таким образом, в низкокипящих фракциях нефтей содержатся преимущественно алкилпроизводные циклопентана и циклогексана, в высококипящих фракциях — полициклоалканы и моноциклоалканы изопреноидного строения.
Химические превращения
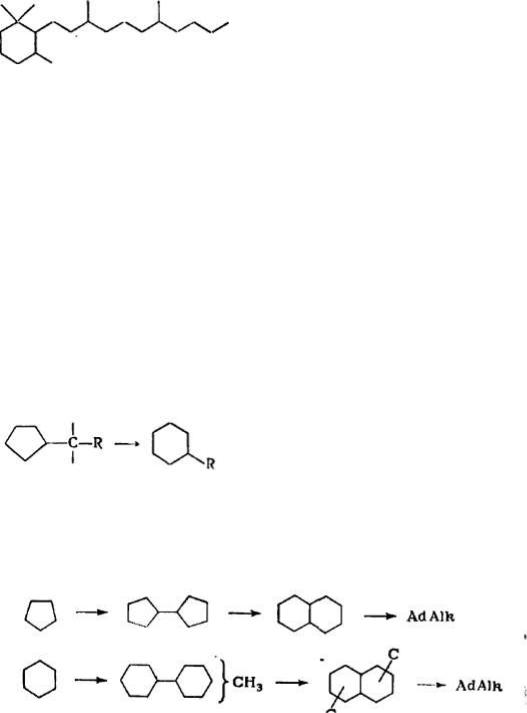
Изомеризация.
Пятичленные циклоалканы в составе нефтяных фракций могут превращаться в циклогексаны [56]. Расширение цикла происходит за счет включения в него α-углеродных атомов боковой цепи по схеме:
В зависимости от условий реакции изомеризации возможно протекание процессов образования 1,1'-бициклопентила или 1,1'- бициклогексила, декалинов и в конечном счете алкилированных производных адамантана (Ad), имеющих устойчивую с минимально напряженными связями молекулу:
Реакции протекают в несколько стадий, катализаторы — галогениды алюминия. При 40—60 °C циклогексан образует смесь диметилдекалинов, при 140—160 °C — алкиладамантаны [65].
При нагревании циклогептана с хлоридом алюминия в течение 20 ч происходит его изомеризация с образованием смеси 97 % метилциклогексана и 3%
205
диметилциклопентана. При 200 °C в присутствии никелевого катализатора циклооктан изомеризуется в метилциклогептан и диметилциклогексан.
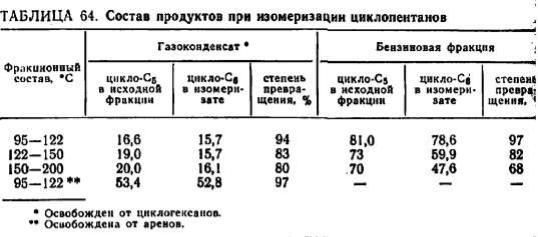
Реакция изомеризации алкилциклопентанов, содержащихся в нефтяных фракциях, может использоваться для получения ценного нефтехимического сырья — циклогексанов (табл. 64).
Процесс протекает селективно с высоким выходом фракции С7—C9. Изомеризация этилциклопентана осуществляется при 60 °C в течение 7 на катализаторе со степенью превращения 93—96 % [58].
Процесс изомеризации циклопентанов непосредственно в бензиновых фракциях газоконденсатов и нефтей, содержащих бoлее 20—50% циклоалканов, в том числе l/2-:-1/3 циклопентанов, особенно интересен в сочетании с последующим дегидрированием изомеризатов циклогексанов и селективной экстракцией аренов. Повидимому, вместо дегидрирования возможно выделение циклогексанов из изомеризата комплексообразованием с тиокарбамидом [66].
Дегидрирование.
В зависимости от строения циклоалканов при дегидрировании могут быть получены моно-, би- и полицикличскне арены. Например, образование алкилбензола из циклогексанов происходит при нагревании в присутствии катализатора — платинированного угля, содержащего 18 % платины или 2 % железа и 20 % платины
[67].
Реакция дегидрирования широко используется для изучения индивидуального и группового состава циклоалканов различных фракций нефти, а также лежит в основе промышленного процесса облагораживания прямогонных бензинов каталитического риформинга [68]. При риформинге одновременно протекают процессы дегидрогенизации гексанов, дегидроциклизации нормальных алканов и изомеризации пятичленных циклоалканов в шестичленные. Риформинг проводится при 480—500°C, давлении 3,6—4,0 МПа. Применяется бифункциональный катализатор АП-64, содержащий 0,60—0,65 % платины (дегидрирующий катализатор) на оксиде алюминия (изомеризующий катализатор). Более эффективен полиметаллический платино-рениевый катализатор типа KP-102, КР-104А, позволяющий осуществлять
206
риформинг при меньшем давлении 1,4—2,0 МПа. В процессе риформинга сырье претерпевает следующие изменения:
|
АП-64 |
KP-104A |
|
Сырье (бензин) |
|
|
|
|
|
|
|
Пределы перегонки, °C |
80-173 |
102-176 |
|
Массовое содержание углеводородов, % |
29,0 |
30,6 |
|
циклоалканов |
|||
|
|
||
аренов |
8,7 |
8,3 |
|
алканов |
62,2 |
60,8 |
|
алкенов |
0,1 |
0,1 |
|
Катализат |
|
|
|
|
|
|
|
Массовое содержание углеводородов, % |
61,6 |
65,6 |
|
аренов |
|||
|
|
||
алканов |
34,4 |
30,6 |
Термическая деструкция и гидрогенолиз.
Пиролиз проводят при 500—550 °С, как это имеет место при изучении структуры углеводородов нефтяных фракций в лабораторных условиях. При этом циклоалканы деструктируют. Газохроматографическим методом идентифицируют продукты разложения циклоалканов [67]:
Термическая деструкция циклоалканов происходит при промышленном пиролизе нефтяных фракций в трубчатых печах [57]. При 840—860 °C, времени превращения 0,4—0,5 с получают в числе других многочисленных продуктов (этилена, пропилена, бутадиена) бензол и из него последующей переработкой — циклогексан для производства капролактама. Сырье с высоким содержанием алканов, например бензин-рафинат 60—140 °C, позволяющее получать арены, алкены и затем циклоалканы, имеет следующий состав (в %):
Нормальные алканы |
39,4 |
Изоалканы |
49,7 |
Циклоалканы |
4,0 |
в том числе |
|
метилциклопентан |
2,7 |
циклогексан |
1,3 |
Весьма высокой термической устойчивостью обладает адамантан или трицикло[3.3.1.13,7]декан — трициклический циклоалкан, впервые обнаруженный в нефтях в 1933 г. [67] и имеющий следующую упрощенную структуру:
207
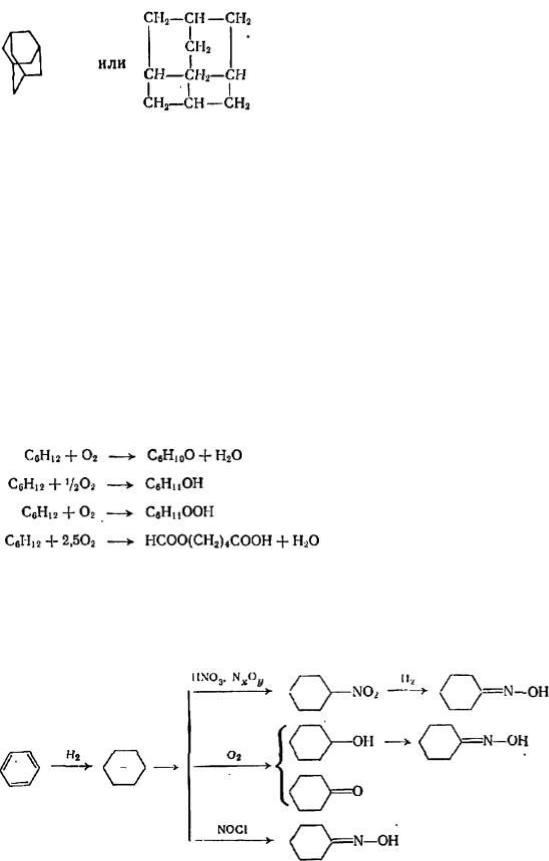
Адамантан обладает устойчивой структурой с минимально напряженными связями. Его термическая деструкция начинается пpи 660 °C и завершается на 94 % при 675°C образованием алкенов и аренов [67]. В присутствии алюмосиликатного или алюмохромового катализатора адамантан превращается в продукты разложения при 550—570 °С. В среде водорода в контакте с катализаторами на кизельгуре происходит гидрогенолиз адамантана: на никелевом катализаторе при 300—500 °C, на иридиевом или платиновом при 500—550 °С образуются газообразные вещества, бензол, нафталин и др.
Окисление.
Большое практическое значение имеет реакция окисления циклогексана, в результате которой образуются циклогексанон, циклогексанол, гидропероксид циклогексила, адипиновая кислота и побочные вещества (вода, кислоты, эфиры) [69]:
В газовой фазе некаталитическое окисление циклогексана кислородом воздуха происходит при нагревании смеси до 340 °C. Жидкофазное окисление происходит при 130—160 °C, давлении 1—10 МПа при взаимодействии с кислородсодержащими соединениями или молекулярным кислородом по схемам [69—71]:
Схема получения капролактама включает гидрирование бензола в циклогексан при 320—360 °Ct давлении 30 МПа, катализатор — сульфиды никеля и вольфрама. Циклогексан окисляют в циклогексаноксим и последний изомеризуют в ε-капролактам
— сырье для производства капрона. Исходным продуктом вместо бензола может служить циклогексан.
208
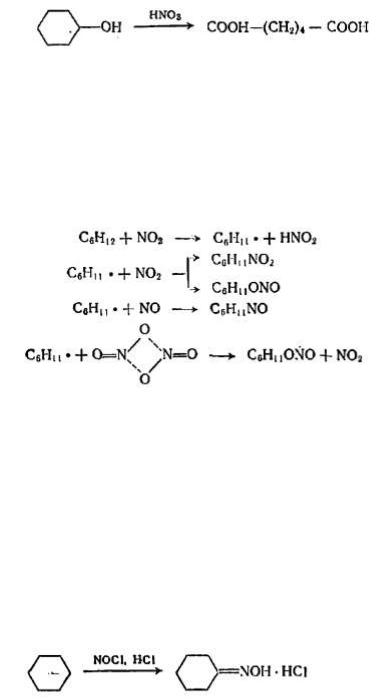
По непрерывной схеме проводится обработка циклогексана 35 % азотной кислотой при 120—125 °С, давлении 0,4—0,5 МПа, мольном отношении кислоты к циклогексану не более 1,33:1. Побочный продукт нитрования — адипиновая кислота:
Нитроциклогексан восстанавливают в циклогексаноксим водородом в среде жидкого аммиака в присутствии медного катализатора при 80—130 °C, давлении 17—20 МПа с выходом оксима 85-90 %.
Перспективно окисление циклогексана диоксидом азота, протекающее при относительно низкой температуре (70 °С) в течение 6 ч с образованием смеси 80 % адипиновой кислоты, 10 % нитроциклогексана и примесей других продуктов [69, 70]:
Возможно использование для окисления циклогексана оксида хрома (VI).
Жидкофазное окисление циклогексана кислородом воздуха происходит при 120—130 °C, давлении 1,5—2 МПа в присутствии катализаторов нафтената кобальта или стеарата марганца. Суммарный выход циклогексанола и циклогексаном достигает 65—75%, одновpeмeннo образуется 0,5 т адипиновой кислоты на 1 т кaпролактама.
Весьма эффективен способ получения капролактама, основанный на фотохимическом нитрозировании циклогексана раствором хлороксида азота (III) при облучении видимым светом с длинной волны 450—550 ммк и насыщении раствора газообразным хлороводородом [69, 70]:
Хлоргидрат циклогексаноксима изомеризуют с получением капролактама.
Большой практический интерес представляет процесс жидкофазного окисления моноциклоалканов в присутствии борной кислоты, связывающей образующиеся спирты в борнокислые эфиры, устойчивые к дальнейшему окислению [71]. Этерифицирующие добавки — борную кислоту или борный ангидрид добавляют в peaктор для окисления (5 % от массы окисляемого углеводорода). Oкисление проводилось в реакторе барботажного типа азото-водород- ной смесью, содержащей 3,5—7,0 % кислорода при удельном pасходе газовой смеси 500—1500 л/(кг-ч), 145—185°С в течение 3—4 ч.
209

Окисление гомологов циклогексана происходит при 165°C газовой смесью, содержавшей 3,5 % кислорода при удельном расходе смеси 1000 л/(кг-ч). Алкилциклопентаны более химически инертны по сравнению с алкилциклогексанами, поэтому их окисление происходит в более жестких условиях газовой смесью, содержащей 7 % кислорода в течение 3—4 ч. С удлинением боковой цепи степень окисления алкилциклопентанов возрастает: гексилциклопентан окисляется на 36,2%, нонилциклопентан — на 42,0%. Окисление пропилциклопентана в присутствии борного ангидрида происходило при 180 °C окисляющей смесью с 2,4% кислорода при удельном расходе смеси 2500 л/(кг∙ч), давлении 1,15 МПа в течение 0,5—2,0 ч. Функция борного ангидрида в процессе окисления аналогична борной кислоте.
Характеристика спиртов, полученных окислением углеводородов, представлена ниже
[71]:
При окислении алкилциклопентанов образовывались в основном вторичные спирты, в небольшом количестве — первичные и до 1,6 % третичные. Из пропилциклопентана получено 16% 1-циклопентил- 1-пропанола и 1-пропил-2-циклопентанола (цис-изомер), 20,4 % пропил-2-циклопентанола (транс-изомер), 15,1% 1-циклопентил-
пропанола, 47,2% 1-пропил-3-циклопентанола. С удлинением боковой цепи возрастала доля циклоалкеновых спиртов с гидроксильной группой в боковой цепи. Без использования борной кислоты в продуктах окисления возрастала доля третичных спиртов. Образующиеся спирты имели то же число атомов углерода в молекуле, что и исходный углеводород.
Окислением циклоалканов средней фракции балаханской нефти получены нефтяные кислоты, по качеству не уступавшие товарным продуктам — мылонафту, асидолу и асидолу-мылонафту, получаемым выщелачиванием кислот из нефтей и нефтепродуктов [72]. Исходным сырьем являлась фракция концентрата циклоалканов 250—350°C с содержанием 23 % циклогексанов и 77 % циклопентанов с боковыми цепями С6—С15. Окисление проводилось на пилотной установке при 140 °C с постепенным снижением нагрева до 110 °C со скоростью 5 °С/ч в присутствии 2 % нафтенатов марганца и калия в расчете на массу сырья, с удельным расходом воздуха 0,9 м3/(кг∙ч) в течение 4,5 ч. Нафтенат калия ингибировал окисление циклоалканов в гидроксикислоты. Выход нафтеновых кислот 16 %, гидроксикислот — 2 %.
Алкилирование.
Молекула циклогексана симметрична, в ней отсутствуют третичные углеродные атомы, поэтому она не взаимодействует с алкенами. Метилциклогексан в присутствии комплекса хлоридов алюминия и железа (III) (20:1) взаимодействует с алкенами (пропеном, метилпропеном, 1-ноненом, 1-додеценом и метилоктеном) [73]. При 20°C происходит только полимеризация алкенов, при 50 °С одновременно протекают реакции алкилирования и полимеризации, при 80—100 °C - преимущественно
210
