
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- •1.1. Химическая реакция
- •1.2. Классификация веществ
- •1.3. Количественные расчеты в химии
- •2. СТРОЕНИЕ АТОМА
- •2.1. Развитие представлений о строении атома
- •2.1.1. Теория строения атома Бора
- •2.1.2. Особенности описания микрочастиц
- •2.2. Основные понятия волновой механики
- •2.2.1. Волновое уравнение
- •2.2.2. Решение уравнения Шрёдингера для простейших случаев
- •2.3.1. Основное состояние атома водорода
- •2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •2.3.3. Возбужденные состояния атома водорода
- •2.3.4. Многоэлектронные атомы
- •2.4. Периодический закон и таблица элементов
- •2.4.1. Электронные конфигурации многоэлектронных атомов
- •2.4.2. Связь периодического закона со строением атома
- •2.4.3. Физико-химические характеристики атома
- •Контрольные вопросы
- •3. ХИМИЧЕСКАЯ СВЯЗЬ
- •3.1. Основные характеристики и классификация моделей химической связи
- •3.1.1. Основные параметры химической связи
- •3.1.2. Типы химической связи
- •3.2. Ковалентная химическая связь
- •3.2.1. Метод валентных связей
- •3.2.3. Геометрия простейших молекул. Гибридизация АО
- •3.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •3.2.5. Метод молекулярных орбиталей
- •3.2.6. Полярность связи и дипольный момент молекулы
- •Контрольные вопросы
- •4. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
- •4.1. Межмолекулярные взаимодействия
- •4.1.2. Водородная связь
- •4.2. Химическая связь в твердом теле
- •4.2.1. Основные понятия о строении кристаллов
- •4.2.3. Ковалентные (атомные) кристаллы
- •4.2.4. Ионные кристаллы. Ионный тип химической связи
- •4.2.5. Химическая связь в металлах
- •4.2.6. Зонная модель кристаллического тела
- •4.2.7. Металлы, полупроводники и диэлектрики
- •4.2.8. Кристаллические материалы
- •4.2.9. Аморфные твердые тела
- •4.3. Химическая связь в жидкостях
- •Контрольные вопросы
- •5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •5.1. Основные понятия и определения
- •5.1.1. Термодинамическая система
- •5.1.2. Термодинамический процесс
- •5.2. Тепловые эффекты физико-химических процессов
- •5.2.1. Внутренняя энергия
- •5.2.2. Первое начало термодинамики
- •5.2.3. Тепловой эффект химической реакции
- •5.2.4. Термохимические расчеты
- •5.3. Направление и пределы протекания химического процесса
- •5.3.1. Второе начало термодинамики
- •5.3.2. Энтропия
- •5.3.3. Направление химического процесса
- •5.3.4. Химический потенциал
- •Контрольные вопросы
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.1. Механизм химической реакции
- •6.1.1. Частицы, участвующие в химической реакции
- •6.1.2. Классификация химических реакций
- •6.2. Элементарная химическая реакция
- •6.2.1. Скорость химической реакции
- •6.2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •6.2.3. Константа скорости химической реакции
- •6.3. Формальная кинетика гомогенных реакций
- •6.3.1. Кинетические уравнения реакций
- •6.3.2. Зависимость скорости реакции от температуры
- •6.3.3. Определение кинетических параметров реакции
- •6.4. Цепной механизм химической реакции
- •6.5. Индуцированные реакции
- •6.5.1. Фотохимические реакции
- •6.5.2. Радиационно–химические процессы
- •6.6. Макрокинетика
- •6.6.1. Гетерогенные реакции
- •6.6.2. Горение и взрыв
- •6.7. Катализ
- •6.7.1. Гомогенный катализ
- •6.7.2. Гетерогенный катализ
- •Контрольные вопросы
- •7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •7.1. Термодинамическое условие химического равновесия
- •7.2. Кинетическое условие химического равновесия
- •7.3. Расчет равновесного состава газовой смеси
- •7.4. Равновесия в растворах
- •7.4.1. Растворы
- •7.4.2. Электролитическая диссоциация
- •7.4.3. Ионное произведение воды. Водородный показатель
- •7.4.4. Растворы кислот и оснований
- •7.4.5. Буферные растворы
- •7.4.6. Гидролиз солей
- •7.4.7. Обменные реакции с образованием осадка
- •7.5. Фазовые равновесия
- •7.5.1. Диаграмма состояния однокомпонентной системы
- •7.5.2. Диаграмма состояния двухкомпонентной системы
- •7.5.3. Кипение и кристаллизация растворов
- •7.5.4. Электролиты
- •Контрольные вопросы
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Основные понятия и определения
- •8.2. Электродные процессы
- •8.2.1. Скачок потенциала на границе «металл–электролит»
- •8.2.2. Уравнение Нернста
- •8.2.3. Электроды
- •8.3. Неравновесные электрохимические системы
- •8.3.1. Гальванический элемент
- •8.3.2. Окислительно-восстановительные реакции в водных растворах
- •8.3.3. Электролиз
- •8.4. Кинетика электрохимических процессов
- •8.4.1. Скорость электрохимических процессов
- •8.4.2. Поляризация электродов
- •8.5. Практическое использование электрохимических процессов
- •8.5.1. Химические источники тока
- •8.5.2. Применение электролиза
- •Контрольные вопросы
- •9. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •9.1. Коррозионные процессы
- •9.2. Химическая коррозия
- •9.2.1. Высокотемпературная газовая коррозия
- •9.2.2. Кинетика роста оксидных пленок
- •9.2.3. Факторы, влияющие на скорость газовой коррозии
- •9.3. Электрохимическая коррозия
- •9.3.1. Анодные и катодные реакции
- •9.3.2. Термодинамические условия электрохимической коррозии металлов
- •9.3.3. Факторы, влияющие на скорость электрохимической коррозии
- •9.4. Коррозионные среды и влияние дополнительных факторов
- •9.4.1. Коррозионно-механическое разрушение металлов
- •9.4.2. Водородная коррозия
- •9.4.3. Радиационная коррозия
- •Контрольные вопросы
- •Библиографический список
1000 кДж/моль), а энергия межмолекулярного взаимодействия –
0,1 ÷ 1эВ ( 10 ÷ 100 кДж/моль). Поэтому первые относят к груп-
пе сильных связей, а вторые к группе слабых.
3.2. Ковалентная химическая связь
Количественное описания ковалентной связи (определение параметров связи: энергии связи, длины связи, валентных углов) стало возможным с созданием квантово-механической модели атома. Сразу вслед за опубликованием работ Шрёдингера стала развиваться новая наука – квантовая химия – приложение квантовой механики к теории строения молекул.
Основные задачи квантовой химии сводятся к решению уравнения Шрёдингера для рассматриваемой молекулы, т.е. к нахож-
дению волновой функции (Ψ-функции) валентных электронов, которая дает информацию для определения величины энергии химической связи и распределения электронной плотности в пространстве.
Аналитическое решение этой задачи практически невозможно, поэтому используют методы приближенного вычисления. Наиболее распространенным является вариационный метод. Суть его сводится к произвольному заданию волновой функции (функция первого приближения), вычислению энергии системы и дальнейшему достижению ее минимального значения путем изменения вида волновой функции. Вычисленный таким образом минимум энергии тем ближе к истинной энергии системы, чем точнее най-
денная приближенная функция (Ψ) совпадает с истинной волновой функцией системы.
Существуют два подхода к описанию ковалентной связи: метод валентных связей (ВС) и метод молекулярных орбиталей (МО). Эти методы различаются в основном способом построения исходной волновой функции системы (функции первого приближения) и, как следствие, математическим аппаратом.
3.2.1. Метод валентных связей
Основы метода ВС разработали в 1927 г. Вальтер Гайтлер и Фриц Лондон. Модельной частицей для этого метода является молекула водорода Н2. При построении волновой функции молекулы
70

|
−e2 |
в методе валентных связей считается, что: |
|
+eA |
|
1) атомы в молекуле сохраняют свою инди- |
|
+eB |
видуальность – каждый электрон принад- |
||
|
|||
−e1 |
|
лежит ядру своего атома, 2) известны вол- |
|
Атом В |
новые функции электронов атома А (ΨА) и |
||
Атом А |
|||
ΨА |
ΨВ |
атома В (ΨВ) – атомные орбитали, 3) счита- |
|
Рис. 3.3. Схема элек- |
ется, что частицы (электроны и ядра ато- |
||
тростатического |
мов) неразличимы. |
||
взаимодействия элек- |
Составим уравнение Шрёдингера для мо- |
||
тронов и ядер в моле- |
лекулы водорода. Входящая в него потенци- |
||
куле водорода |
альная энергия включает в себя сумму энер- |
||
|
|
||
гий электростатического взаимодействия всех частиц (двух электронов −e и двух ядер +e). Из рис. 3.3 видно, что суммарная потенциальная энергия складывается из двух положительных членов: энергии отталкивания электронов и ядер между собой и четырех отрицательных – энергий притяжения электронов к ядрам:
V (r)=+ke2 + ke2 − ke2 − ke2 − ke2 − ke2 ,
rAB r12 rA1 rB2 rA2 rB1
где rAB; r12 − расстояния между ядрами атомов А и В и между первым и вторым электронами; rA1; rA2 – расстояния между ядром атома А и первым и вторым электронами соответственно; rB1; rB2 – расстояния между ядром атома В и первым и вторым электронами соответственно.
Таким образом, уравнение Шрёдингера для молекулы водорода имеет вид
( 2 |
Ψ+ |
2 |
Ψ)+8π2m |
(E − ke2 −ke2 + ke2 + ke2 + ke2 + ke2 ) Ψ=0. |
1 |
|
2 |
h2 |
rAB r12 rA1 rB2 rA2 rB1 |
|
|
|
Аналитическое решение данного уравнения практически не-
возможно, поэтому нахождение энергии химической связи ∆E(r) и волновой функции электронов, показывающей распределение электронной плотности в молекуле, производят приближенным методом.
Поскольку вероятность нахождения электрона в элементарном
объеме пропорциональна Ψ-функции, а по условиям метода ВС атомы при образовании связи сохраняют свои атомные орбитали, то в первом приближении функция, описывающая состояние электронов в молекуле водорода, может быть представлена как произ-
71

ведение волновых функций электронов в отдельных изолированных атомах водорода:
Ψ1 = ΨА(1) ΨВ(2),
где Ψ1 – функция, описывающая состояния электронов в молекуле водорода; ΨА(1) – функция, описывающая состояния электрона 1, принадлежащего атому А (Ψ1s – функция основного состояния атома водорода); ΨВ(2) функция, описывающая состояния элек-
трона 2, принадлежащего атому В (Ψ1s).
Поскольку электроны и ядра атомов принципиально неразличимы, то безразлично, какой из них будет находиться у определенного ядра. Поэтому необходимо составить и вторую функцию:
Ψ2 = ΨА(2) ΨВ(1).
Первая функция рассматривает электрон 1 как принадлежащий атому А, а 2 – как принадлежащий атому В, вторая функция, наоборот, считает, что электрон 2 принадлежит атому А, а 1 – атому В. Обе функции являются решениями уравнения Шрёдингера. Для простоты изложения нормировочные множители приняты равными единице.
Расчет с использованием этих функций качественно правильно описывал молекулу водорода, но величины энергии и длины связи сильно отличались от определенных экспериментально.
Более точным приближением к истинной волновой функции явилась линейная комбинация первой и второй:
ΨS =ΨА(1) ΨВ(2) + ΨА(2) ΨВ(1),
ΨА =ΨА(1) ΨВ(2) – ΨА(2) ΨВ(1).
Физический смысл этих двух функций заключается в следующем: ΨS – симметричная функция – соответствует случаю, когда электроны в молекуле водорода имеют разные по знаку значения спинового квантового числа, – спины электронов антипараллельны; ΨА – антисимметричная функция – описывает состояние, когда оба электрона имеют одинаковое значение спинового числа, – спины электронов параллельны.
Изменение энергии системы двух взаимодействующих атомов водорода описывается выражением ∆ES (r) =1Q++SI2 – для симмет-
ричной функции, ∆EA(r)=1Q−−SI2 – для антисимметричной, Q – «кулоновский интеграл», характеризующий изменение энергии
72
системы вследствие электростатического взаимодействия электронов и ядер между собой; I – «обменный интеграл», интеграл, характеризующий понижение энергии системы вследствие неразличимости электронов; S – «интеграл перекрывания», характеризующий изменение энергии системы вследствие перекрывания атомных орбиталей.
Для выяснения физического смысла этих интегралов проанализируем их выражения.
«Интеграл перекрывания»
S =∫ΨA (1)ΨB (1)dV1 =∫ΨA (2)ΨB (2)dV2
V V
характеризует область пространства перекрывания атомных орбиталей.
«Кулоновский интеграл»
ke2 |
ke2 |
2 |
2 |
ke2 |
2 |
ke2 |
2 |
(1)dV1 |
Q=r |
+∫∫ r |
ΨA |
(1)ΨB |
(2)dV1dV2 −∫r |
ΨB |
(2)dV2 −∫ r |
ΨA |
|
AB |
V 12 |
|
|
V A2 |
|
V B1 |
|
|
показывает изменение энергии системы в результате отталкивания ядер друг от друга (первый член суммы), электронов (второй член) и притяжения электронов к ядрам «не своего атома» (третий и четвертый члены). Последние два интеграла равны между собой, поскольку атомы одинаковы. Физический смысл интегралов очеви-
ден: ψi2dVj – вероятность нахождения j-электрона в элементарном
объеме пространства, e ψi2dVj – величина заряда. Согласно закону Кулона энергия электростатического взаимодействия прямо пропорциональна произведению величины зарядов и обратно пропорциональна расстоянию между ними.
Энергия притяжения электронов к ядрам «своего атома» – энергия невзаимодействующих атомов (E0) – в энергии химической связи не учитывается (полная энергия молекулы водорода E =
= 2 E0+∆E(r)).
«Обменный интеграл»
I = |
ke2 S |
ke2 |
|
|
r |
+∫∫ r |
ΨA (1)ΨA (2)ΨB (1)ΨB (2)dV1dV2 − |
||
|
AB |
V 12 |
|
|
|
ke2 |
|
ke2 |
|
−S ∫r |
ΨA (2)ΨB (2)dV2 −S ∫ r |
ΨA (1)ΨB (1)dV1 , |
||
|
V A2 |
|
V B1 |
|
S – «интеграл перекрывания».
73

«Обменный интеграл» похож на «кулоновский», но вместо квадрата волновой функции для данного электрона стоит произведение волновых функций разных атомов, что придает ему достаточно абстрактный характер – «неклассическое электростатическое взаимодействие». Энергия системы изменяется вследствие неразличимости электронов, т.е. возможность замены одного электрона на другой приводит к изменению энергии системы.
На расстояниях r → ∞ кулоновский, обменный интегралы и ин-
теграл перекрывания стремятся к нулю: Q → 0, I → 0 и S → 0. На расстояниях, близких к длине связи, кулоновский и обменный ин-
тегралы отрицательны: Q < 0; I < 0, причем Q < I ; при r → 0 они становятся положительными. Интеграл перекрывания всегда
положителен и меньше единицы: 0 ≤ S < 1.
В случае симметричной функции (спины электронов антипа-
раллельны) в зависимости ∆E(r) существует минимум (потенциальная яма), а электронная плотность между атомами возрастает – химическая связь образуется, молекула устойчива (рис. 3.4). В случае антисимметричной функции (спины электронов параллель-
ны) минимум в зависимости ∆E(r) отсутствует, электронная плотность между ядрами равна нулю – связь не образуется.
∆E(r) |
|
|
A |
B |
|
|
|
||
|
|
|
ΨА |
|
↑↑ |
|
Q − I |
|
|
∆E |
(r) = |
|
|
|
A |
|
1− S 2 |
|
|
|
|
|
r Ψ |
|
∆E |
(r) = |
Q + I |
S |
|
|
|
|||
S |
|
1+ S 2 |
|
|
↑↓ |
|
|
|
|
A B
Рис. 3.4. Зависимость изменения энергии молекулы и распределение электронной плотности в молекуле водорода в случае описания системы симметричной (ΨS)
иантисимметричной (ΨA) функцией
Пр и м е р. Энергия и длина связи в молекуле водорода, определенные экспериментально и рассчитанные с учетом различных факторов, усложняющих явный вид волновых функций:
74
|
Энергия связи, эВ |
Длина связи, Ǻ |
Эксперимент…………………….. |
4,747 |
0,741 |
Функции Ψ1s Ψ1s………………… |
0,25 |
0,9 |
Функции ΨS ΨA………………….. |
3,14 |
0,869 |
С учетом сжимаемости атомов… |
3,76 |
0,743 |
С учетом поляризации атомов…. |
4,02 |
0,749 |
С учетом ионности связи……….. |
4,10 |
0,740 |
На основе представлений, выработанных при расчете молекулы водорода, сформулированы основные принципы (постулаты) метода валентных связей, позволяющие описывать образование ковалентной химической связи в более сложных молекулах:
1)единичная химическая связь образуется общей парой электронов с противоположными (антипараллельными) спинами;
2)общая электронная пара локализована (сосредоточена) между атомами в направлении максимального перекрывания атомных орбиталей;
3)энергия связи определяется только силами электростатического взаимодействия электронов и ядер и зависит от величины перекрывания орбиталей.
Таким образом, число связей (валентность), которые может образовывать атом, определяется числом неспаренных электронов на внешнем энергетическом уровне атома в основном или возбужденном состоянии. Ковалентная связь обладает свойством насыщенности (атом может образовывать ограниченное число единич-
ных ковалентных связей). Ковалентная химическая связь обладает свойством направленности (расположение в пространстве общей электронной пары определяется пространственной ориентацией перекрывающихся валентных орбиталей). Атомы взаимно располагаются таким образом, чтобы перекрывание валентных орбиталей было максимальным. Из двух связей прочнее та, в которой перекрывание валентных орбиталей больше.
3.2.2. Кратные связи. σ- и π-связи
Единичная химическая связь представляет собой общую электронную пару, локализованную в области перекрывания валентных орбиталей, что приводит к образованию области повышенной электронной плотности, расположенной между ядрами атомов.
Если область повышенной электронной плотности располагается симметрично линии, проходящей через ядра взаимодействую-
75
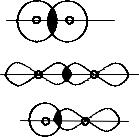
щих атомов (линии связи), то такой тип связи называется σ- связью. Она принципиально может образовываться в результате перекрывания любого типа атомных орбиталей (рис. 3.5).
σs-s |
H2 (H 1s1) |
|
|
σp-p |
Cl2 (Cl 3s23p5) |
|
|
σs-p |
HF (H1s1; F 2s22p5) |
|
Рис. 3.5. Схема образования σ-связи
Поскольку σ-связь обладает цилиндрической симметрией, то поворот атомов относительно друг друга вокруг линии связи не приводит к изменению распределения электронной плотности. Поэтому оба атома могут свободно вращаться вокруг оси, совпадаю-
щей с линией связи, не разрывая и не деформируя σ-связь.
П р и м е ч а н и е. Волновые функции, описывающие атомные орбитали, могут иметь области положительных и отрицательных значений – знак функции. Функция, описывающая s-орбиталь, во всей области пространства положительна (рис. 3.6, а). Функции, описывающие p- и d- орбитали, имеют узловые точки (точки, в которых функция обращается в ноль). При переходе через узловую точку волновая функция меняет свой знак на противоположный, т.е. имеются области орбиталей с отрицательным и положительным знаком волновых функций (рис. 3.6, б, в).
Область повышенной электронной плотности (образование связи) возникает в том случае, если перекрываются электронные орбитали, функции которых имеют одинаковый знак. Поэтому, например, перекрывание s- и py- или pz-орбитали (направление оси x совпадает с линией связи) не приводит к образованию химической связи (рис. 3.6, г). Связь образуется при перекрывании s- и положительной части px-орбитали (рис. 3.6, д).
Электроны, имеющие сложную симметрию орбиталей (p- и d- орбитали), могут образовывать связь в результате перекрывания орбиталей в двух областях над и под линией связи. Такой тип свя-
зи называется π-связью (рис. 3.7).
Энергия π-связи меньше, чем энергия σ-связи, так как перекры-
вание орбиталей по π-типу меньше, чем по σ-типу. π-связь не обладает цилиндрической симметрией относительно линии связи,
76

поэтому вращение атомов вокруг линии связи исключено, что объясняет существование цис- и транс-изомеров.
При образовании химической связи между двумя атомами в
первую очередь образуется σ-связь. Во многих случаях она будет единственной, но если атомы имеют дополнительно неспаренные
р-электроны, то, кроме σ-связи, могут образоваться одна или две
π-связи, которые будут располагаться во взаимно перпендикулярных плоскостях. В этом случае говорят о кратности связи – двой-
ная связь (σ- и одна π-связь) или тройная (σ- и две π-связи), которые образованы соответственно двумя или тремя электронными парами (рис. 3.8).
a) |
s |
|
б) |
p |
|
|
в) |
+ |
d |
|
+ |
|
|
+ |
|
|
|
− |
|
|
|
|
|
|
|
− |
|
||
|
|
|
|
− |
|
|
|
+ |
|
|
г) |
+ |
py |
д) |
|
|
px |
|
|
|
|
+ |
x |
|
+ |
+ |
− |
|
x |
|
|
− |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Рис. 3.6. Области орбиталей с отрицательным и положительным знаком волновых функций
+  +
+
 x
x
−  −
−
πpy-py (πpz-pz)
+ |
+ |
− |
|
|
x |
− |
− |
+ |
|
πp-d |
|
Рис. 3.7. Схема образования π-связи
z z
πpz-pz
 y σpy-py
y σpy-py
πpx-px
 x
x  x
x
Рис. 3.8. Схема образования кратных связей: py-py – одна σ-связь, px-px, pz-pz – две π-связи
77
