
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- •1.1. Химическая реакция
- •1.2. Классификация веществ
- •1.3. Количественные расчеты в химии
- •2. СТРОЕНИЕ АТОМА
- •2.1. Развитие представлений о строении атома
- •2.1.1. Теория строения атома Бора
- •2.1.2. Особенности описания микрочастиц
- •2.2. Основные понятия волновой механики
- •2.2.1. Волновое уравнение
- •2.2.2. Решение уравнения Шрёдингера для простейших случаев
- •2.3.1. Основное состояние атома водорода
- •2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •2.3.3. Возбужденные состояния атома водорода
- •2.3.4. Многоэлектронные атомы
- •2.4. Периодический закон и таблица элементов
- •2.4.1. Электронные конфигурации многоэлектронных атомов
- •2.4.2. Связь периодического закона со строением атома
- •2.4.3. Физико-химические характеристики атома
- •Контрольные вопросы
- •3. ХИМИЧЕСКАЯ СВЯЗЬ
- •3.1. Основные характеристики и классификация моделей химической связи
- •3.1.1. Основные параметры химической связи
- •3.1.2. Типы химической связи
- •3.2. Ковалентная химическая связь
- •3.2.1. Метод валентных связей
- •3.2.3. Геометрия простейших молекул. Гибридизация АО
- •3.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •3.2.5. Метод молекулярных орбиталей
- •3.2.6. Полярность связи и дипольный момент молекулы
- •Контрольные вопросы
- •4. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
- •4.1. Межмолекулярные взаимодействия
- •4.1.2. Водородная связь
- •4.2. Химическая связь в твердом теле
- •4.2.1. Основные понятия о строении кристаллов
- •4.2.3. Ковалентные (атомные) кристаллы
- •4.2.4. Ионные кристаллы. Ионный тип химической связи
- •4.2.5. Химическая связь в металлах
- •4.2.6. Зонная модель кристаллического тела
- •4.2.7. Металлы, полупроводники и диэлектрики
- •4.2.8. Кристаллические материалы
- •4.2.9. Аморфные твердые тела
- •4.3. Химическая связь в жидкостях
- •Контрольные вопросы
- •5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •5.1. Основные понятия и определения
- •5.1.1. Термодинамическая система
- •5.1.2. Термодинамический процесс
- •5.2. Тепловые эффекты физико-химических процессов
- •5.2.1. Внутренняя энергия
- •5.2.2. Первое начало термодинамики
- •5.2.3. Тепловой эффект химической реакции
- •5.2.4. Термохимические расчеты
- •5.3. Направление и пределы протекания химического процесса
- •5.3.1. Второе начало термодинамики
- •5.3.2. Энтропия
- •5.3.3. Направление химического процесса
- •5.3.4. Химический потенциал
- •Контрольные вопросы
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.1. Механизм химической реакции
- •6.1.1. Частицы, участвующие в химической реакции
- •6.1.2. Классификация химических реакций
- •6.2. Элементарная химическая реакция
- •6.2.1. Скорость химической реакции
- •6.2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •6.2.3. Константа скорости химической реакции
- •6.3. Формальная кинетика гомогенных реакций
- •6.3.1. Кинетические уравнения реакций
- •6.3.2. Зависимость скорости реакции от температуры
- •6.3.3. Определение кинетических параметров реакции
- •6.4. Цепной механизм химической реакции
- •6.5. Индуцированные реакции
- •6.5.1. Фотохимические реакции
- •6.5.2. Радиационно–химические процессы
- •6.6. Макрокинетика
- •6.6.1. Гетерогенные реакции
- •6.6.2. Горение и взрыв
- •6.7. Катализ
- •6.7.1. Гомогенный катализ
- •6.7.2. Гетерогенный катализ
- •Контрольные вопросы
- •7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •7.1. Термодинамическое условие химического равновесия
- •7.2. Кинетическое условие химического равновесия
- •7.3. Расчет равновесного состава газовой смеси
- •7.4. Равновесия в растворах
- •7.4.1. Растворы
- •7.4.2. Электролитическая диссоциация
- •7.4.3. Ионное произведение воды. Водородный показатель
- •7.4.4. Растворы кислот и оснований
- •7.4.5. Буферные растворы
- •7.4.6. Гидролиз солей
- •7.4.7. Обменные реакции с образованием осадка
- •7.5. Фазовые равновесия
- •7.5.1. Диаграмма состояния однокомпонентной системы
- •7.5.2. Диаграмма состояния двухкомпонентной системы
- •7.5.3. Кипение и кристаллизация растворов
- •7.5.4. Электролиты
- •Контрольные вопросы
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Основные понятия и определения
- •8.2. Электродные процессы
- •8.2.1. Скачок потенциала на границе «металл–электролит»
- •8.2.2. Уравнение Нернста
- •8.2.3. Электроды
- •8.3. Неравновесные электрохимические системы
- •8.3.1. Гальванический элемент
- •8.3.2. Окислительно-восстановительные реакции в водных растворах
- •8.3.3. Электролиз
- •8.4. Кинетика электрохимических процессов
- •8.4.1. Скорость электрохимических процессов
- •8.4.2. Поляризация электродов
- •8.5. Практическое использование электрохимических процессов
- •8.5.1. Химические источники тока
- •8.5.2. Применение электролиза
- •Контрольные вопросы
- •9. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •9.1. Коррозионные процессы
- •9.2. Химическая коррозия
- •9.2.1. Высокотемпературная газовая коррозия
- •9.2.2. Кинетика роста оксидных пленок
- •9.2.3. Факторы, влияющие на скорость газовой коррозии
- •9.3. Электрохимическая коррозия
- •9.3.1. Анодные и катодные реакции
- •9.3.2. Термодинамические условия электрохимической коррозии металлов
- •9.3.3. Факторы, влияющие на скорость электрохимической коррозии
- •9.4. Коррозионные среды и влияние дополнительных факторов
- •9.4.1. Коррозионно-механическое разрушение металлов
- •9.4.2. Водородная коррозия
- •9.4.3. Радиационная коррозия
- •Контрольные вопросы
- •Библиографический список
термодинамика определяет термодинамическую возможность осуществления химического процесса при заданных условиях, т. е. возможность перехода системы из одного состояния равновесия в другое в результате протекания химических реакций. При этом время и пути этого перехода – промежуточные стадии, представляющие собой отдельные химические реакции, не рассматриваются. Однако термодинамическая возможность в ряде случаев не реализуется из-за бесконечно большого времени протекания некоторых химических реакций. Поэтому для оценки возможности практической реализации конкретного процесса большое значение приобретает понимание закономерностей развития во времени его отдельных стадий, т.е. механизма химической реакции.
Химическая кинетика – учение о механизме химических реакций и закономерностях их развития во времени в зависимости от условий протекания (температуры, давления, концентрации реагирующих веществ, катализаторов и ингибиторов, свойств среды, в которой протекает реакция, и др.). Знание химической кинетики позволяет оптимизировать условия проведения процессов.
Кинетика содержит в себе два основных раздела: учение о механизме химического взаимодействия и формальную кинетику – математическое описание изменения количества реагирующих веществ во времени.
Во всех кинетических исследованиях фигурируют время и промежуточные продукты (вещества, образующиеся на промежуточных стадиях реакции). Этим они отличаются от исследований систем в условиях химического равновесия, когда рассматриваются только начальное и конечное состояния реагентов.
6.1. Механизм химической реакции
Химические реакции, протекающие при непосредственном взаимодействии молекул исходных веществ (протекающие в одну стадию), называются элементарными. В большинстве случаев процесс осуществляется не путем прямого перехода молекул исходных веществ в молекулы продуктов, а состоит из нескольких промежуточных стадий, каждая из которых является элементарной химической реакцией. В этом случае говорят, что реакция является сложной. Совокупность всех стадий называется механизмом хими-
ческой реакции.
165

Характерная особенность сложных реакций заключается в том, что на отдельных стадиях образуются промежуточные частицы, которые затем расходуются в других стадиях. Как правило, эти частицы обладают повышенной реакционной способностью и обеспечивают развитие сложной реакции. В ряде случаев, в зависимости от химической природы реагирующих веществ и условий осуществления процесса, можно получить достаточно высокие концентрации промежуточных частиц (промежуточное вещест-
во).
6.1.1.Частицы, участвующие в химической реакции
Входе реакции происходит преобразование химических связей
вреагентах. Оно представляет собой разрыв химических связей в молекулах исходных веществ и образование новых химических связей в продуктах реакции. Этот процесс может осуществляться двумя путями. Во-первых, в результате столкновения двух молекул образуется нестабильная промежуточная частица, в состав которой входят все атомы исходных веществ, объединенные общей системой химических связей, которая в дальнейшем может образовать либо продукты реакции, либо исходные вещества. В этом случае процесс протекает в одну стадию, химическая реакция является элементарной:
A |
|
B + C |
|
D ↔ |
A |
B |
→ |
A |
|
D + B |
|
C |
|
|
D |
C |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
Во-вторых, химический процесс может реализоваться путем протекания нескольких (как минимум двух) последовательных элементарных реакций. Первая стадия такого процесса состоит в предварительном разрыве химических связей в молекулах исходных веществ с образованием отдельных фрагментов, которые могут быть заряжены, – ионы и не заряжены – свободные атомы и свободные радикалы. Последующее взаимодействие этих частиц приводит к образованию новых молекул. Например, превращение молекул АВ и СD в молекулы АD и ВС может быть описано следующими схемами:
|
|
|
|
|
|
|
|
→ A+ |
- |
|
|
|
|
|
|
|
|
|
D → A B |
|
|
|
|
|
|||||
A |
|
B + C |
|
|
+ B |
→ A |
|
D + B |
|
C |
||||
|
|
|
|
|
|
|||||||||
|
|
|
|
C |
|
D →C+ + D- |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||||
166
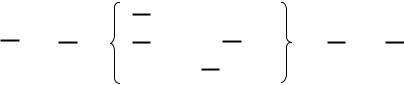
A B → A• + B•
A B + C D → C D+A• →A D +C• →A D+B C B• + C• → B C
Распад молекулы на отдельные фрагменты называется диссоциацией. Разорвать химическую связь в молекулах вещества можно двумя путями. Во-первых, разорвав общую электронную пару. Такой разрыв называется гомолитическим. При этом образуются частицы, обладающие неспаренными электронами: свободные атомы или фрагменты молекул, состоящие из нескольких атомов,
– свободные радикалы. При записи эти частицы обозначают точкой в виде верхнего индекса химической формулы.
Наличие у свободных атомов и радикалов неспаренных электронов обусловливает их повышенную реакционную способность по сравнению с молекулами.
Диссоциация молекул может также происходить без разрыва общей электронной пары, путем ее перехода к одному из фрагментов с образованием положительно и отрицательно заряженных ионов. Такой разрыв называется гетеролитическим. Электрический заряд ионов определяет их повышенную реакционную способность по сравнению с молекулами.
Значения энергии диссоциации молекул веществ, находящихся в газовой фазе при гомолитическом и гетеролитическом разрыве связей, приведены в табл. 6.1.
Т а б л и ц а 6.1
Молекула |
Гомолитический |
Энергия, |
Гетеролитический |
Энергия, |
|
разрыв |
кДж/моль |
разрыв |
кДж/моль |
H2 |
H• + H• |
429 |
H+ + H- |
1669 |
F2 |
F• + F• |
154 |
F+ + F- |
1486 |
HF |
H• + F• |
559 |
H+ + F- |
1524 |
H2O |
H• + OH• |
482 |
H+ + OH- |
1539 |
CH4 |
H• + CH3• |
420 |
H+ + CH3- |
1626 |
CsCl |
Cs• + Cl• |
423 |
CH3+ + H- |
1298 |
Cs+ + Cl- |
434 |
Как видно из табл. 6.1, в газовой фазе энергия гетеролитического разрыва связей обычно значительно превышает энергию гомолитического разрыва. Только для молекул, в которых связь сильно
167
поляризована (ионный тип связи), энергии гомолитического и гетеролитического разрывов различаются не сильно. Как правило, образование свободных атомов и радикалов происходит при относительно высоких температурах (термическая диссоциация), при поглощении квантов света (фотохимические реакции) или частиц ионизирующего излучения (радиационно-химические реакции).
Поэтому реакции в газовой фазе протекают преимущественно с участием радикалов.
Ситуация изменяется при осуществлении реакций в растворах, особенно при использовании полярных растворителей, например воды. В этом случае, согласно модели электролитической диссоциации, в результате поляризации связи в молекулах растворенного вещества под действием растворителя создаются условия для ее гетеролитичесого разрыва, приводящего к образованию ионов. В растворах химические реакции, как правило, протекают с участием молекул и ионов. Первая стадия реакции – распад молекул раство-
ренного вещества на ионы (электролитическая диссоциация) −
осуществляется в процессе растворения. Поэтому для обменных реакций растворы, по сути, являются «подготовленными» для химической реакции системами, в них осуществлен разрыв «старых» химических связей. Образование продуктов реакции обусловлено возможностью реализации процессов ассоциации ионов таким образом, чтобы в результате образовалось вещество, плохо распадающееся на ионы (слабый электролит) или уходящее из сферы реакции (осадок, газ).
Таким образом, в химической реакции могут принимать участие молекулы, атомы, радикалы и ионы.
6.1.2. Классификация химических реакций
Вследствие огромного разнообразия химических реакций их деление на отдельные группы возможно по различным признакам, в частности по признакам, которые влияют на механизм их протекания, что сказывается на особенностях их кинетического описания.
1.В зависимости от числа стадий реакции делятся на простые
исложные. В ходе простой (элементарной) реакции исходные вещества непосредственно, без образования промежуточных веществ, превращаются в продукты. Сложная (многостадийная) реакция состоит из нескольких простых реакций – элементарных
168
стадий. Продукты одной стадии служат исходными веществами для других стадий.
2. В зависимости от фазового состава исходных веществ и продуктов химические реакции делятся на:
•гомогенные – реагирующие вещества образуют одну фазу, например, реакции между газами или смешивающимися жидкостями. Непосредственное взаимодействие реагирующих частиц может происходить в любой точке объема занимаемого реагентами;
•гетерогенные – реагирующие вещества находятся в разных фазах, например реакции между твердыми и жидкими, твердыми и газообразными веществами. Непосредственное взаимодействие реагирующих частиц происходит на границе раздела фаз.
Если продукты реакции не образуют новую фазу, реакции на-
зываются гомофазными, а если образуют – гетерофазными.
Пр и м е р.
гомогенная, гомофазная реакция:
H2(газ)+Br2(газ) ↔ 2 HBr(газ),
гомогенная, гетерофазная реакция:
NH3(газ) + HCl(газ) → NH4Cl(тв),
гетерогенная, гомофазная реакция:
C(тв) + O2(газ) → CO2(газ),
гетерогенная, гетерофазная реакция:
Cu(тв) + O2(газ) → 2CuO(тв).
3.Если в системе происходят химические реакции, приводящие
кобразованию только продуктов реакции, то такие реакции называются необратимыми (односторонними). Стрелка, направленная
только вправо в уравнении реакции, говорит о том, что эта реакция необратима. Если в системе происходят химические реакции, приводящие к образованию как продуктов из исходных веществ (прямая реакция), так и исходных веществ из продуктов (обратная реакция), то такие реакции называются обратимыми (двусторонними). В ходе обратимых реакций исходные вещества полностью не расходуются. Система приходит в состояние равновесия. В состоянии равновесия обязательно будут как продукты реакции, так и исходные вещества, концентрация которых будет зависеть от внешних условий. Две стрелки, направленные вправо и влево в уравнении реакции, говорят о том, что она обратима.
169
4. Химические реакции могут быть разделены по числу исходных веществ и продуктов. Деление на группы по этому признаку может относиться как к простым, так и к сложным реакциям.
А. Исходным является одно вещество. Как правило, в этом случае реакции простые и в элементарном акте превращение претерпевает одна частица с образованием одной, двух и более частиц
(мономолекулярная реакция): A → A1 + A2 + …+An.
К реакциям этого типа относятся:
• реакции распада, в которых из одного исходного вещества получаются два и более продуктов реакции. Распад с разрывом только одной химической связи называется диссоциацией, напри-
мер: H2O2 → 2OH•. Распад на три и более веществ называется
фрагментацией;
• реакции изомеризации, в ходе которых меняется только строение молекулы исходного вещества, например:
(CH3)2CHCH2+ → (CH3)3C+.
Б. Исходными являются два вещества. В случае простой реакции в элементарном акте принимают участие две частицы (бимо-
лекулярные реакции).
К реакциям этого типа относятся:
• реакции присоединения (ассоциации): A + B → AB. Соедине-
ние двух одинаковых молекул называется димеризацией, напри-
мер: 2NO2→ N2O4. Последовательное соединение одинаковых молекул в одну макромолекулу называется полимеризацией,
например: nCH2=CH2→(-CH2-CH2-)n. Если в элементарной реакции участвуют два свободных атома, радикала или иона с образованием молекулы, то реакция называется рекомбинацией, например:
H•+ H•→ H2, H• + Cl• → HCl, H+ + OH- → H2O;
•реакции типа A + BC → AB + C называются реакциями от-
рыва, если В – атом или одноатомный ион, например: CH4 + Cl• → →CH3• + HCl, и реакциями замещения, если А – молекула, радикал, ион, а В – многоатомный радикал или ион, например: CH3Cl + I- →
→CH3I + Cl-.
5. В зависимости от того, как происходит перераспределение электронов в химических реакциях, их можно разделить на:
•окислительно-восстановительные, в ходе которых одно ве-
щество (восстановитель) отдает, а другое (окислитель) принимает электроны, например: Fe+2 + OH• → Fe+3 + OH-;
170
