
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- •1.1. Химическая реакция
- •1.2. Классификация веществ
- •1.3. Количественные расчеты в химии
- •2. СТРОЕНИЕ АТОМА
- •2.1. Развитие представлений о строении атома
- •2.1.1. Теория строения атома Бора
- •2.1.2. Особенности описания микрочастиц
- •2.2. Основные понятия волновой механики
- •2.2.1. Волновое уравнение
- •2.2.2. Решение уравнения Шрёдингера для простейших случаев
- •2.3.1. Основное состояние атома водорода
- •2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •2.3.3. Возбужденные состояния атома водорода
- •2.3.4. Многоэлектронные атомы
- •2.4. Периодический закон и таблица элементов
- •2.4.1. Электронные конфигурации многоэлектронных атомов
- •2.4.2. Связь периодического закона со строением атома
- •2.4.3. Физико-химические характеристики атома
- •Контрольные вопросы
- •3. ХИМИЧЕСКАЯ СВЯЗЬ
- •3.1. Основные характеристики и классификация моделей химической связи
- •3.1.1. Основные параметры химической связи
- •3.1.2. Типы химической связи
- •3.2. Ковалентная химическая связь
- •3.2.1. Метод валентных связей
- •3.2.3. Геометрия простейших молекул. Гибридизация АО
- •3.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •3.2.5. Метод молекулярных орбиталей
- •3.2.6. Полярность связи и дипольный момент молекулы
- •Контрольные вопросы
- •4. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
- •4.1. Межмолекулярные взаимодействия
- •4.1.2. Водородная связь
- •4.2. Химическая связь в твердом теле
- •4.2.1. Основные понятия о строении кристаллов
- •4.2.3. Ковалентные (атомные) кристаллы
- •4.2.4. Ионные кристаллы. Ионный тип химической связи
- •4.2.5. Химическая связь в металлах
- •4.2.6. Зонная модель кристаллического тела
- •4.2.7. Металлы, полупроводники и диэлектрики
- •4.2.8. Кристаллические материалы
- •4.2.9. Аморфные твердые тела
- •4.3. Химическая связь в жидкостях
- •Контрольные вопросы
- •5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •5.1. Основные понятия и определения
- •5.1.1. Термодинамическая система
- •5.1.2. Термодинамический процесс
- •5.2. Тепловые эффекты физико-химических процессов
- •5.2.1. Внутренняя энергия
- •5.2.2. Первое начало термодинамики
- •5.2.3. Тепловой эффект химической реакции
- •5.2.4. Термохимические расчеты
- •5.3. Направление и пределы протекания химического процесса
- •5.3.1. Второе начало термодинамики
- •5.3.2. Энтропия
- •5.3.3. Направление химического процесса
- •5.3.4. Химический потенциал
- •Контрольные вопросы
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.1. Механизм химической реакции
- •6.1.1. Частицы, участвующие в химической реакции
- •6.1.2. Классификация химических реакций
- •6.2. Элементарная химическая реакция
- •6.2.1. Скорость химической реакции
- •6.2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •6.2.3. Константа скорости химической реакции
- •6.3. Формальная кинетика гомогенных реакций
- •6.3.1. Кинетические уравнения реакций
- •6.3.2. Зависимость скорости реакции от температуры
- •6.3.3. Определение кинетических параметров реакции
- •6.4. Цепной механизм химической реакции
- •6.5. Индуцированные реакции
- •6.5.1. Фотохимические реакции
- •6.5.2. Радиационно–химические процессы
- •6.6. Макрокинетика
- •6.6.1. Гетерогенные реакции
- •6.6.2. Горение и взрыв
- •6.7. Катализ
- •6.7.1. Гомогенный катализ
- •6.7.2. Гетерогенный катализ
- •Контрольные вопросы
- •7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •7.1. Термодинамическое условие химического равновесия
- •7.2. Кинетическое условие химического равновесия
- •7.3. Расчет равновесного состава газовой смеси
- •7.4. Равновесия в растворах
- •7.4.1. Растворы
- •7.4.2. Электролитическая диссоциация
- •7.4.3. Ионное произведение воды. Водородный показатель
- •7.4.4. Растворы кислот и оснований
- •7.4.5. Буферные растворы
- •7.4.6. Гидролиз солей
- •7.4.7. Обменные реакции с образованием осадка
- •7.5. Фазовые равновесия
- •7.5.1. Диаграмма состояния однокомпонентной системы
- •7.5.2. Диаграмма состояния двухкомпонентной системы
- •7.5.3. Кипение и кристаллизация растворов
- •7.5.4. Электролиты
- •Контрольные вопросы
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Основные понятия и определения
- •8.2. Электродные процессы
- •8.2.1. Скачок потенциала на границе «металл–электролит»
- •8.2.2. Уравнение Нернста
- •8.2.3. Электроды
- •8.3. Неравновесные электрохимические системы
- •8.3.1. Гальванический элемент
- •8.3.2. Окислительно-восстановительные реакции в водных растворах
- •8.3.3. Электролиз
- •8.4. Кинетика электрохимических процессов
- •8.4.1. Скорость электрохимических процессов
- •8.4.2. Поляризация электродов
- •8.5. Практическое использование электрохимических процессов
- •8.5.1. Химические источники тока
- •8.5.2. Применение электролиза
- •Контрольные вопросы
- •9. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •9.1. Коррозионные процессы
- •9.2. Химическая коррозия
- •9.2.1. Высокотемпературная газовая коррозия
- •9.2.2. Кинетика роста оксидных пленок
- •9.2.3. Факторы, влияющие на скорость газовой коррозии
- •9.3. Электрохимическая коррозия
- •9.3.1. Анодные и катодные реакции
- •9.3.2. Термодинамические условия электрохимической коррозии металлов
- •9.3.3. Факторы, влияющие на скорость электрохимической коррозии
- •9.4. Коррозионные среды и влияние дополнительных факторов
- •9.4.1. Коррозионно-механическое разрушение металлов
- •9.4.2. Водородная коррозия
- •9.4.3. Радиационная коррозия
- •Контрольные вопросы
- •Библиографический список
или точных металлических копий (гальванопластика);
•электролиз с растворимым анодом лежит в основе процессов рафинирования (очистки) металлов: меди, никеля, серебра;
•процессы анодного растворения используются для электрохимической обработки металлов: электрополирования, электрофрезерования и др.
•электролизом получают различные химические вещества: хлор, водород и кислород, гидроксид натрия и др.
Контрольные вопросы
1.Электрохимический процесс. Количественные соотношения между величиной тока и количеством реагентов.
2.Двойной электрический слой на границе «металл–электролит». Электродный потенциал. Уравнение Нернста.
3.Химический и концентрационный гальванические элементы. ЭДС, электродные реакции.
4.Скорость электрохимической реакции. Поляризация электродов.
5.Химические источники тока.
6.Электролиз расплавов и водных растворов электролитов.
9.КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
Коррозия металлов (от лат. corrosio − разъедание) – непреднамеренный самопроизвольный физико-химический процесс взаимодействия металлов с окружающей (внешней) средой, приводящий к их разрушению или изменению физических свойств.
Причиной коррозии металлов является термодинамическая неустойчивость системы, состоящей из металла и компонентов окружающей среды. В подавляющем большинстве случаев коррозионные процессы представляют собой окисление металлов компонентами среды и превращение их в оксиды (MexOy), гидроксиды (Me(OH)n) или соли (MexAny). Получающиеся соединения называются продуктами коррозии, состав которых зависит от коррозионной среды. Изменение энергии Гиббса для реакций окисления большинства металлов при невысоких температурах отрицательное:
Me0→MexOy; Me(OH)n; MexAny; Me0 → Men+ + nē; ∆rG<0,
310
следовательно, они протекают самопроизвольно.
Только для некоторых химически неактивных металлов (золото, металлы платиновой группы) окисленное состояние термодинамически менее устойчиво, поэтому в природе они часто находятся в неокисленном состоянии. Остальные металлы находятся в природе в виде соединений, и для их получения необходимы затраты энергии на проведение реакция восстановления (металлургические процессы):
MexOy; Me(OH)n; MexAny →Me0; Men+ + nē → Me0; ∆rG>0.
9.1.Коррозионные процессы
Взависимости от условий эксплуатации металлических изделий внешняя среда состоит из газообразных или жидких веществ. Поэтому коррозия на границе «металл–газ», «металл–жидкость» является гетерогенным процессом, протекающим с изменением поверхности. Продукты коррозии, как правило, образуют на поверхности металла твердую фазу в виде пленок. Следовательно, коррозия должна включать в себя стадию диффузии реагентов через эти пленки.
Таким образом, коррозия является сложным физикохимическим процессом, включающим в себя как химические реакции, так и диффузию. Скорость коррозии определяется как природой металла и химическим составом окружающей среды, так и свойствами ее продуктов и зависит от температуры. Обычно скорость коррозии оценивают по убыли металла с единицы площади (K) или по скорости проникновения, т.е. по одностороннему уменьшению толщины нетронутого металла (П).
Массовый показатель (K) скорости коррозии представляет со-
бой изменение массы металла (∆m) за единицу времени (τ), отнесенное к единице поверхности образца (S): K=∆m/Sτ. Чаще всего
единицей измерения является г/(м2 сут).
Глубинный показатель (П) скорости коррозии характеризует среднюю глубину (h) разрушения металла за единицу времени (τ):
П=h/τ. Обычная единица измерения – мм/год.
Установлена 10-балльная шкала общей коррозионной стойкости металлов (табл. 9.1).
Т а б л и ц а 9.1
311
Группа стойкости |
Скорость коррозии металла, мм/год |
Балл |
|
|
|
|
|
Совершенно стойкие |
Менее 0,001 |
1 |
|
Весьма стойкие |
Свыше 0,001 до 0,005 |
2 |
|
|
0,005 до 0,01 |
3 |
|
Стойкие |
0,01 |
до 0,05 |
4 |
|
0,05 до 0,1 |
5 |
|
Понижено стойкие |
0,1 |
до 0,5 |
6 |
|
0,5 |
до 1,0 |
7 |
Малостойкие |
1,0 |
до 5,0 |
8 |
|
5,0 до 10,0 |
9 |
|
Нестойкие |
Свыше 10,0 |
10 |
|
Необходимо отметить, что коррозионная стойкость металла в различных средах может значительно различаться.
Показатели коррозионной стойкости некоторых металлов в кислоте, щелочи и морской воде:
|
20% НCl |
20% KOH |
Морская вода |
Алюминий................ |
9−10 |
10 |
5 |
Магний...................... |
10 |
3−4 |
10 |
Сталь 3...................... |
9−10 |
1−2 |
6−7 |
В особых случаях коррозия может оцениваться и по другим показателям (потеря механической прочности и пластичности, рост электрического сопротивления, уменьшение отражательной способности и т.д.), которые выбираются в соответствии с видом коррозии и назначением изделия или конструкции.
Потери в хозяйственной деятельности, понесенные вследствие коррозии, включают в себя потери металла за счет окисления (~20%, из них ~1,5…2% безвозвратно), стоимость оборудования, выведенного из строя в результате коррозии отдельных элементов, косвенные потери, связанные с ремонтом, простоем и т.д.
Знание основных закономерностей коррозионных процессов и способов борьбы с ней необходимо для повышения надежности и долговечности работы оборудования.
Классификация коррозионных процессов. Вследствие огром-
ного разнообразия коррозионных процессов они классифицируются по различным признакам: по характеру коррозионных разрушений металла, по составу коррозионной среды, по механизму коррозионного процесса, по характеру дополнительных воздействий, которым подвергается металл одновременно с действием кор-
312

розионной среды, и т.д.
По виду, геометрическому характеру разрушений поверхности или объема металла различают сплошную (общую) и местную (локальную) коррозию.
В случае сплошной коррозии разрушению подвергается вся поверхность металлического изделия, причем она может быть равномерной (рис. 9.1, а) и неравномерной (рис. 9.1, б) в зависимости от того, одинакова ли глубина коррозионного разрушения на разных участках.
При местной коррозии (рис. 9.1, в–д) поражения локальны. Значительная часть поверхности остается практически незатронутой. В зависимости от степени локализации (соотношение поверхности и глубины проникновения коррозии) различают коррозионные пятна (разрушение отдельных участков на небольшую глубину), язвы (большая глубина поражения металла) и питтинг (точечное разрушение металла на относительно большую глубину).
а) |
|
б) |
|
|
среда |
среда |
|||
|
|
металл |
в) |
|
г) |
|
|
среда |
среда |
|||
|
|
металл
д) среда 
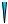
 металл
металл

Рис. 9.1. Основные виды коррозионных разрушений поверхности металла: сплошная равномерная (а) и неравномерная (б) коррозия;
местная коррозия – пятна (в), язвы (г) и питтинг (д)
Коррозия может приводить к микроскопическим разрушениям в металле (рис. 9.2). Все металлы являются поликристаллическими материалами, состоящими из большого числа произвольно ориентированных относительно друг друга мелких монокристаллов (зерно металла) одинакового или разного химического состава. Часто коррозионные процессы развиваются на границах зерен металла, продвигаясь в глубь материала, ослабляя химические связи
313

между микрокристаллами. Процесс такого типа называется межкристаллитной коррозией (рис.9.2, а). В металлическом изделии, находящемся под действием механических напряжений, коррозия может развиваться в виде трещины, рассекая металл прямо через зёрна − транскристаллитная коррозия (рис. 9.2, б). Эти два вида местной коррозии наиболее опасны, поскольку могут приводить к полной потере прочности и разрушению детали или конструкции. Они почти не оставляют видимых следов на поверхности, их трудно обнаружить и своевременно принять необходимые меры.
При коррозии сплавов может происходить избирательное разрушение одного из компонентов. Коррозия такого типа называется
селективной (рис.9.2, в).
а) среда



 металл
металл
б) среда
металл |
в) среда
металл |
Рис. 9.2. Основные виды микроскопических коррозионных разрушений металла: межкристаллитная (а), транскристаллитная (б), селективная (избирательная) (в)
Отдельные коррозионные среды и вызываемые ими разрушения столь характерны, что по их названию классифицируют и протекающие в них коррозионные процессы.
Выделяют газовую коррозию, протекающую под действием газов в условиях, исключающих образование на поверхности металла жидкой фазы. В отдельный тип выделяют атмосферную коррозию – разрушение металлов под действием природной атмосферы при относительно низкой температуре, приводящей к возможности образования жидкой фазы воды на поверхности металла.
Коррозия металлов при контакте с жидкими агрессивными средами делится на коррозию в электролитах (водные растворы кислот, щелочей и солей) и неэлектролитах (нефть, топливо, смазки и др.).
Коррозия металлических конструкций в грунтах и почвах называется почвенной или подземной коррозией.
В ряде случаев металл подвергается дополнительным воздейст-
314
