
- •Краткий курс лекций по биологической химии для студентов, обучающихся по специальности Педиатрия
- •1.1. Содержание белковв организме человека
- •1.2. Биологические функции белков
- •1.3. Химический состав белков
- •1.3. 1. Элементарный состав белков
- •1.3.2. Аминокислотный состав белков
- •1.4. Виды связей аминокислот в белках
- •1. 5. Структурная организация белков
- •1. 5. 1. Первичная структура белков
- •1. 5. 2. Вторичная структура белков
- •1. 5. 3. Третичная структура белков
- •1.5.4. Четвертичная структура белков
- •1. 5. 5. Доменные белки
- •1. 6. Физико-химические свойства белков
- •1.6. 1. Растворимость белков
- •1. 6. 2. Молекулярная масса белков
- •1.6.3. Размеры и форма белковых молекул
- •1.6.4. Свойства белков, сходные со свойствами коллоидных растворов
- •1.6.5. Оптические свойства белковых растворов
- •1.6.6. Свойства белков как истинных растворов
- •1.6.6. 1. Заряд белковой молекулы
- •1.6.6.2. Формирование гидратной (водной) оболочки
- •1.7. Осаждение белков из растворов
- •1.8. Методы количественного определения белков
- •1.9. Выделение, фракционирование и очистка белков
- •1.10. Классификация белков
- •1.10.1. Простые белки (протеины)
- •1.10.2. Сложные белки (протеиды)
- •2. Структура, свойства и механизм действия ферментов
- •2.1. Краткая история ферментологии
- •2.2. Структура ферментов
- •2.3. Механизм действия ферментов
- •2.4. Номенклатура ферментов
- •2.5. Классификация ферментов
- •2.6. Свойства ферментов
- •2.6.1. Высокая каталитическая активность ферментов
- •2.6.2. Высокая специфичность ферментов
- •2.6.3. Термолябильность ферментов
- •2.6.4. Фотолябильность ферментов
- •2.6.5. Зависимость активности ферментов от рН.
- •2.6. 6. Зависимость скорости ферментативной реакции от концентрации фермента и концентрации субстрата
- •2.6.7. Зависимость скорости ферментативных реакций от присутствия активаторов и ингибиторов.
- •2.6.7.1. Влияние активаторов ферментов
- •2.6.7.2. Влияние ингибиторов ферментов
- •2.8. Регуляция активности ферментов в процессе метаболизма
- •2.9. Структурная организация ферментов в клетке
- •2.10. Принципы обнаружения и количественного определения ферментов:
- •2.10.1. Количественное определение ферментов
- •3. Введение в обмен веществ. Биохимия питания. Витамины
- •3.1. Общие сведения об обмене веществ
- •3.2. Биохимия питания
- •3.2.1. Краткая характеристика питательных веществ
- •3.3. Биохимия витаминов
- •3.3.1. Номенклатура витаминов
- •3.3.2. Классификация витаминов
- •3.3.3. Биологическая роль витаминов
- •3.3.4. Обмен витаминов
- •3.3.5. Краткая характеристика некоторых витаминов
- •3.4. Биохимические основы рационального вскармливания грудных детей
- •3.4.1. Химический состав грудного молока
- •Биологически активные компоненты грудного молока.
- •4. Биологическое окисление
- •4.1. Функции биологического окисления
- •4.2. Краткая история учения о биологическом окислении
- •4.3. Виды биологического окисления
- •4.4. Ферменты и коферменты биологического окисления
- •4.4.1. Никотинамидзависимые дегидрогеназы (над, надф-зависимые)
- •4.4.1.1. Витамин рр
- •4.4.2. Флавопротеиды (флавиновые дегидрогеназы)
- •4.4.2.1. Витамин в2
- •4.4.3. Убихинон (КоQ)
- •4.4.4. Цитохромы
- •4.4. 5. Оксигеназы
- •4.4.6. Пероксидазы
- •4.5. Внутримитохондриальное окисление
- •4.5.1. Длинная дыхательная цепь
- •4.5.2. Короткая дыхательная цепь
- •4.5.3. Окислительные комплексы и их ингибиторы
- •4.6. Энергетический обмен
- •5.6.1. Окислительное фосфолирирование
- •4.6.1. 1. Регуляция окислительного фосфолирирования
- •4.6.2. Особенности энергетического обмена у детей
- •4.6.3. Нарушение энергетического обмена.
- •4.7. Внемитохондриальное окисление
- •4.7.1. Окисление с участием оксидаз. Активные формы кислорода
- •4.7.2. Окисление с участием оксигеназ.
- •4.7.3. Пероксидазное окисление.
- •5. Общие пути катаболизма
- •5.1. Окислительное декарбоксилирование пировиноградной кислоты
- •5.1.1. Пируватдегидрогеназный комплекс
- •5.2. Цикл трикарбоновых кислот (цикл г. Кребса)
- •5.2.1. Химизм цикла Кребса (цикла трикарбоновых кислот)
- •5.2.2. Биологическое значение цикла Кребса
- •5.2.3. Регуляция активности цикла трикарбоновых кислот
- •6. Обмен и функции углеводов
- •6.1. Содержание углеводов в организме и их биологические функции
- •6.2. Классификация углеводов
- •6.2.1. Моносахариды и их производные
- •6.2.2. Олигосахариды
- •6.2.3. Полисахариды
- •6.2.3.1. Гомополисахариды
- •6.2.3.2. Гетерополисахариды (гликозаминогликаны)
- •6.2.3.3. Особенности содержания и обмена гликозаминогликанов и протеогликанов у детей.
- •6.3. Переваривание и всасывание углеводов
- •6.3.1. Особенности переваривания углеводов в детском возрасте
- •6.4.2. Распад гликогена
- •6.5. Обмен глюкозы в тканях
- •6.5.1. Окисление глюкозы в тканях
- •6.5.1.1. Анаэробное окисление глюкозы
- •6.5.1.2. Аэробное окисление глюкозы
- •6.5. 2. Биосинтез глюкозы (глюконеогенез)
- •6.5.2.1. Витамин н
- •6.6. Пентозофосфатный путь окисления глюкозы
- •6.7. Утилизация фруктозы и её нарушения
- •6.8. Усвоение галактозы и его нарушения
- •6.9. Взаимные превращения углеводов (гексоз)
- •6.10. Особенности обмена глюкозы в различных тканях
- •6.11. Регуляция углеводного обмена
- •6.12. Патология углеводного обмена
- •6.12.1. Нарушение переваривания и всасывания углеводов
- •6.12.2. Нарушения содержания глюкозы в крови
- •6.12.3. Нарушения тканевого обмена углеводов
- •7. Обмен и функции липидов
- •7.2.1.2. Глицерофосфолипиды (фл)
- •7.2.2. Сфингозинсодержащие липиды
- •7.2.2.1. Сфингофосфолипиды (сфингомиелины)
- •7.2.2.2. Сфингогликолипиды
- •7.2.3. Холестеринсодержащие липиды
- •7.3. Содержание липидов в организме человека
- •7.4. Биологические функции липидов
- •7.5. Структура и функции клеточных мембран
- •7.6. Переваривание липидов
- •7.7. Всасывание продуктов расщепления липидов
- •7.8. Ресинтез липидов в слизистой тонкого кишечника
- •7.9. Особенности переваривания и всасывании липидов у детей
- •7.10. Транспорт липидов кровью
- •7.11. Обмен триацилглицеринов
- •7.11.1. Распад триацилглицеринов в тканях (липолиз)
- •7.11.1.1. Окисление жирных кислот.
- •Химизм β - окисления насыщенных жирных кислот
- •7.11.2.3. Синтез триацилглицеринов
- •7.12. Обмен глицерофосфолипидов
- •7.12.1. Синтез глицерофосфолипидов
- •7.12.2. Распад глицерофосфолипидов
- •7.13. Обмен сфинголипидов
- •7.13.1. Синтез сфинголипидов
- •7.13. 2. Распад сфинголипидов
- •7.14. Обмен холестерина
- •7.14.1. Биосинтез холестерина
- •7.14.2. Использование холестерина в тканях
- •7.14.3. Выведение холестерина из организма
- •7.14.4. Нарушение обмена холестерина
- •7.15. Взаимосвязь липидного и углеводного обменов
- •7.15.1. Ацетоновые тела
- •7.16. Регуляция липидного обмена
- •7.17. Патология липидного обмена
- •7.18. Перекисное окисление липидов (пол)
- •7.18.1. Витамин е
- •7.19. Эйкозаноиды
- •7.19.1. Синтез и краткая характеристика эйкозаноидов
- •8. Обмен белков и аминокислот
- •8.1. Общие сведения об азотистом обмене
- •8.2. Переваривание белков
- •8.3. Всасывание аминокислот
- •8.4. Гниение белков в толстом кишечнике
- •8.4.1. Обезвреживание продуктов гниения белков в печени
- •8.5. Динамическое состояние белков в тканях организма
- •8.5.1. Пути образования и использования аминокислот в тканях
- •8.6. Катаболизм аминогруппп аминокислот
- •8.6.1. Трансаминирование аминокислот
- •8.6.1.1. ВитаминВ6
- •8.6.2. Дезаминирование аминокислот
- •8.6.2.1. Окислительное дезаминирование
- •8.6.2.2. Непрямое дезаминирование
- •8.6.2.3. Внутримолекулярное дезаминирование
- •8.7. Декарбоксилирование аминокислот. Биогенные амины
- •8.8. Образование и обезвреживание аммиака в организме
- •8.8.1. Пути временного (экстренного) связывания аммиака в тканях
- •8.8.1.1. Восстановительное аминирование альфа-кетокислот
- •8.8.1.2. Амидирование тканевых белков
- •8.8.1.3. Биосинтез глютамина
- •8.8.2. Конечные продукты азотистого обмена
- •8.8.2.1. Синтез аммонийных солей в почках
- •8.8.2.2. Биосинтез мочевины и его нарушения
- •Особенности выведения конечных азотистых продуктов у детей
- •Аферментозы биосинтеза мочевины
- •8.9. Обмен безазотистых радикалов аминокислот
- •8.10. Особенности обмена отдельных аминокислот
- •8.10.1. Обмен глицина и серина
- •8.10. 1.1. Фолиевая кислота
- •8.10. 2. Обмен серосодержащих аминокислот цистеина и метионина
- •8.10. 2.1. Витамин в12
- •8.10.2.2. Нарушения обмена серосодержащих аминокислот
- •8.10.3. Обмен фенилаланина и тирозина и его нарушения
- •8.11. Регуляция белкового обмена
- •8.12. Патология белкового обмена
- •9. Обмен и функции нуклеиновых кислот
- •9.1. Химический состав и строение нуклеиновых кислот
- •9.2. Обмен нуклеиновых кислот
- •9.2.1. Переваривание нуклеиновых кислот
- •9.2.2. Распад нуклеиновых кислот в тканях
- •9.2.2.1. Распад пуриновых нуклеотидов и его нарушения
- •9.2.2.2. Распад пиримидиновых нуклеотидов
- •9.2.3. Биосинтез пуриновых нуклеотидов и его нарушения
- •9.2.4. Биосинтез пиримидиновых нуклеотидов
- •9.3. Биосинтез днк
- •9.4. Биосинтез рнк (транскрипция)
- •9.5. Биосинтез белков (трансляция)
- •9.5.1. Характеристика генетического кода
- •9.5.2. Трансляция
- •9.5.3. Посттрансляционная модификация белков
- •9.5.4. Ингибиторы биосинтеза белка
- •9.5.5. Регуляция биосинтеза белка
- •10. Биохимия гормонов
- •10.1. Классификация гормонов по их химической природе
- •10.2. Общие сведения об обмене гормонов
- •10.3. Механизмы действия гормонов
- •10.3.2. Мембранный механизм действия водорастворимых гормонов
- •10.3.2.1. Циклические нуклеотиды - цАмф, цГмф - вторичные посредники
- •10.4. Краткая характеристика гормонов
- •10.4.1. Белково-пептидные гормоны
- •10.4.1.1. Гормоны гипофиза
- •10.4.1.2. Гормоны паращитовидных желез
- •10.4.1.3. Гормоны поджелудочной железы
- •10.4.1.4. Гормоны вилочкой железы
- •10.4.2. Гормоны- производные аминокислот
- •10.4.2.1. Гормоны щитовидной железы
- •10.4.2.2. Гормоны мозгового слоя надпочечников (катехоламины)
- •10.4.2.3. Гормоны эпифиза
- •10.4.3. Стероидные гормоны
- •10.4.3.1. Гормоны коры надпочечников
- •10.4.3.2. Мужские половые гормоны (андрогены)
- •10.4.3.3. Женские половые гормоны (эстрогены)
- •10.5. Гормоны плаценты
- •10.7. Особенности гормонального статуса у детей
- •11. Биохимия крови
- •11.1. Биохимия эритроцитов.
- •11.2. Обмен гемопротеидов
- •11.2.1. Синтез гема и его нарушения
- •11.2.2. Переваривание и распад гемоглобина в тканях
- •11.2.3. Нарушения распада гемоглобина
- •11.3. Химический состав плазмы крови
- •11.3.1. Белки плазмы крови
- •11.3.1.1. Изменение белкового состава крови при заболеваниях
- •11.3.2. Небелковые азотсодержащие вещества крови
- •11.3.2.1. Кининовая система крови.
- •11.3.3. Безазотистые органические вещества крови
- •11.3.4. Минеральные вещества крови
- •11.4. Физико-химические свойства крови.
- •11.4.1. Нарушения кислотно-основного баланса
- •11.4.2. Особенности кислотно-основного состояния у детей.
- •11.5. Дыхательная функция крови
- •11.5.1. Транспорт кислорода и его нарушения
- •11.5.2. Транспорт со2
- •11.6. Регуляция агрегатного состояния крови
- •11.6.1. Свёртывающая система крови
- •11.6.1.1. Плазменные факторы свёртывающей системы крови
- •11.6.1.2. Схема свёртывания крови
- •11.6.1.3. Витамин к
- •11.6.2. Противосвёртывающая система крови
- •11.6.3. Детские особенности системы гемостаза
- •11.6.4. Нарушения гемостаза
- •12. Водно–минеральный обмен
- •12.1. Водно-солевой обмен
- •12.1.1. Обмен натрия и калия
- •12.1.2. Регуляция водно-солевого обмена
- •12.1.3. Нарушение водно-солевого обмена
- •12.1.4. Роль почек в водно-солевом обмене
- •12.1.5. Особенности водного обмена у детей
- •12.2. Кальций - фосфорный обмен
- •12.2.1. Регуляция кальций – фосфорного обмена.
- •13.2.1.1. Витамин d
- •12.2.2. Нарушения кальций – фосфорного обмена
- •12.3. Обмен железа и его нарушения
- •13. Тканевая биохимия
- •13.1. Биохимия соединительной ткани
- •13.1.1. Витамин с
- •13.2. Биохимия мышечной ткани
- •13.3. Биохимия нервной ткани
- •13.4. Биохимия печени
- •Оглавление
1. 5. 2. Вторичная структура белков
Вторичная структура - регулярно повторяющаяся форма укладки полипептидной цепи в пространстве. Чаще всего в белках встречается 2 вида вторичной структуры: α - спираль и β – складчатая структура.
α – спираль в 1951 году изучена Л. Полингом с помощью рентгеноструктурного метода. Она представляет собой правозакрученную спиральную структуру, в одном витке которой укладывается 3,6 аминокислоты. Шаг спирали (расстояние между соседними витками) составляет 0,54 н.м. α - спираль фиксируется водородными связями, которые замыкаются между пептидными связями, образованными каждой 4-ой аминокислотой. Вторичная α - структура укладывается самопроизвольно и определяется первичной структурой белка. Доля участков, уложенных в спиральную структуру, в различных белках различна. Например, в гемоглобине, миоглобине преобладает α - структурная укладка, которая в 4 раза уменьшает размеры белковой молекулы.
β – структура имеет вид «гармошки» и стабилизируется водородными связями между удалёнными участками одной полипептидной цепи или между несколькими полипептидными цепями. Выделяют параллельные β – структуры, в которых N и С-концы соответствуют друг другу, и антипараллельные структуры. Примером белков, содержащих преимущественно β – структуры, являются фиброин шёлка, иммуноглобулины.
Вторичная структура белков (А - α – спираль, Б - β – структура)

Вторичную структуру изучают методами рентгеноструктурного анализа, исследованием поглощения белком ультрафиолетовых лучей (чем больше доля α – структур, тем больше поглощение).
Вторичная структура белков разрушается при денатурации.
1. 5. 3. Третичная структура белков
Третичная структура - специфическая для каждого белка форма укладки полипептидной цепи в пространстве. Данная структура формируется самопроизвольно и определяется первичной структурой. Третичная структура значительно, в десятки раз увеличивает компактность белка. В формировании третичной структуры участвуют нековалентные связи (гидрофобные, ионные) и ковалентные (дисульфидные) связи, изображённые на рисунке.
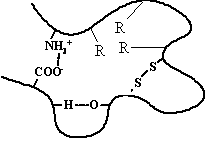
Третичная структура определяет биологическую активность и некоторые физико-химические свойства белков. Изменения в третичной структуре белка отражается на его биологической активности.
Методами изучения третичной структуры являются рентгеноструктурный анализ и определение химической доступности отдельных радикалов аминокислот в белке. Третичная структура белка миоглобина впервые была изучена Дж. Кендрью (1957 г.). М. Перутцем (1959 г.) была изучена структура гемоглобина.
В третичную структуру белков входят α - спиральные, β - складчатые структуры, β- петли (в них полипептидная цепь изгибается на 1800) и, так называемый, неупорядоченный клубок. Например, в белке инсулине содержится 57% α - спиральных участков, 6% β- складчатых структур, 10% молекулы уложены в виде β - петлей и 27% молекулы представляют неупорядоченный клубок.
Совокупность первичной, вторичной, третичной структур составляет конформацию белковой молекулы. Прижизненная (нативная) конформация формируется самопроизвольно, и её образование носит название фолдинг. Конформация белков очень не устойчива и формируется при участии особых белков – шаперонов (компаньонов). Шапероны способны связываться с частично денатурированными, находящимися в неустойчивом состоянии белками, и восстанавливать их нативную конформацию. Шапероны классифицируют по их молекулярной массе (60 – 100 кд.). Наиболее изучены Ш-60, Ш-70 и Ш-90. Например, Ш-70 взаимодействуют с белками, богатыми гидрофобными радикалами, защищают их от высокотемпературной денатурации. В целом шапероны экранируют основные белки организма, препятствуют денатурации и способствуют формировании конформации, облегчают транспорт денатурированных белков в лизосомы, участвуют в процессе синтеза белков.
По конформации все белки делятся на три группы:
фибриллярные белки: коллаген, эластин, фиброин;
глобулярные белки: гемоглобин, альбумин, глобулин;
смешанные белки: миозин.
Третичная структура присуща всем белкам.
