
- •Краткий курс лекций по биологической химии для студентов, обучающихся по специальности Педиатрия
- •1.1. Содержание белковв организме человека
- •1.2. Биологические функции белков
- •1.3. Химический состав белков
- •1.3. 1. Элементарный состав белков
- •1.3.2. Аминокислотный состав белков
- •1.4. Виды связей аминокислот в белках
- •1. 5. Структурная организация белков
- •1. 5. 1. Первичная структура белков
- •1. 5. 2. Вторичная структура белков
- •1. 5. 3. Третичная структура белков
- •1.5.4. Четвертичная структура белков
- •1. 5. 5. Доменные белки
- •1. 6. Физико-химические свойства белков
- •1.6. 1. Растворимость белков
- •1. 6. 2. Молекулярная масса белков
- •1.6.3. Размеры и форма белковых молекул
- •1.6.4. Свойства белков, сходные со свойствами коллоидных растворов
- •1.6.5. Оптические свойства белковых растворов
- •1.6.6. Свойства белков как истинных растворов
- •1.6.6. 1. Заряд белковой молекулы
- •1.6.6.2. Формирование гидратной (водной) оболочки
- •1.7. Осаждение белков из растворов
- •1.8. Методы количественного определения белков
- •1.9. Выделение, фракционирование и очистка белков
- •1.10. Классификация белков
- •1.10.1. Простые белки (протеины)
- •1.10.2. Сложные белки (протеиды)
- •2. Структура, свойства и механизм действия ферментов
- •2.1. Краткая история ферментологии
- •2.2. Структура ферментов
- •2.3. Механизм действия ферментов
- •2.4. Номенклатура ферментов
- •2.5. Классификация ферментов
- •2.6. Свойства ферментов
- •2.6.1. Высокая каталитическая активность ферментов
- •2.6.2. Высокая специфичность ферментов
- •2.6.3. Термолябильность ферментов
- •2.6.4. Фотолябильность ферментов
- •2.6.5. Зависимость активности ферментов от рН.
- •2.6. 6. Зависимость скорости ферментативной реакции от концентрации фермента и концентрации субстрата
- •2.6.7. Зависимость скорости ферментативных реакций от присутствия активаторов и ингибиторов.
- •2.6.7.1. Влияние активаторов ферментов
- •2.6.7.2. Влияние ингибиторов ферментов
- •2.8. Регуляция активности ферментов в процессе метаболизма
- •2.9. Структурная организация ферментов в клетке
- •2.10. Принципы обнаружения и количественного определения ферментов:
- •2.10.1. Количественное определение ферментов
- •3. Введение в обмен веществ. Биохимия питания. Витамины
- •3.1. Общие сведения об обмене веществ
- •3.2. Биохимия питания
- •3.2.1. Краткая характеристика питательных веществ
- •3.3. Биохимия витаминов
- •3.3.1. Номенклатура витаминов
- •3.3.2. Классификация витаминов
- •3.3.3. Биологическая роль витаминов
- •3.3.4. Обмен витаминов
- •3.3.5. Краткая характеристика некоторых витаминов
- •3.4. Биохимические основы рационального вскармливания грудных детей
- •3.4.1. Химический состав грудного молока
- •Биологически активные компоненты грудного молока.
- •4. Биологическое окисление
- •4.1. Функции биологического окисления
- •4.2. Краткая история учения о биологическом окислении
- •4.3. Виды биологического окисления
- •4.4. Ферменты и коферменты биологического окисления
- •4.4.1. Никотинамидзависимые дегидрогеназы (над, надф-зависимые)
- •4.4.1.1. Витамин рр
- •4.4.2. Флавопротеиды (флавиновые дегидрогеназы)
- •4.4.2.1. Витамин в2
- •4.4.3. Убихинон (КоQ)
- •4.4.4. Цитохромы
- •4.4. 5. Оксигеназы
- •4.4.6. Пероксидазы
- •4.5. Внутримитохондриальное окисление
- •4.5.1. Длинная дыхательная цепь
- •4.5.2. Короткая дыхательная цепь
- •4.5.3. Окислительные комплексы и их ингибиторы
- •4.6. Энергетический обмен
- •5.6.1. Окислительное фосфолирирование
- •4.6.1. 1. Регуляция окислительного фосфолирирования
- •4.6.2. Особенности энергетического обмена у детей
- •4.6.3. Нарушение энергетического обмена.
- •4.7. Внемитохондриальное окисление
- •4.7.1. Окисление с участием оксидаз. Активные формы кислорода
- •4.7.2. Окисление с участием оксигеназ.
- •4.7.3. Пероксидазное окисление.
- •5. Общие пути катаболизма
- •5.1. Окислительное декарбоксилирование пировиноградной кислоты
- •5.1.1. Пируватдегидрогеназный комплекс
- •5.2. Цикл трикарбоновых кислот (цикл г. Кребса)
- •5.2.1. Химизм цикла Кребса (цикла трикарбоновых кислот)
- •5.2.2. Биологическое значение цикла Кребса
- •5.2.3. Регуляция активности цикла трикарбоновых кислот
- •6. Обмен и функции углеводов
- •6.1. Содержание углеводов в организме и их биологические функции
- •6.2. Классификация углеводов
- •6.2.1. Моносахариды и их производные
- •6.2.2. Олигосахариды
- •6.2.3. Полисахариды
- •6.2.3.1. Гомополисахариды
- •6.2.3.2. Гетерополисахариды (гликозаминогликаны)
- •6.2.3.3. Особенности содержания и обмена гликозаминогликанов и протеогликанов у детей.
- •6.3. Переваривание и всасывание углеводов
- •6.3.1. Особенности переваривания углеводов в детском возрасте
- •6.4.2. Распад гликогена
- •6.5. Обмен глюкозы в тканях
- •6.5.1. Окисление глюкозы в тканях
- •6.5.1.1. Анаэробное окисление глюкозы
- •6.5.1.2. Аэробное окисление глюкозы
- •6.5. 2. Биосинтез глюкозы (глюконеогенез)
- •6.5.2.1. Витамин н
- •6.6. Пентозофосфатный путь окисления глюкозы
- •6.7. Утилизация фруктозы и её нарушения
- •6.8. Усвоение галактозы и его нарушения
- •6.9. Взаимные превращения углеводов (гексоз)
- •6.10. Особенности обмена глюкозы в различных тканях
- •6.11. Регуляция углеводного обмена
- •6.12. Патология углеводного обмена
- •6.12.1. Нарушение переваривания и всасывания углеводов
- •6.12.2. Нарушения содержания глюкозы в крови
- •6.12.3. Нарушения тканевого обмена углеводов
- •7. Обмен и функции липидов
- •7.2.1.2. Глицерофосфолипиды (фл)
- •7.2.2. Сфингозинсодержащие липиды
- •7.2.2.1. Сфингофосфолипиды (сфингомиелины)
- •7.2.2.2. Сфингогликолипиды
- •7.2.3. Холестеринсодержащие липиды
- •7.3. Содержание липидов в организме человека
- •7.4. Биологические функции липидов
- •7.5. Структура и функции клеточных мембран
- •7.6. Переваривание липидов
- •7.7. Всасывание продуктов расщепления липидов
- •7.8. Ресинтез липидов в слизистой тонкого кишечника
- •7.9. Особенности переваривания и всасывании липидов у детей
- •7.10. Транспорт липидов кровью
- •7.11. Обмен триацилглицеринов
- •7.11.1. Распад триацилглицеринов в тканях (липолиз)
- •7.11.1.1. Окисление жирных кислот.
- •Химизм β - окисления насыщенных жирных кислот
- •7.11.2.3. Синтез триацилглицеринов
- •7.12. Обмен глицерофосфолипидов
- •7.12.1. Синтез глицерофосфолипидов
- •7.12.2. Распад глицерофосфолипидов
- •7.13. Обмен сфинголипидов
- •7.13.1. Синтез сфинголипидов
- •7.13. 2. Распад сфинголипидов
- •7.14. Обмен холестерина
- •7.14.1. Биосинтез холестерина
- •7.14.2. Использование холестерина в тканях
- •7.14.3. Выведение холестерина из организма
- •7.14.4. Нарушение обмена холестерина
- •7.15. Взаимосвязь липидного и углеводного обменов
- •7.15.1. Ацетоновые тела
- •7.16. Регуляция липидного обмена
- •7.17. Патология липидного обмена
- •7.18. Перекисное окисление липидов (пол)
- •7.18.1. Витамин е
- •7.19. Эйкозаноиды
- •7.19.1. Синтез и краткая характеристика эйкозаноидов
- •8. Обмен белков и аминокислот
- •8.1. Общие сведения об азотистом обмене
- •8.2. Переваривание белков
- •8.3. Всасывание аминокислот
- •8.4. Гниение белков в толстом кишечнике
- •8.4.1. Обезвреживание продуктов гниения белков в печени
- •8.5. Динамическое состояние белков в тканях организма
- •8.5.1. Пути образования и использования аминокислот в тканях
- •8.6. Катаболизм аминогруппп аминокислот
- •8.6.1. Трансаминирование аминокислот
- •8.6.1.1. ВитаминВ6
- •8.6.2. Дезаминирование аминокислот
- •8.6.2.1. Окислительное дезаминирование
- •8.6.2.2. Непрямое дезаминирование
- •8.6.2.3. Внутримолекулярное дезаминирование
- •8.7. Декарбоксилирование аминокислот. Биогенные амины
- •8.8. Образование и обезвреживание аммиака в организме
- •8.8.1. Пути временного (экстренного) связывания аммиака в тканях
- •8.8.1.1. Восстановительное аминирование альфа-кетокислот
- •8.8.1.2. Амидирование тканевых белков
- •8.8.1.3. Биосинтез глютамина
- •8.8.2. Конечные продукты азотистого обмена
- •8.8.2.1. Синтез аммонийных солей в почках
- •8.8.2.2. Биосинтез мочевины и его нарушения
- •Особенности выведения конечных азотистых продуктов у детей
- •Аферментозы биосинтеза мочевины
- •8.9. Обмен безазотистых радикалов аминокислот
- •8.10. Особенности обмена отдельных аминокислот
- •8.10.1. Обмен глицина и серина
- •8.10. 1.1. Фолиевая кислота
- •8.10. 2. Обмен серосодержащих аминокислот цистеина и метионина
- •8.10. 2.1. Витамин в12
- •8.10.2.2. Нарушения обмена серосодержащих аминокислот
- •8.10.3. Обмен фенилаланина и тирозина и его нарушения
- •8.11. Регуляция белкового обмена
- •8.12. Патология белкового обмена
- •9. Обмен и функции нуклеиновых кислот
- •9.1. Химический состав и строение нуклеиновых кислот
- •9.2. Обмен нуклеиновых кислот
- •9.2.1. Переваривание нуклеиновых кислот
- •9.2.2. Распад нуклеиновых кислот в тканях
- •9.2.2.1. Распад пуриновых нуклеотидов и его нарушения
- •9.2.2.2. Распад пиримидиновых нуклеотидов
- •9.2.3. Биосинтез пуриновых нуклеотидов и его нарушения
- •9.2.4. Биосинтез пиримидиновых нуклеотидов
- •9.3. Биосинтез днк
- •9.4. Биосинтез рнк (транскрипция)
- •9.5. Биосинтез белков (трансляция)
- •9.5.1. Характеристика генетического кода
- •9.5.2. Трансляция
- •9.5.3. Посттрансляционная модификация белков
- •9.5.4. Ингибиторы биосинтеза белка
- •9.5.5. Регуляция биосинтеза белка
- •10. Биохимия гормонов
- •10.1. Классификация гормонов по их химической природе
- •10.2. Общие сведения об обмене гормонов
- •10.3. Механизмы действия гормонов
- •10.3.2. Мембранный механизм действия водорастворимых гормонов
- •10.3.2.1. Циклические нуклеотиды - цАмф, цГмф - вторичные посредники
- •10.4. Краткая характеристика гормонов
- •10.4.1. Белково-пептидные гормоны
- •10.4.1.1. Гормоны гипофиза
- •10.4.1.2. Гормоны паращитовидных желез
- •10.4.1.3. Гормоны поджелудочной железы
- •10.4.1.4. Гормоны вилочкой железы
- •10.4.2. Гормоны- производные аминокислот
- •10.4.2.1. Гормоны щитовидной железы
- •10.4.2.2. Гормоны мозгового слоя надпочечников (катехоламины)
- •10.4.2.3. Гормоны эпифиза
- •10.4.3. Стероидные гормоны
- •10.4.3.1. Гормоны коры надпочечников
- •10.4.3.2. Мужские половые гормоны (андрогены)
- •10.4.3.3. Женские половые гормоны (эстрогены)
- •10.5. Гормоны плаценты
- •10.7. Особенности гормонального статуса у детей
- •11. Биохимия крови
- •11.1. Биохимия эритроцитов.
- •11.2. Обмен гемопротеидов
- •11.2.1. Синтез гема и его нарушения
- •11.2.2. Переваривание и распад гемоглобина в тканях
- •11.2.3. Нарушения распада гемоглобина
- •11.3. Химический состав плазмы крови
- •11.3.1. Белки плазмы крови
- •11.3.1.1. Изменение белкового состава крови при заболеваниях
- •11.3.2. Небелковые азотсодержащие вещества крови
- •11.3.2.1. Кининовая система крови.
- •11.3.3. Безазотистые органические вещества крови
- •11.3.4. Минеральные вещества крови
- •11.4. Физико-химические свойства крови.
- •11.4.1. Нарушения кислотно-основного баланса
- •11.4.2. Особенности кислотно-основного состояния у детей.
- •11.5. Дыхательная функция крови
- •11.5.1. Транспорт кислорода и его нарушения
- •11.5.2. Транспорт со2
- •11.6. Регуляция агрегатного состояния крови
- •11.6.1. Свёртывающая система крови
- •11.6.1.1. Плазменные факторы свёртывающей системы крови
- •11.6.1.2. Схема свёртывания крови
- •11.6.1.3. Витамин к
- •11.6.2. Противосвёртывающая система крови
- •11.6.3. Детские особенности системы гемостаза
- •11.6.4. Нарушения гемостаза
- •12. Водно–минеральный обмен
- •12.1. Водно-солевой обмен
- •12.1.1. Обмен натрия и калия
- •12.1.2. Регуляция водно-солевого обмена
- •12.1.3. Нарушение водно-солевого обмена
- •12.1.4. Роль почек в водно-солевом обмене
- •12.1.5. Особенности водного обмена у детей
- •12.2. Кальций - фосфорный обмен
- •12.2.1. Регуляция кальций – фосфорного обмена.
- •13.2.1.1. Витамин d
- •12.2.2. Нарушения кальций – фосфорного обмена
- •12.3. Обмен железа и его нарушения
- •13. Тканевая биохимия
- •13.1. Биохимия соединительной ткани
- •13.1.1. Витамин с
- •13.2. Биохимия мышечной ткани
- •13.3. Биохимия нервной ткани
- •13.4. Биохимия печени
- •Оглавление
1.6.4. Свойства белков, сходные со свойствами коллоидных растворов
Многие молекулярно- кинетические свойства белковых растворов сходны со свойствами коллоидных растворов.
Медленная скорость диффузии белков;
Н
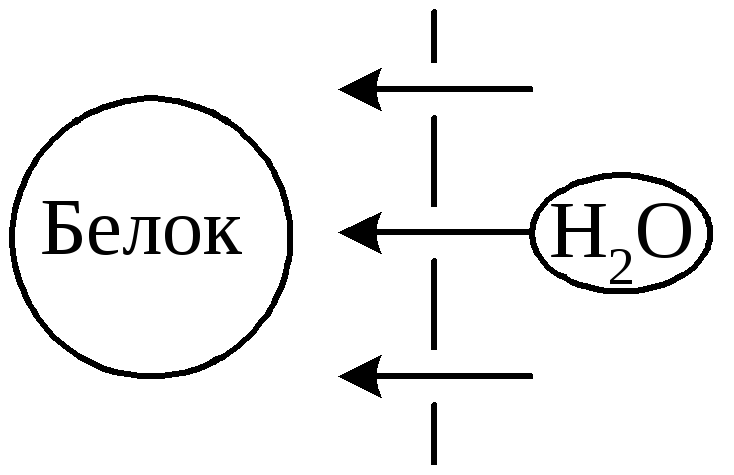 евозможность
прохождения белков через полупроницаемые
мембраны. В отсеках организма с высокой
концентрацией белка создаётся избыточное
гидростатическое давление, обусловленное
односторонним перемещением молекул
воды через полупроницаемую мембрану
в сторону высокой концентрации белка.
Избыточное давление, создаваемое
белками, называетсяонкотическимдавлением. Оно является важным фактором,
определяющим передвижение воды между
тканями, кровью, кишечником;
евозможность
прохождения белков через полупроницаемые
мембраны. В отсеках организма с высокой
концентрацией белка создаётся избыточное
гидростатическое давление, обусловленное
односторонним перемещением молекул
воды через полупроницаемую мембрану
в сторону высокой концентрации белка.
Избыточное давление, создаваемое
белками, называетсяонкотическимдавлением. Оно является важным фактором,
определяющим передвижение воды между
тканями, кровью, кишечником;Высокая вязкость белков обусловлена различными межмолекулярными взаимодействиями крупных белковых молекул. Повышенная вязкость крови, в частности, повышает нагрузку на сердечную мышцу;
Некоторые белки способны образовывать гели, что увеличивает прочность белков (например, коллаген).
1.6.5. Оптические свойства белковых растворов
Оптические свойства белков определяются размерами белковых молекул, структурой радикалов аминокислот в белках, а также наличием пептидных связей и альфа-спиральных участков в белках.
Белковые растворы обладают эффектом светопреломления (рефракции) и светорассеивания. Данные свойства обусловлены большими размерами белковых молекул, соизмеримыми с длиной волны видимой части спектра.. При этом короткие синие лучи рассеиваются в большей степени, чем более длинноволновые красные лучи. Степень рефракции пропорциональна концентрации белкового раствора.
Белковые растворы поглощают ультрафиолетовые лучив диапазоне 190-230 нм за счёт присутствия пептидных связей и в диапазоне 260-280 нм за счёт присутствия в белках циклических аминокислот. Степень поглощения УФЛ пропорциональна концентрации белка в растворе.
Белковые растворы способны вращать плоскость поляризованного света,что обусловлено оптической активностью содержащихся в белке аминокислот и наличием в нём альфа-спиральных участков. Изменение угла вращения поляризованного луча света изменяется при денатурационных воздействиях.
1.6.6. Свойства белков как истинных растворов
Белки, являясь молекулярными растворами, обладают свойствами истинных растворов. Будучи истинными растворами, белковые растворы отличаются высокой устойчивостью. Устойчивость белковым растворам придают два фактора: заряд белковой молекулы и гидратная оболочка.
1.6.6. 1. Заряд белковой молекулы
Появление заряда на молекулах белков связано с их амфотерными свойствами (наличием кислотных и основных свойств). Группы, способные приобретать заряды, называются ионогенными. К ним относятся СООН - группы глютамата, аспартата, СООН - группы С-концевых аминокислот, NH2- группы лизина, аргинина, α-NH2. - группыN-концевых аминокислот, азот имидазольного кольца гистидина. В очень незначительной степени ионизируются –SHгруппы цистеина и –OHгруппы тирозина. Ионизация различных функциональных групп белка групп определяется величиной рН среды.
Ионизация кислотных групп (СООН - группы – доноры Н+).
При рН = 2-4 половина карбоксильных групп в белках находится в ионизированном состоянии (–СОО-), половина – в неионизированном виде(–СООН). При физиологических значениях рН в интервале 7,35 – 7,45 (более щелочная среда) карбоксильные группы полностью ионизированы и определяютотрицательный зарядбелковой молекулы.
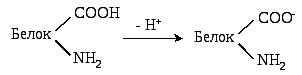
Ионизация щелочных групп (NH2 -группы - акцепторы Н+)
При рН около 10 половина аминогрупп белков ионизирована, а половина не ионизирована. При физиологических величинах рН =7.4 (более кислая среда) преобладает ионизированная форма аминогрупп (NH3+), придающая белковым молекуламположительный заряд.

Кислотно-основные свойства белков и аминокислот изучают методом потенциометрического титрования. Изменение ионизации белка при разных значениях рН имеет вид графика, приведенного ниже.
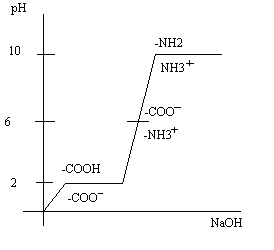
Из всех аминокислот только гистидин обладает буферными свойствами при рН = 6-7. Входя в состав белка гемоглобина, гистидин определяет его буферные свойства, необходимые для связывания кислорода.
Изменениями величины рН среды белок можно перевести в особое изоэлектрическое(электронейстральное) состояние, в котором сумма положительных зарядов равна сумме отрицательных зарядов, а молекула в целом электронейтральна
(+Н3N- белок - СОО-). Значение рН, при котором молекула белка электронейтральна, называется изоэлектрической точкой (ИЭТ). Для большинства белков изоэлектрическая точка находится в кислой среде (рН = 5-5,5). В то же время для гистонов ИЭТ находится в щелочной среде (рН= 9-11). В изоэлектрическом состоянии белки менее устойчивы, чем при наличии зарядов, поскольку одинаковый по знаку заряд белковой молекулы является фактором электростатического отталкивания белковых молекул, определяет ионные связи в белках и формирует наиболее стабильную конформацию белковой молекулы.
Таким образом, заряд белковой молекулы является одним из стабилизирующих факторов, препятствующим осаждению белков из растворов.
