
- •1. Основные положения статистической термодинамики
- •1.1. Понятия и начала феноменологической термодинамики.
- •1.2. Микроскопическое (механическое) описание классических систем.
- •1.3. Особенности представления квантовых систем
- •1.4. Вероятность нахождения системы в элементе фазового пространства. Метод ансамблей Гиббса.
- •1.5. Макроскопические величины как фазовые средние
- •1.6. Распределение в системах с постоянным числом частиц
- •1.6.2. Распределения Гиббса.
- •1.6.3. Квазиклассическое приближение.
- •1.7. Свойства распределения Гиббса
- •1.8. Большое каноническое распределение Гиббса
- •2. Статистика идеального газа
- •2.1. Идеальный газ как модель статистической системы
- •2.2. Распределение Максвелла
- •2.3. Столкновения молекул со стенкой сосуда. Давление
- •2.4. Характерные величины идеального газа
- •2.5. Столкновение молекул между собой
- •2.6. Длина свободного пробега
- •2.7. Идеальный газ во внешнем поле
- •2.8. Число и функция состояний идеального газа
- •2.9. Классическая теория теплоемкости газа двухатомных молекул
- •2.10. Квантовая теория теплоемкости газа двухатомных молекул
- •2.11. Распределения в квантовых системах
- •3. Законы термодинамики
- •3.1. Статистическое обоснование первого начала термодинамики
- •3.2. Второе начало термодинамики
- •3.3. Вечный двигатель второго рода. Максимальная работа процессов
- •3.4. Полезная работа тепловых машин
- •3.5. Метод термодинамических потенциалов
- •3.6. Термодинамические коэффициенты. Критерии устойчивости равновесия
- •3.7. Статистическое вычисление термодинамических величин
- •3.8. Третье начало термодинамики (теорема Нернста)
- •3.9. Применения термодинамики
- •4. Статистика сложных систем.
- •4.1. Модель кристаллического твердого тела. Уравнение движения атомов
- •4.2. Дисперсионное уравнение нормальных колебаний кристалла
- •4.3. Кристалл как система линейных гармонических осцилляторов
- •4.4. Статистическая сумма и энергия кристалла (в гармоническом приближении)
- •4.5. Теория теплоемкости Дебая
- •4.6. Электронный газ в металлах
- •4.7. Зависимость энергии электрона от волнового вектора. Эффективная масса
- •4.8. Теория парамагнетизма. Природа и характеристики магнетизма.
- •4.9. Равновесное излучение.
- •4.10. Системы с кулоновским взаимодействием частиц.
- •5. Теория малых флуктуаций
- •5.1. Определение и значение флуктуаций
- •5.2. Мера вероятности и масштаб флуктуаций
- •5.3. Флуктуации термодинамических величин в однородной среде
- •5.4. Предельная чувствительность измерительных приборов
- •5.5. Рассеяния света флуктуациями
- •6. Элементы теории физической кинетики
- •6.1. Определения и характеристики необратимых процессов
- •6.2. Теория стационарных процессов в газе свободных электронов
- •6.3. Газокинетическое уравнение Больцмана
- •6.4. Приближение времени релаксации
- •Раздел 2
- •Раздел 2
- •Раздел 3
- •Раздел 4
- •Раздел 5
- •Раздел 6
- •Список Литературы
СОДЕРЖАНИЕ
ВВЕДЕНИЕ. ЗАДАЧИ И ПРЕДМЕТ ТЕРМОДИНАМИКИ И СТАТИСТИЧЕСКОЙ ФИЗИКИ 10
1. ОСНОВНЫЕ ПОЛОЖЕНИЯ СТАТИСТИЧЕСКОЙ ТЕРМОДИНАМИКИ 18
1.1. Понятия и начала феноменологической термодинамики 18
1.2. Микроскопическое (механическое) описание классических систем 24
1.2.1 Уравнения движения точечных масс (материальных точек) 24
1.2.2. Фазовое пространство 28
1.3. Особенности представления квантовых систем 33
1.4. Вероятность нахождения системы в элементе фазового пространства. Метод ансамблей Гиббса 39
1.5. Макроскопические величины как фазовые средние 44
1.6. Распределение в системах с постоянным числом частиц 46
1.6.1. Квазинезависимые системы. Основная задача статистики 46
1.6.2. Распределения Гиббса 49
1.6.3. Квазиклассическое приближение 53
1.7. Свойства распределения Гиббса 54
1.8. Большое каноническое распределение Гиббса 56
2. СТАТИСТИКА ИДЕАЛЬНОГО ГАЗА 62
2.1. Идеальный газ как модель статистической системы 62
2.2. Распределение Максвелла 65
2.3. Столкновения молекул со стенкой сосуда. Давление 67
2.4. Характерные величины идеального газа 69
2.4.1. Свойства распределения Максвелла 69
2.4.2. Опыт Штерна 70
2.4.3. Средние скорости и энергия молекул 71
2.5. Столкновение молекул между собой 74
2.6. Длина свободного пробега 77
2.7. Идеальный газ во внешнем поле 80
2.7.1. Распределение Больцмана 80
2.7.2. Идеальный газ в гравитационном поле 81
2.7.3. Вес и потенциальная энергия 83
2.8. Число и функция состояний идеального газа 85
2.8.1. Число состояний и критерий невырожденности 85
2.8.2. Функция распределения идеального газа 86
2.8.3. Функция (интеграл) состояний 87
2.9. Классическая теория теплоемкости газа двухатомных молекул 89
2.10. Квантовая теория теплоемкости газа двухатомных молекул 93
2.10.1. Базовые положения 93
2.10.2. Функция состояний и энергия колебаний 95
2.10.3. Функция состояний и энергия вращений 98
2.11. Распределения в квантовых системах 101
2.11.1. Метод ячеек в фазовом пространстве 101
2.11.2. Квантовые распределения для идеального газа 106
2.11.3. Функция распределения фермионов. Параметры электронного газа 112
2.11.4. Статистика фотонного газа 118
3. ЗАКОНЫ ТЕРМОДИНАМИКИ 121
3.1. Статистическое обоснование первого начала термодинамики 121
3.1.1. Статистическое определение внутренней энергии 121
3.1.2. Первое начало термодинамики 122
3.1.3. Основное термодинамическое равенство 124
3.2. Второе начало термодинамики 127
3.2.1. Статистический смысл энтропии 127
3.2.2. Формула Больцмана 127
3.2.3. Закон возрастания энтропии 128
3.3. Вечный двигатель второго рода. Максимальная работа процессов 131
3.4. Полезная работа тепловых машин 133
3.4.1. Тепловые машины периодического действия 133
3.4.2. Тепловые машины однократного действия 135
3.5. Метод термодинамических потенциалов 138
3.5.1. Определение и физический смысл потенциалов 138
3.5.2. Дифференциальные соотношения термодинамики. Уравнения Гиббса-Гельмгольца 141
3.5.3. Потенциалы систем с переменным числом частиц 143
3.6. Термодинамические коэффициенты. Критерии устойчивости равновесия 145
3.6.1. Теплоемкости 145
3.6.2. Термические и упругие коэффициенты 147
3.6.3. Критерии устойчивости равновесия однородной системы 148
3.7. Статистическое вычисление термодинамических величин 149
3.8. Третье начало термодинамики (теорема Нернста) 153
3.9. Применения термодинамики. 156
3.9.1. Охлаждение газа при необратимом адиабатическом расширении 156
3.9.2. Термодинамика диэлектриков и магнетиков 159
4. СТАТИСТИКА СЛОЖНЫХ СИСТЕМ 165
4.1. Модель кристаллического твердого тела. Уравнение движения атомов 165
4.2. Дисперсионное уравнение нормальных колебаний кристалла 168
4.3. Кристалл как система линейных гармонических осцилляторов 171
4.4. Статистическая сумма и энергия кристалла (в гармоническом приближении) 174
4.5. Теория теплоемкости Дебая 177
4.5.1. Спектральная плотность нормальных колебаний 177
4.5.2. Потенциал, энтропия и теплоемкость кристалла 180
4.5.3. Теплоемкость электронного газа 185
4.6. Электронный газ в металлах 186
4.6.1. Модель свободных электронов 186
4.6.2. Обобществление электронов 186
4.6.3. Обоснование модели свободных электронов 187
4.6.4. Энергетические зоны и статистика электронного газа 188
4.7. Зависимость энергии электрона от волнового вектора. Эффективная масса 190
4.7.1. Дисперсионное уравнение электрона в металле 190
4.7.2. Эффективная масса электрона 192
4.8. Теория парамагнетизма. Природа и характеристики магнетизма 195
4.8.1. Вектор магнитной поляризации. Классификация магнетиков 195
4.8.2. Классическая теория парамагнетизма Ланжевена 197
4.8.3. Понятие о квантовой теории парамагнетизма 198
4.8.4. Парамагнетизм электронного газа
4.9. Равновесное излучение. 201
4.9.1. Теория излучения Планка 201
4.9.2. Термодинамические потенциалы и параметры равновесного излучения 205
4.10. Системы с кулоновским взаимодействием частиц 207
4.10.1. Метод самосогласованного поля. Распределение электронов в МОП-транзисторах 207
4.10.2. Внутренняя энергия плазмы 211
4.10.3. Термодинамические потенциалы и параметры 213
4.10.4. Собственные продольные колебания 215
5. ТЕОРИЯ МАЛЫХ ФЛУКТУАЦИЙ 217
5.1. Определение и значение флуктуаций 217
5.2. Мера вероятности и масштаб флуктуаций 218
5.2.1. Флуктуации в замкнутых системах 218
5.2.2. Флуктуации в квазизамкнутых системах 220
5.3. Флуктуации термодинамических величин в однородной среде 223
5.3.1. Базовые соотношения. Критерии устойчивости равновесия 223
5.3.2. Флуктуации объема и температуры 225
5.3.3. Флуктуации давления и энтропии 226
5.3.4. Флуктуации числа частиц и плотности. Радиус корреляции 227
5.4. Предельная чувствительность измерительных приборов 229
5.4.1. Флуктуации в бестоковых измерительных приборах 230
5.4.2. Электрические флуктуации 232
5.4.3. Предельная чувствительность токовых приборов 234
5.5. Рассеяния света флуктуациями 239
6. ЭЛЕМЕНТЫ ТЕОРИИ ФИЗИЧЕСКОЙ КИНЕТИКИ 244
6.1. Определения и характеристики необратимых процессов 244
6.1.1. Релаксация 244
6.1.2. Явления переноса. Линейные диссипативные уравнения 245
6.1.3. Потоки физических величин 247
6.1.4. Уравнение непрерывности 249
6.2. Теория стационарных процессов в газе свободных электронов 250
6.2.1. Дрейфовая скорость электрона. Время релаксации 250
6.2.2. Электропроводность невырожденного и вырожденного электронных газов 251
6.2.3. Зависимость электропроводности проводника от температуры 254
6.2.4. Теплопроводность электронного газа. Закон Видемана-Франца 257
6.3. Газокинетическое уравнение Больцмана 259
6.3.1. Приближение Больцмана 259
6.3.2. Уравнение непрерывности в отсутствие столкновений 262
6.3.3. Учет столкновительных процессов 263
6.4. Приближение времени релаксации 266
6.4.1. Упрощенное уравнение Больцмана 266
6.4.2. Электропроводность электронного газа 267
6.4.3. Изотермический эффект Холла 271
ПРИЛОЖЕНИЯ 275
П. 1. Элементы теории вероятностей 275
П. 1.1. Определения и понятия теории вероятностей (ТВ) 275
П. 1.2. Свойства вероятностей 276
П. 1.3. Основные характеристики случайной величины 278
П. 1.4. Функции распределения 279
П. 2. Специальные функции и интегралы 281
П. 2.1. Гаммафункция 281
П. 2.2. Функции Гаусса и вероятности ошибок (error function) 281
П. 2.3. Интеграл Ферми 282
П. 3. Теорема Лиувилля 284
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 287
СПИСОК ЛИТЕРАТУРЫ 291
ВВЕДЕНИЕ
ЗАДАЧИ И ПРЕДМЕТ ТЕРМОДИНАМИКИ И СТАТИСТИЧЕСКОЙ ФИЗИКИ
Порядок изучения различных курсов как общей, так и теоретической физики последовательно определяется постепенным анализом все более сложных форм движения соответствующих структурных видов материи, как-то: макротел, молекул, атомов, элементарных частиц полей.
Законы простейшей формы движения – относительного перемещения тел в пространстве со временем изучает механика. Вне механики движением является и изменение качества. Термодинамика и статистическая физика рассматривают явления, обусловленные совокупным действием огромного числа непрерывно движущихся частиц (молекул, атомов, электронов и др.), из которых состоят тела. Беспорядочное их движение приобретает новые качества: макроскопические свойства таких систем совершенно не зависят от начального положения частиц, в то время как механическое состояние существенно зависит от начальных условий. Возрастание количества механически движущихся частиц в системе порождает качественно новый вид движения – тепловое. Определяющим для его возникновения является не механическое движение отдельных частиц системы, а существование коллектива большого числа частиц. Действительно, закономерности теплового движения проявляются не только в атомно-молекулярных совокупностях, но и в таких системах, как электромагнитное излучение, заключенное в некотором объеме.
Название «Термодинамика» не связано с понятием динамики, определяет не учение о движении тепла, а наряду о «движущихся силах», возникающих при тепловых процессах. Об этом говорит первое сочинение по термодинамике «Размышления о движущей силе огня и о машинах, способных развивать эту силу» (Сади Карно, 1824 г.). Здесь под «движущей силой» понималось полезное действие (работа), которое двигатель может дать за счет тепла. Таким образом, термодинамика – наука о законах теплового движения (термо) и его превращениях в другие виды движения. Она изучает тепловые свойства макроскопических систем, не обращаясь к микроскопическому строению составляющих её частей.
Законы термодинамики установлены на основе многочисленных опытных данных и наблюдений за свойствами макроскопических систем. Термодинамика – наука дедуктивная, черпающая главное свое содержание из двух исходных законов – начал, поэтому подобно электродинамике является феноменологической. Невозможен процесс возникновения и исчезновения энергии – первое начало, а второе – невозможен процесс, имеющий единственным своим результатом превращение теплоты в работу. Эти начала имеют около десятка различных формулировок, большая часть которых эквивалентна одна другой. Разнообразие формулировок связано с проявлением этих законов в тех или иных конкретных явлениях.
Предметом изучения термодинамики служат все факты физики и химии, которые представляют собой статистически закономерный результат молекулярных и атомных явлений. Типичными примерами фактов, подлежащих термодинамическому исследованию, являются: неупорядоченное проникновение молекул одного вещества в гущу молекул другого (растворение, абсорбция); охлаждение и нагревание, сопровождающиеся изменением интенсивности движения отдельных элементарных частиц вещества; химические реакции; кристаллизация, плавление, испарение, поляризация и т.п.
Поэтому область термодинамики ограничена в отношении размеров исследуемых тел. Они должны быть достаточно велики, чтобы было обеспечено выравнивание случайных событий микромира. Этому требованию удовлетворяют даже весьма малые тела: так как уже в булавочной головке содержится молекул больше, чем ведер воды в Каспийском море. С другой стороны, законы статистики не пригодны для выяснения свойств каждой частицы (молекулы, атома, иона, электрона) вещества. Поэтому к таким частицам не применимы законы термодинамики.
В качестве научной системы, исходящей из работ С. Карно и закона сохранения и превращения энергии, термодинамика появилась в 50-х годах XIX в. в трудах Клаузиуса и Томсона (Кельвина), давших современные формулировки второго начала, понятия энтропии и абсолютной температуры. Исторически термодинамика возникла из потребностей теплотехники. Её главной задачей в то время было создание точной и полной теории действия тепловых машин основы для проектирования и усовершенствования паровых поршневых машин, двигателей внутреннего сгорания, паровых турбин, холодильных машин и т.д. Здесь отправным пунктом явилась теорема, сформулированная С. Карно при решении практической задачи улучшения характеристик паровой машины. В связи с этим дальнейшее развитие в XIX в. получила термодинамика газов и паров, а ее главным содержанием было:
1) Исследование различных циклов с точки зрения их коэффициента полезного действия; 2) изучение свойств газов и паров; 3) разработка и создание термодинамических диаграмм для практических расчетов в области теплотехники. С этим направлением исследований связаны имена основателей термодинамики: Сади Карно, Бенуа Пьера Клайперона, Роберта Майера, Уильяма Томсона (Джоуля), Рудольфа Клаузиуса. В развитие этого направления в начале XX века разрабатывается теория течения и истечения паров. В целом, вся эта первая характерная для термодинамики XX в. линия развития представляет техническую термодинамику.
Первым характерным для термодинамики начала XX в. предметом исследования является свойства паров, жидкостей и твердых тел. О темпах развития этой области свидетельствует то, что разными авторами было предложено свыше ста уравнений состояния. Последующие исследования были направлены на фазовые равновесия и фазовые превращения и термодинамику электрических и магнитных процессов.
Особую роль в развитии физической науки имеет термодинамика лучистой энергии. История её связана с именами Густава Роберта Кирхгофа, Вильгельма Вина, Джона Рэлея, Джеймса Джинса, Хендрика Лоренца, Макса Планка, Людвига Больцмана и др. Общеизвестно, что в начале века развитие термодинамики лучистой энергии привело М. Планка к созданию теории квантов. Определилось огромное значение этой области термодинамики для металлургии, металлофизики, минералогии, геохимии.
Следующим характерным предметом изучения современной термодинамики являются химические реакции. Видное место в химической термодинамике занимает теория активности, которая обобщает формулы термодинамики идеальных газов (растворов) на любые реальные системы.
Таким образом, круг вопросов, при исследовании которых оказывается эффективным термодинамический подход, чрезвычайно широк: сюда следует отнести и новейшие исследования по теории упругости и биологию (термодинамика живых организмов), термодинамику оптических явлений, космических процессов. Получаемые при этом результаты имеют весьма большую общность и не требуют привлечения упрощенных моделей рассматриваемых систем.
Феноменологический характер термодинамики (отсутствие связи с молекулярной сущностью систем) приводит к важным результатам в отношении свойств физических систем, но, с другой стороны, ограничивает глубину изучения этих свойств, так как не позволяет вскрыть природу исследуемых явлений. Поэтому наряду с развитием термодинамики формировалась и молекулярно-кинетическая теория свойств физических систем. Практически все исследователи, имена которых связаны с термодинамикой, уделяли большое внимание молекулярно-кинетическому обоснованию ее результатов. Термодинамика – первый этап на пути к изучению закономерностей в коллективе большого числа непрерывно движущихся и взаимодействующих частиц. Для их всестороннего и более полного рассмотрения необходимо применение статистических методов. Обоснование законов термодинамики, их связь с законами движения частиц, из которых построены макротела, дается статистической физикой. Она же позволяет выяснить границы применимости термодинамики.
Статистическая физика и термодинамика – науки родственные. Предмет изучения этих наук един. Почти все, что является предметом изучения статистики, является также предметом изучения термодинамики. Общеизвестно, что термодинамические понятия, как теплота, энтропия, температура, имеют статистический смысл. Поэтому область приложения статистической физики так же, как и термодинамики, ограничена системами, которые содержат достаточно большое число частиц. Мерой «большого числа частиц» может служить постоянная Авогадро. Термодинамика выходит из первого и второго начал, статистика – из законов механики и теории вероятности. Мостом между этими двумя дисциплинами служит соотношение между энтропией и термодинамической вероятностью состояния, а именно: энтропия, с точки зрения статистики, есть величина, пропорциональная логарифму вероятности (формула Больцмана). Этот факт определяет энтропию как аддитивную величину, тогда как вероятность состояния системы равна произведению вероятностей состояния ее частей.
Несмотря на одинаковый с термодинамикой предмет изучения статистическая физика не ограничивается исследованием частных систем ее задача шире: выявить и изучить связь между макроскопическими свойствами изучаемых систем и законами движения микрочастиц, составляющих данную систему. Постановка такой задачи вытекает из реальности микрочастиц (молекул, атомов, электронов, фотонов и др.), существование которых не подвергается сомнению в современной физике.
Почти все тела состоят из огромного количества частиц (1022 см – 3), что накладывает особые условия на метод исследования подобных объектов. Мы оказываемся не в состоянии проследить за движением отдельных частиц, и кроме того, свойства обширной совокупности частиц не является суммой свойств отдельных молекул. На некоторой ступени нарастания числа частиц в агрегате рождается новое «качество». В этих условиях проявляются так называемые статистические закономерности, поэтому молекулярная теория вещества может быть только статистической. Однако было бы неправильно утверждать, что поведение отдельных частиц системы никак не влияет на её свойства в целом. Эта связь обязательно имеет место. Если изменяются законы движения отдельных частиц, или мы переходим от частиц одной природы к другим (положим, от атомов к электронам), изменяется поведение всей макроскопической системы. В основу статистической теории кладется определенная динамическая модель вещества и делаются некоторые статистические предположения об априорных вероятностях тех или иных микроскопических состояний динамической системы. Статистические закономерности дают возможность определять средние значения величин и оценивать вероятности любых других возможных значений. В основе современной статистической физики лежит метод Гиббса. С его помощью могут быть найдены средние значения любых величин, характеризующих состояние системы, основные термодинамические функции любой системы по её энергетическому спектру, а, следовательно, все термодинамические параметры. Метод Джозайя Вилларда Гиббса возник в теоретической физике как обобщение работ Р. Клаузиуса, Дж. Максвелла и особенно Л. Больцмана по атомистической теории тепла. За истекшие годы с момента выхода книги Дж. В. Гиббса «Принципы статистической механики» (1902 г.) с достаточной убедительностью было показано, что любая частная статистическая теория в наиболее строгом виде может быть построена на принципах, лежащих в основе метода Гиббса. Можно с уверенностью сказать, что метод Гиббса в статистической физике занимает такое же место, какое уравнения Максвелла – во всей теории электромагнетизма.
Развивая определенные представления о строении вещества, статистическая физика последовательно приближает нас к правильному пониманию объективных закономерностей окружающего нас мира. На этом пути статистическая физика добилась крупных успехов: обосновала первое и второе начала, выявила суть понятий температуры, энтропии, свободной энергии и др.; дала возможность вычисления термодинамических функций различных систем, заложила основу квантовой механики, объяснила законы равновесного излучения. Плодотворно её использование при анализе поведения электронов в металле, теплоемкостей газов и твердых тел.
Статистическая физика условно делится на теорию равновесных состояний и теорию неравновесных процессов. Соответственно в первом случае теория оперирует со стационарными средними величинами и вероятностями состояний, во втором же случае – с вероятностями и средними величинами, зависящими от времени. Различают классическую и квантовую статистическую физику в зависимости от исследуемой модели вещества. Ряд явлений отображается достаточно полно, если считать, что атомы и молекулы, составляющие систему, движутся по законам классической механики. Построенная на этой модели статистическая физика называется классической статистикой. Если нельзя игнорировать квантовые законы движения частиц, выбирается квантовая модель вещества, и соответствующая теория называется квантовой статистикой (см. таблицу).
Таблица
ТИП ПРОЦЕССОВ |
МОДЕЛЬ |
|
Классическая |
Квантовая |
|
Теория равновесных состояний |
Классическая статистика равновесных состояний (статистическая механика) |
Квантовая статистика равновесных состояний (квантовая статистика) |
Теория равновесных процессов |
Классическая теория неравновесных процессов (классическая кинематика) |
Квантовая теория неравновесных процессов (квантовая кинетика) |
Каждый из этих разделов может иметь подразделы. Например, если изучаются процессы при очень больших температурах (с большими скоростями микрочастиц), то модель вещества рассматривается как релятивистская, и соответственно, каждый из приведенных разделов будет представлен релятивистским и нерелятивистским подразделом.
Термодинамические закономерности составляют наиболее общую и надежную основу макроскопического явления. Аппарат термодинамики позволяет любое эмпирическое соотношение ассоциировать с первым и вторым началом, благодаря чему сразу могут быть получены достоверные и ценные следствия. В этом отношении методы статистики менее удобны, математический аппарат статистики громоздок. Поэтому попытки статистического вывода следствий из эмпирических закономерностей нередко оказывались бесплодными. Да и по существу этот прием – чужд духу статистики. Вследствие этого термодинамика в ряде случаев опережает статистику, и было бы заблуждением давать абсолютное преимущество статистической физике.
В настоящее время обе эти науки развиваются с равным успехом, дополняя и обогащая друг друга, что в итоге способствует правильному материалистическому пониманию явлений в окружающем нас мире.
1. Основные положения статистической термодинамики
1.1. Понятия и начала феноменологической термодинамики.
Задача статистической
термодинамики – определение параметров
макроскопической системы на основе
свойств образующих ее частиц, законов
их движения и взаимодействия. В механике
состояние системы в данный момент
времени полностью определяется положением
и скоростью каждой из ее точечных масс.
Для системы с большим (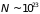 )
числом частиц практически невозможно
определить столько переменных. Поэтому
в термодинамике вводится другое, отличное
от динамического, более простое понятие
состояния системы. Здесь нет необходимости
вычисления
)
числом частиц практически невозможно
определить столько переменных. Поэтому
в термодинамике вводится другое, отличное
от динамического, более простое понятие
состояния системы. Здесь нет необходимости
вычисления
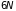 переменных, поскольку термодинамика
имеет дело с величинами, которые описывают
средние параметры системы, следовательно,
точное знание движения каждой точечной
массы было бы излишним.
переменных, поскольку термодинамика
имеет дело с величинами, которые описывают
средние параметры системы, следовательно,
точное знание движения каждой точечной
массы было бы излишним.
Состояние
термодинамической системы однозначно
определяется совокупностью независимых
физических параметров. Так, в системах,
состоящих из химически однородных газов
или жидкостей, такими параметрами
являются температура
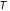 ,
объем
,
объем
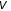 и давление
и давление
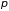 .
При данном количестве вещества объем
и давление не являются независимыми
величинами, они связаны соотношением
.
При данном количестве вещества объем
и давление не являются независимыми
величинами, они связаны соотношением
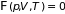 ,
,
которое называется уравнением состояния. Неоднородные системы, кроме давления, объема и температуры, характеризуются еще и концентрацией составляющих ее веществ. Если на систему действуют внешние, например, электрические или магнитные поля, то для ее описания вводится вектор электрической или магнитной поляризации. Обычно предполагается, что составные части термодинамической системы или находятся в покое, или движутся так медленно, что их кинетической энергией можно пренебречь. Когда эти условия не выполнены, для определения состояния системы следует задать скорости различных ее частей.
Каждому термодинамическому состоянию отвечает большое или бесконечное число соответствующих ему состояний молекулярного движения. С течением времени система проходит все микросостояния (динамические состояния) при заданных термодинамических параметрах. Иными словами термодинамическое состояние есть совокупность динамических состояний, через которые в результате молекулярного движения система быстро проходит. Такое определение состояния скорее абстрактное и отнюдь не единственное; поэтому, в каждом отдельном случае, следует указывать какими переменными величинами оно описывается.
Состояние системы, свойства которой не изменяются до тех пор, пока внешние условия остаются неизменными, называется равновесным. Например, газ, заключенный в сосуд постоянного объема, находится в равновесии, когда его давление повсюду постоянно и температура равна температуре окружающей среды.
Если замкнутая (или изолированная) система находится в равновесном состоянии, то в равновесии находятся и отдельные ее части – подсистемы. Следует отметить, что неизменность во времени состояния какого-либо тела еще не является достаточным признаком его термодинамического равновесия. Так, помещенный в термостат участок электрической цепи, по которому течет электрический ток, находится в стационарном состоянии практически неограниченное время. Однако оно не является равновесным: протекания тока сопровождается необратимым превращением электрического тока в тепло, отводимое в термостат. Примером стационарного, но не равновесного состояния являются открытые системы, характеризующиеся обменом вещества и энергии с окружающей средой. К ним относятся химические системы с непрерывными реакциями, а также все живые организмы. Во всех подобных случаях рассматриваемое тело является частью большой системы, находящейся в неравновесном состоянии.
Когда меняется
хотя бы один макроскопический параметр
системы, говорят о термодинамическом
процессе. Чаще всего речь идет о
переходе системы от начального к
конечному состоянию через непрерывную
последовательность промежуточных
состояний. Процесс считается обратимым,
когда последовательно проходимые
промежуточные состояния бесконечно
близки равновесным состояниям. Поэтому
обратимые процессы могут соединять
только равновесные начальные и конечные
состояния. На практике
их можно реализовать, если изменять
внешние условия так медленно, что система
успевает прийти в равновесное состояние,
соответствующее изменившимся условиям.
Если система была переведена из начального
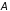 в конечное
в конечное
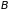 состояние при обратимом процессе, то
ее можно перевести посредством обратимого
превращения из конечного
в начальное
,
проходя через те же самые промежуточные
состояния, но в обратном порядке.
состояние при обратимом процессе, то
ее можно перевести посредством обратимого
превращения из конечного
в начальное
,
проходя через те же самые промежуточные
состояния, но в обратном порядке.
Величина, характеризующая систему и не зависящая от способа, посредством которого она приведена в данное состояние называется функцией состояния. К ним, в частности, относится внутренняя энергия – совокупность всех видов энергии, заключенной в изолированной системе. Она складывается из кинетической энергии движения частиц, образующих систему, их энергии взаимодействия и внутренней энергии самих частиц.
В основу термодинамики
положены многочисленные опытные данные
без привлечения представлений молекулярной
теории. Эти факты обобщены в два основных
положения (начала) термодинамики. Первое
начало термодинамики представляет
специальный случай всеобщего закона
сохранения и превращения энергии
применительно к тепловым процессам и
формулируются следующим образом.
Внутренняя энергия системы
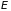 является функцией состояния, и ее
изменение определяется разностью между
количеством тепла
является функцией состояния, и ее
изменение определяется разностью между
количеством тепла
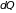 ,
сообщенным системе, и работой
,
сообщенным системе, и работой
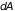 ,
совершенной системой (Р. Майер, 1842; Г.
Гельмгольц, 1847.):
,
совершенной системой (Р. Майер, 1842; Г.
Гельмгольц, 1847.):
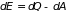 , (1.1)
, (1.1)
Это начало
термодинамики сформулировано на основе
неудачных попыток построить вечный
двигатель и экспериментов по установлению
механического эквивалента теплоты.
Теплота и работа в отличие от внутренней
энергии зависят как от начальных и
конечных состояний системы, так и от
пути, по которому проходила система. В
частности, совершаемая над газом работа
при изменении его объема от
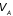 до
до
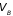 и заданном давлении
и заданном давлении
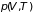 равна
равна
 .
.
т.е. при изотермическом
процессе (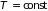 )
результат интегрирования зависит от
температуры.
)
результат интегрирования зависит от
температуры.
Многочисленные
попытки создать тепловую машину, полезная
работа которой производилась только
за счет охлаждения одного тела без
каких-либо изменений в других телах
(вечный двигатель второго рода), кончились
неудачно. Обобщение этих данных и легло
в основу второго начала термодинамики:
невозможно построить вечный двигатель
второго рода. Второе начало допускает
к аналитическую формулировку с введением
еще одной функции состояния – энтропии
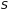 ,
изменение которой в обратимом процессе
определяется соотношением
,
изменение которой в обратимом процессе
определяется соотношением
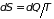 . (1.2)
. (1.2)
Согласно второму началу, направление возможных процессов, а также условия равновесия могут быть получены из закона возрастания энтропии (Р. Клаузиус, 1850; В. Томсон, 1851)
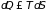 . (1.3)
. (1.3)
В замкнутых системах
( )
при любом реальном процессе
)
при любом реальном процессе
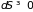 ;
знак равенства имеет место для обратимых
процессов. В состоянии равновесия
энтропия достигает максимума, и никакие
макроскопические процессы в замкнутой
системе невозможны. В общем случае из
второго начала следует необратимость
макроскопических процессов, протекающих
с конечной скоростью и связанных с
теплообменом при конечной разности
температур, с трением, диффузией газов,
расширением газов в пустоту, выделением
джоулева тепла и т.д. Существует несколько
эквивалентных формулировок второго
начала. В частности, невозможно реализовать
процесс (с помощью каких-либо машин или
приборов), единственным следствием
которого был бы переход тепла от одного
тела к другому, более нагретому.
;
знак равенства имеет место для обратимых
процессов. В состоянии равновесия
энтропия достигает максимума, и никакие
макроскопические процессы в замкнутой
системе невозможны. В общем случае из
второго начала следует необратимость
макроскопических процессов, протекающих
с конечной скоростью и связанных с
теплообменом при конечной разности
температур, с трением, диффузией газов,
расширением газов в пустоту, выделением
джоулева тепла и т.д. Существует несколько
эквивалентных формулировок второго
начала. В частности, невозможно реализовать
процесс (с помощью каких-либо машин или
приборов), единственным следствием
которого был бы переход тепла от одного
тела к другому, более нагретому.
При обратимых процессах (1.3) закон сохранения энергии может быть записан в виде (основное термодинамическое равенство):
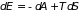 . (1.4)
. (1.4)
Если система помимо тепла и работы обменивается с окружающей средой и частицами, которые приносят или уносят с собой энергию, то равенство (1.1) должно быть дополнено соответствующим слагаемым
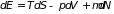 , (1.5)
, (1.5)
где
 – изменение числа частиц в системе.
Химический (парциальный) потенциал
– изменение числа частиц в системе.
Химический (парциальный) потенциал
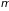 – суть энергия теплоизолированной
системы постоянного объема, которую
она теряет или приобретает при изменении
ее числа частиц на единицу:
– суть энергия теплоизолированной
системы постоянного объема, которую
она теряет или приобретает при изменении
ее числа частиц на единицу:
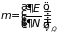 , (1.6)
, (1.6)
В
соответствии с (1.2) энтропия определяется
через приращение тепла, т.е. с точностью
до произвольной аддитивной постоянной.
Вместе с тем остаются неопределенными
и линейные по
члены в ряде термодинамических выражений.
Эта неопределенность устраняется
третьим началом термодинамики (В.
Нернст, 1906): энтропия системы стремится
к абсолютной постоянной величине (в
том числе, к нулю) при
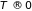 .
Отсюда вытекает ряд важных физических
следствий. В частности, при
обращаются в нуль теплоемкость,
коэффициент теплового расширения,
термический коэффициент давления.
.
Отсюда вытекает ряд важных физических
следствий. В частности, при
обращаются в нуль теплоемкость,
коэффициент теплового расширения,
термический коэффициент давления.
При описании процесса феноменологическая термодинамика устанавливает связь между изменениями термодинамических параметров в форме дифференциальных уравнений. Расчет характеристик конечного процесса требует интегрирования этих уравнений, что невозможно без знания уравнения состояния. Вывести же уравнения состояния феноменологическая термодинамика не может, здесь, как правило, использует экспериментально полученные соотношения. Ограниченность феноменологического метода, прежде всего в том, что он не дает возможностей теоретически рассчитать термодинамические функции и вывести уравнения состояния с учетом свойств частиц, образующих систему.
Кроме того, сами начала феноменологической термодинамики нуждаются в обосновании. В частности, требуют ответа следующие вопросы. Почему система, находящаяся в заданных условиях, с течением времени приходит в состояние равновесия и остается в этом состоянии до тех пор, пока сохраняются эти условия? Как объяснить наблюдаемую на опыте направленность естественных процессов? Какую интерпретацию дать характеризующим систему макроскопическим параметрам, особенно тем, которые не имеют аналогов в механике (температура, энтропия, химический потенциал). Хотя феноменологическая термодинамика раскрывает многие свойства этих функций и параметров, дать глубокое понимание их физического смысла она не в состоянии.
Решение поставленных общих проблем, а также задачи о количественной связи между макроскопическими свойствами системы и свойствами образующих систему частиц может быть достигнуто методами статистической физики. Указанный круг задач собственно и составляет предмет статистической термодинамики.
