
- •1. Основные положения статистической термодинамики
- •1.1. Понятия и начала феноменологической термодинамики.
- •1.2. Микроскопическое (механическое) описание классических систем.
- •1.3. Особенности представления квантовых систем
- •1.4. Вероятность нахождения системы в элементе фазового пространства. Метод ансамблей Гиббса.
- •1.5. Макроскопические величины как фазовые средние
- •1.6. Распределение в системах с постоянным числом частиц
- •1.6.2. Распределения Гиббса.
- •1.6.3. Квазиклассическое приближение.
- •1.7. Свойства распределения Гиббса
- •1.8. Большое каноническое распределение Гиббса
- •2. Статистика идеального газа
- •2.1. Идеальный газ как модель статистической системы
- •2.2. Распределение Максвелла
- •2.3. Столкновения молекул со стенкой сосуда. Давление
- •2.4. Характерные величины идеального газа
- •2.5. Столкновение молекул между собой
- •2.6. Длина свободного пробега
- •2.7. Идеальный газ во внешнем поле
- •2.8. Число и функция состояний идеального газа
- •2.9. Классическая теория теплоемкости газа двухатомных молекул
- •2.10. Квантовая теория теплоемкости газа двухатомных молекул
- •2.11. Распределения в квантовых системах
- •3. Законы термодинамики
- •3.1. Статистическое обоснование первого начала термодинамики
- •3.2. Второе начало термодинамики
- •3.3. Вечный двигатель второго рода. Максимальная работа процессов
- •3.4. Полезная работа тепловых машин
- •3.5. Метод термодинамических потенциалов
- •3.6. Термодинамические коэффициенты. Критерии устойчивости равновесия
- •3.7. Статистическое вычисление термодинамических величин
- •3.8. Третье начало термодинамики (теорема Нернста)
- •3.9. Применения термодинамики
- •4. Статистика сложных систем.
- •4.1. Модель кристаллического твердого тела. Уравнение движения атомов
- •4.2. Дисперсионное уравнение нормальных колебаний кристалла
- •4.3. Кристалл как система линейных гармонических осцилляторов
- •4.4. Статистическая сумма и энергия кристалла (в гармоническом приближении)
- •4.5. Теория теплоемкости Дебая
- •4.6. Электронный газ в металлах
- •4.7. Зависимость энергии электрона от волнового вектора. Эффективная масса
- •4.8. Теория парамагнетизма. Природа и характеристики магнетизма.
- •4.9. Равновесное излучение.
- •4.10. Системы с кулоновским взаимодействием частиц.
- •5. Теория малых флуктуаций
- •5.1. Определение и значение флуктуаций
- •5.2. Мера вероятности и масштаб флуктуаций
- •5.3. Флуктуации термодинамических величин в однородной среде
- •5.4. Предельная чувствительность измерительных приборов
- •5.5. Рассеяния света флуктуациями
- •6. Элементы теории физической кинетики
- •6.1. Определения и характеристики необратимых процессов
- •6.2. Теория стационарных процессов в газе свободных электронов
- •6.3. Газокинетическое уравнение Больцмана
- •6.4. Приближение времени релаксации
- •Раздел 2
- •Раздел 2
- •Раздел 3
- •Раздел 4
- •Раздел 5
- •Раздел 6
- •Список Литературы
3. Законы термодинамики
3.1. Статистическое обоснование первого начала термодинамики
3.1.1. Статистическое
определение внутренней энергии. С
работы С. Карно (1824 г) и определения
механического эквивалента тепла
термодинамика длительное время
развивалась вне связи с молекулярной
теорией. В её основу были положены
накопленные на практике многочисленные
факты, которые обобщены в два положения
– начала термодинамики. Как указывалось
ранее (раздел 1.1), первое из них
устанавливает, что изменение внутренней
энергии макроскопической системы
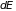 слагается из работы, произведенной ею
над внешними телами
,
и количества тепла, полученного системой,
(1.1):
слагается из работы, произведенной ею
над внешними телами
,
и количества тепла, полученного системой,
(1.1):
.
Под внутренней энергией системы здесь понималась полная энергия за вычетом кинетической энергии движения ее, как целого, и ее потенциальной энергии во внешнем поле. Второе начало представляет собой обобщение установленного экспериментального факта – невозможности построить вечный двигатель второго рода (раздел 1.1). Все другие выводы термодинамики являются непосредственным математическим следствием указанных начал. Достоверность и общность выводов – важнейшее достоинство термодинамических методов анализа. Недостаток их в том, что они не раскрывают физической, молекулярной сущности тепловых процессов, не объясняют смысл таких понятий как внутренняя энергия, температура, энтропия и т.п.
В основе молекулярной теории тепловых свойств вещества лежит единственное и весьма естественное допущение:
Внутренняя
энергия макроскопического тела
тождественна его средней энергии
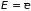 ,
вычисленной по законам статистической
физики. Так как в равновесной системе
с большим числом частиц средняя энергия
практически точно совпадает с её истинным
значением, то допущение можно сформулировать
иначе:
,
вычисленной по законам статистической
физики. Так как в равновесной системе
с большим числом частиц средняя энергия
практически точно совпадает с её истинным
значением, то допущение можно сформулировать
иначе:
Внутренняя энергия всякого макроскопического тела представляет энергию теплового движения молекул, из которых построено тело. Этим самым утверждается, что термодинамическая внутренняя энергия суть энергия теплового движения молекул, а теплота есть форма движения молекул. В настоящее время такое положение настолько обосновано экспериментально и теоретически, что термин «предположение» («допущение») кажется излишним. Принятое предположение позволяет полностью построить статистическую теорию тепловых явлений.
Для вычисления средней энергии воспользуемся общим правилом теории вероятности и каноническим распределением Гиббса:
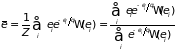 .
.
Суммирование ведется по всем уровням энергии. Обратив внимание на связь
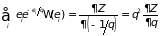 ,
,
определим внутреннюю энергию через функцию состояния :
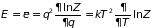 . (3.1)
. (3.1)
Отсюда следует, что состояние макроскопической системы, в частности, её внутренняя энергия зависит от температуры термостата . В состоянии статистического равновесия, при котором температура системы и термостата совпадают, можно говорить о зависимости внутренней энергии тела от его собственной температуры.
3.1.2. Первое начало термодинамики. Состояние тела зависит как от его температуры, так и от внешних условий. Последние определяются силовыми полями и характеризуются внешними параметрами. При конкретных условиях взаимодействия данной системы с окружающей средой в роли внешних параметров выступают различные физические величины. Так, если системой является газ, который находится в сосуде с подвижной стенкой (поршнем), то его состояние зависит от положения поршня (объема) – внешнего по отношению к системе параметра.
Обозначим
совокупность внешних параметров через
и будем рассматривать их влияние на
энергию системы
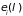 .
Только за счет изменения внешних
параметров изменится энергия системы:
.
Только за счет изменения внешних
параметров изменится энергия системы:
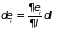 .
.
Величина
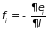 имеет смысл обобщенной силы, взятой с
обратным знаком (внешние силы производят
работу над системой!). При постоянной
функции распределения изменение
внутренней энергии вычисляется как
среднее значение изменения энергии
молекул в системе:
имеет смысл обобщенной силы, взятой с
обратным знаком (внешние силы производят
работу над системой!). При постоянной
функции распределения изменение
внутренней энергии вычисляется как
среднее значение изменения энергии
молекул в системе:
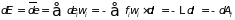 , (3.2)
, (3.2)
где
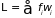 – средняя обобщенная сила, действующая
на систему. Формула связывает изменение
внутренней энергии с работой внешней
силы
– средняя обобщенная сила, действующая
на систему. Формула связывает изменение
внутренней энергии с работой внешней
силы
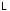 – (
– ( ).
Когда изменяются несколько внешних
параметров,
).
Когда изменяются несколько внешних
параметров,
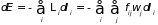 , (3.3)
, (3.3)
где
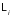 – обобщенная сила, соответствующая
-му
внешнему параметру
– обобщенная сила, соответствующая
-му
внешнему параметру
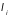 .
Очевидно, что приращение внутренней
энергии
.
Очевидно, что приращение внутренней
энергии
 только под воздействием внешних
параметров не представляет собой полного
дифференциала
только под воздействием внешних
параметров не представляет собой полного
дифференциала
Если наряду с воздействием внешних параметров происходит и обмен энергией между системой и термостатом, то функция распределения вероятностей меняется. И тогда полное изменение внутренней энергии можно записать в виде суммы
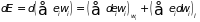 . (3.4)
. (3.4)
Первое слагаемое
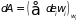 ,
по-прежнему, определяет работу, совершаемую
внешними силами над системой (или
системой над внешними телами) при
постоянной функции распределения
(вероятности
,
по-прежнему, определяет работу, совершаемую
внешними силами над системой (или
системой над внешними телами) при
постоянной функции распределения
(вероятности
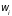 ).
Второе слагаемое представляет энергию
системы, которая не зависит от внешних
условий и обусловлена непосредственной
передачей энергии от частиц среды
частицам системы. Эту часть энергии
).
Второе слагаемое представляет энергию
системы, которая не зависит от внешних
условий и обусловлена непосредственной
передачей энергии от частиц среды
частицам системы. Эту часть энергии
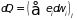 называют теплом. Таким образом
получаем закон сохранения энергии для
тепловых процессов – первое начало
термодинамики:
называют теплом. Таким образом
получаем закон сохранения энергии для
тепловых процессов – первое начало
термодинамики:
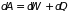 . (3.5)
. (3.5)
Обоснованием его в отличие от феноменологической термодинамики является формула (3.4), а статистический метод делает ясным физический смысл понятий внутренней энергии, работы, теплоты и связь их в термодинамическом процессе.
3.1.3. Основное термодинамическое равенство. Рассмотрим процессы, при которых систему в каждый отдельный момент времени можно считать находящейся в состоянии статистического равновесия, или в ходе которых система проходит последовательно ряд равновесных состояний. Такие процессы называются квазистатическими или обратимыми. Примером их реализации может служить процесс медленного сжатия газа в сосуде с подвижной стенкой – поршнем. При перемещении поршня в непосредственной близости от него образуется область с повышенной плотностью молекул. С течением времени, называемым временем релаксации, эта флуктуация плотности, благодаря столкновениям и хаотическому движению молекул, рассосётся по всему объему, то-есть газ вновь станет однородным. Теперь плотность уже отличается от первоначального значения. Если время, за которое поршень переместится на заметное расстояние, будет больше времени релаксации, то новое состояние системы (при новом положении поршня) будет вновь равновесным. Следовательно, условием квазистатичности процесса является его медленность. Каждому времени релаксации отвечает своя быстрота изменения внешних условий, при которых процесс можно считать квазистатическим, обратимым. Вполне обратимый процесс является некоторой идеализацией, поскольку реальные процессы всегда проходят с конечной скоростью и сопровождаются нарушением равновесия.
Для неравновесных систем процессы необратимые. Изменение внешних условий в обратной последовательности не будет означать, что система проходит те же состояния, что и в прямом процессе.
При квазистатическом
процессе система находится в состоянии
равновесия, и для вычисления
 используем распределение Гиббса:
используем распределение Гиббса:
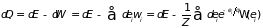 .
.
Поскольку число состояний при квазистатическом процессе сохраняется, то
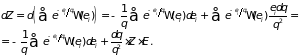 .
.
Откуда следует
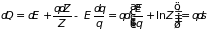 . (3.6)
. (3.6)
Здесь с точностью до произвольной постоянной определено количество тепла через изменение функции
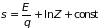 , (3.7)
, (3.7)
которая получила название статистической энтропии системы. Закон сохранения энергии при квазистатическом процессе может быть записан в виде:
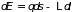 или
или
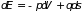 , (3.8)
, (3.8)
где
и давление
играют роль обобщенной силы. Формулы
(3.8) называются основными
термодинамическими
равенствами.
При постоянном числе частиц системы
изменение внутренней энергии
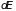 есть полный дифференциал, поэтому
обобщенные силы определяются следующим
образом:
есть полный дифференциал, поэтому
обобщенные силы определяются следующим
образом:
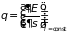 ,
,
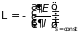 ,
,
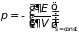 (3.9)
(3.9)
Формулы (3.8) по своей структуре имеет сходство с зависимостью изменения потенциальной энергии от обобщенной координаты в механике. По этой причине внутреннюю энергию называют термодинамическим потенциалом по отношению к обобщенным координатам и ( ).
Из неравенства
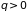 следует
следует
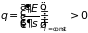 , (3.10)
, (3.10)
что означает монотонную зависимость энергии от энтропии. Другим важным свойством внутренней энергии является равенство нулю интеграла по замкнутому циклу возможных состояний системы
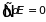 . (3.11)
. (3.11)
Внутренняя энергия
– однозначная функция состояния системы.
При возвращении системы в первоначальное
состояние её энергия также приобретает
прежнее значение. В отличие от
,
изменение работы и тепла (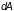 и
)
не являются полными дифференциалами:
как зависят не только от состояния
системы, но и от характера процесса.
Поэтому не имеет смысла говорить о
количестве тепла и работы в системе в
заданном состоянии. Смысл имеет лишь
изменение этих величин.
и
)
не являются полными дифференциалами:
как зависят не только от состояния
системы, но и от характера процесса.
Поэтому не имеет смысла говорить о
количестве тепла и работы в системе в
заданном состоянии. Смысл имеет лишь
изменение этих величин.
