
- •1. Основные положения статистической термодинамики
- •1.1. Понятия и начала феноменологической термодинамики.
- •1.2. Микроскопическое (механическое) описание классических систем.
- •1.3. Особенности представления квантовых систем
- •1.4. Вероятность нахождения системы в элементе фазового пространства. Метод ансамблей Гиббса.
- •1.5. Макроскопические величины как фазовые средние
- •1.6. Распределение в системах с постоянным числом частиц
- •1.6.2. Распределения Гиббса.
- •1.6.3. Квазиклассическое приближение.
- •1.7. Свойства распределения Гиббса
- •1.8. Большое каноническое распределение Гиббса
- •2. Статистика идеального газа
- •2.1. Идеальный газ как модель статистической системы
- •2.2. Распределение Максвелла
- •2.3. Столкновения молекул со стенкой сосуда. Давление
- •2.4. Характерные величины идеального газа
- •2.5. Столкновение молекул между собой
- •2.6. Длина свободного пробега
- •2.7. Идеальный газ во внешнем поле
- •2.8. Число и функция состояний идеального газа
- •2.9. Классическая теория теплоемкости газа двухатомных молекул
- •2.10. Квантовая теория теплоемкости газа двухатомных молекул
- •2.11. Распределения в квантовых системах
- •3. Законы термодинамики
- •3.1. Статистическое обоснование первого начала термодинамики
- •3.2. Второе начало термодинамики
- •3.3. Вечный двигатель второго рода. Максимальная работа процессов
- •3.4. Полезная работа тепловых машин
- •3.5. Метод термодинамических потенциалов
- •3.6. Термодинамические коэффициенты. Критерии устойчивости равновесия
- •3.7. Статистическое вычисление термодинамических величин
- •3.8. Третье начало термодинамики (теорема Нернста)
- •3.9. Применения термодинамики
- •4. Статистика сложных систем.
- •4.1. Модель кристаллического твердого тела. Уравнение движения атомов
- •4.2. Дисперсионное уравнение нормальных колебаний кристалла
- •4.3. Кристалл как система линейных гармонических осцилляторов
- •4.4. Статистическая сумма и энергия кристалла (в гармоническом приближении)
- •4.5. Теория теплоемкости Дебая
- •4.6. Электронный газ в металлах
- •4.7. Зависимость энергии электрона от волнового вектора. Эффективная масса
- •4.8. Теория парамагнетизма. Природа и характеристики магнетизма.
- •4.9. Равновесное излучение.
- •4.10. Системы с кулоновским взаимодействием частиц.
- •5. Теория малых флуктуаций
- •5.1. Определение и значение флуктуаций
- •5.2. Мера вероятности и масштаб флуктуаций
- •5.3. Флуктуации термодинамических величин в однородной среде
- •5.4. Предельная чувствительность измерительных приборов
- •5.5. Рассеяния света флуктуациями
- •6. Элементы теории физической кинетики
- •6.1. Определения и характеристики необратимых процессов
- •6.2. Теория стационарных процессов в газе свободных электронов
- •6.3. Газокинетическое уравнение Больцмана
- •6.4. Приближение времени релаксации
- •Раздел 2
- •Раздел 2
- •Раздел 3
- •Раздел 4
- •Раздел 5
- •Раздел 6
- •Список Литературы
2. Статистика идеального газа
2.1. Идеальный газ как модель статистической системы
В газообразном состоянии плотность вещества мала, так что среднее расстояние между молекулами значительно превышают их размеры. Поэтому большую часть всего времени движения каждая из частиц (атом или молекула) находится сравнительно далеко от остальных, и силы межмолекулярного взаимодействия существенно ослаблены. Поэтому газовые молекулы движутся прямолинейно и равномерно до тех пор, пока не произойдет столкновение между данной и какой-либо другой молекулой или со стенкой сосуда. При столкновениях можно считать молекулы недеформируемыми, т.е. рассматривать их как обычные упругие шары. В процессе столкновения происходит обмен кинетической энергией между молекулами и изменение направления их полета. Зеркальное (упругое) отражение имеет место при столкновении газовой молекулы со стенкой сосуда (молекулой вещества этой стенки).
В самом акте
столкновения молекулы взаимодействуют
между собой очень сильно. Их скорости
могут существенно измениться как по
абсолютной величине, так и по направлению.
Однако длительность (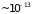 сек)
и частота (
сек)
и частота (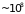 сек-1)
процессов соударения таковы, что
подавляющую часть времени газовые
молекулы движутся как свободные.
Траекторию каждой из них можно представить
как совокупность прямолинейных путей,
образующих ломанные линии. Длина
прямолинейных участков (
сек-1)
процессов соударения таковы, что
подавляющую часть времени газовые
молекулы движутся как свободные.
Траекторию каждой из них можно представить
как совокупность прямолинейных путей,
образующих ломанные линии. Длина
прямолинейных участков (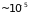 см)
намного превосходит размеры молекул
(
см)
намного превосходит размеры молекул
(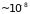 см).
В качестве модели разреженного газа
рассматривается идеальный газ.
см).
В качестве модели разреженного газа
рассматривается идеальный газ.
Статистическую систему, частицы которой взаимодействуют только в процессе столкновений, а остальное время двигаются как свободные, называют идеальным газом. Состояние такого газа описывает основное кинетическое уравнение состояния – уравнение Клайперона-Менделеева
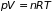 , (2.1.а)
, (2.1.а)
где
– давление,
– объем,
– абсолютная температура,
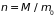 – количество молей,
– количество молей,
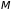 – масса газа,
– масса газа,
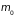 – масса моля,
– универсальная газовая постоянная.
Уравнение обобщает многочисленные
опытные данные и построено на
идеализированной модели молекулярного
движения в газе. В ее основе – пренебрежение
силами сцепления (отсутствие
взаимодействия). Это предположение –
в столь жесткой формулировке не имеет
достаточного основания. Для самопроизвольного
расширения газа достаточно, чтобы
средняя кинетическая энергия была
больше энергии притяжения молекул при
среднем их удалении друг от друга. Ведь
именно благодаря энергии межмолекулярного
взаимодействия совершается переход
газа в конденсированное состояние
вещества, жидкое или твердое. Указанный
закон выполняется для большинства газов
лишь приближенно и только при достаточно
высокой температуре. Например, учет
конечных размеров молекул и слабого
молекулярного взаимодействия приводит
к ряду полуэмпирических уравнений,
одним из которых есть уравнение
Ван-дер-Ваальса (для произвольного
количества молей вещества):
– масса моля,
– универсальная газовая постоянная.
Уравнение обобщает многочисленные
опытные данные и построено на
идеализированной модели молекулярного
движения в газе. В ее основе – пренебрежение
силами сцепления (отсутствие
взаимодействия). Это предположение –
в столь жесткой формулировке не имеет
достаточного основания. Для самопроизвольного
расширения газа достаточно, чтобы
средняя кинетическая энергия была
больше энергии притяжения молекул при
среднем их удалении друг от друга. Ведь
именно благодаря энергии межмолекулярного
взаимодействия совершается переход
газа в конденсированное состояние
вещества, жидкое или твердое. Указанный
закон выполняется для большинства газов
лишь приближенно и только при достаточно
высокой температуре. Например, учет
конечных размеров молекул и слабого
молекулярного взаимодействия приводит
к ряду полуэмпирических уравнений,
одним из которых есть уравнение
Ван-дер-Ваальса (для произвольного
количества молей вещества):
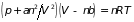 . (2.1.б)
. (2.1.б)
Здесь притяжение
молекул учитывается фактором
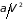 ,
где
– поправка на давление, а отталкивание
– «мертвый» объемом
,
где
– поправка на давление, а отталкивание
– «мертвый» объемом
 ,
который приблизительно в 4 раза превышает
собственный объем молекулы.
,
который приблизительно в 4 раза превышает
собственный объем молекулы.
Модель точечных невзаимодействующих масс тем и удобна, что позволяет построить математическую теорию и дать физическое обоснование о самых важных явлениях молекулярного движения в газе, выяснить сложные различия между идеальным газом молекул и таким же газом электронов, фотонов и фононов, о которых речь впереди. Последовательно отказываясь от различных упрощений идеальной модели, мы будем приходить к новым эффектам и явлениям. В частности, с конечными размерами молекул связаны явления переноса, с их способностью разрушаться – химические реакции, ионизироваться – электропроводности и т.д.
Газ из огромного числа молекул представляет собой механическую систему с весьма большим числом степеней свободы. Зная идеальные условия, можно было бы в принципе проинтегрировать уравнения движения всех молекул и найти их траектории. Подобное решение не представляло бы никакого интереса: свойства газа совершенно не зависят от начальных положений и скоростей молекул, т.е. не зависят от его предыстории. Газ является системой, качественно отличной от отдельной молекулы, и его поведение подчиняется иным статистическим закономерностям. Движение отдельной частицы, ее траектория и последовательность изменения состояний становится несущественной, второстепенной деталью явления.
Для выявления статистических закономерностей в соответствии с прямыми данными опыта будем использовать предположение о молекулярном хаосе, а именно: о равномерном распределении молекул в пространстве и о равномерном распределении их скоростей по всем направлениям. Столкновительные процессы не только устанавливают молекулярный хаос, но и изменяют абсолютное значение скорости молекул. Часть молекул получает избыточную кинетическую энергию за счет других молекул, соответственно потерявших часть энергии. Благодаря этому в газе возникает некоторое распределения молекул по скоростям. Если газ представлен самому себе, то числа молекул, приобретающих и теряющих скорость при столкновениях, уравниваются – устанавливается стационарное распределение по скоростям. Задача статистической физики – нахождение распределения молекул идеального газа по скоростям (энергиям), а, следовательно, определение среднего числа молекул, имеющих данные значение скорости.
