
- •1. Основные положения статистической термодинамики
- •1.1. Понятия и начала феноменологической термодинамики.
- •1.2. Микроскопическое (механическое) описание классических систем.
- •1.3. Особенности представления квантовых систем
- •1.4. Вероятность нахождения системы в элементе фазового пространства. Метод ансамблей Гиббса.
- •1.5. Макроскопические величины как фазовые средние
- •1.6. Распределение в системах с постоянным числом частиц
- •1.6.2. Распределения Гиббса.
- •1.6.3. Квазиклассическое приближение.
- •1.7. Свойства распределения Гиббса
- •1.8. Большое каноническое распределение Гиббса
- •2. Статистика идеального газа
- •2.1. Идеальный газ как модель статистической системы
- •2.2. Распределение Максвелла
- •2.3. Столкновения молекул со стенкой сосуда. Давление
- •2.4. Характерные величины идеального газа
- •2.5. Столкновение молекул между собой
- •2.6. Длина свободного пробега
- •2.7. Идеальный газ во внешнем поле
- •2.8. Число и функция состояний идеального газа
- •2.9. Классическая теория теплоемкости газа двухатомных молекул
- •2.10. Квантовая теория теплоемкости газа двухатомных молекул
- •2.11. Распределения в квантовых системах
- •3. Законы термодинамики
- •3.1. Статистическое обоснование первого начала термодинамики
- •3.2. Второе начало термодинамики
- •3.3. Вечный двигатель второго рода. Максимальная работа процессов
- •3.4. Полезная работа тепловых машин
- •3.5. Метод термодинамических потенциалов
- •3.6. Термодинамические коэффициенты. Критерии устойчивости равновесия
- •3.7. Статистическое вычисление термодинамических величин
- •3.8. Третье начало термодинамики (теорема Нернста)
- •3.9. Применения термодинамики
- •4. Статистика сложных систем.
- •4.1. Модель кристаллического твердого тела. Уравнение движения атомов
- •4.2. Дисперсионное уравнение нормальных колебаний кристалла
- •4.3. Кристалл как система линейных гармонических осцилляторов
- •4.4. Статистическая сумма и энергия кристалла (в гармоническом приближении)
- •4.5. Теория теплоемкости Дебая
- •4.6. Электронный газ в металлах
- •4.7. Зависимость энергии электрона от волнового вектора. Эффективная масса
- •4.8. Теория парамагнетизма. Природа и характеристики магнетизма.
- •4.9. Равновесное излучение.
- •4.10. Системы с кулоновским взаимодействием частиц.
- •5. Теория малых флуктуаций
- •5.1. Определение и значение флуктуаций
- •5.2. Мера вероятности и масштаб флуктуаций
- •5.3. Флуктуации термодинамических величин в однородной среде
- •5.4. Предельная чувствительность измерительных приборов
- •5.5. Рассеяния света флуктуациями
- •6. Элементы теории физической кинетики
- •6.1. Определения и характеристики необратимых процессов
- •6.2. Теория стационарных процессов в газе свободных электронов
- •6.3. Газокинетическое уравнение Больцмана
- •6.4. Приближение времени релаксации
- •Раздел 2
- •Раздел 2
- •Раздел 3
- •Раздел 4
- •Раздел 5
- •Раздел 6
- •Список Литературы
2.9. Классическая теория теплоемкости газа двухатомных молекул
Большая часть
веществ в газообразном состоянии
существует в виде неодноатомных молекул,
например,
,
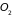 ,
,
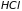 ,
,
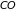 ,
,
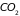 ,
,
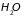 ,
,
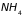 .
Наша задача обобщение полученных в
предыдущих разделах результатов на газ
многоатомных молекул и, в особенности,
на самую простую структуру – двухатомный
газ. Многоатомная молекула суть устойчивое
образование из двух,
трех и большего числа одинаковых или
разных атомов. Их особенность –
наличие у них вращательных и
колебательных степеней свободы.
Считаем, что молекула представляет
систему, подчиняющуюся законам
классической механики. Поскольку
внутреннее движение электронов в атоме
нас не будет интересовать, то каждый
атом отождествляем материальной точкой.
.
Наша задача обобщение полученных в
предыдущих разделах результатов на газ
многоатомных молекул и, в особенности,
на самую простую структуру – двухатомный
газ. Многоатомная молекула суть устойчивое
образование из двух,
трех и большего числа одинаковых или
разных атомов. Их особенность –
наличие у них вращательных и
колебательных степеней свободы.
Считаем, что молекула представляет
систему, подчиняющуюся законам
классической механики. Поскольку
внутреннее движение электронов в атоме
нас не будет интересовать, то каждый
атом отождествляем материальной точкой.
Моделью двухатомной молекулы может служить миниатюрная гантель, на концах которой находятся бесконечно малые шарики с массами и (различными массами атомов). Связь между атомами в молекуле не является абсолютно жесткой. По этой причине возможны следующие виды движения: поступательное (три степени свободы); вращение вокруг двух осей, перпендикулярных оси, соединяющей оба атома (две степени свободы); колебания атомов вдоль линии, их соединяющей. Общая энергия молекулы состоит из суммы энергий соответствующих движений
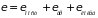 .
.
Состояние молекулы
определяется заданием шести пространственных
координат и шести импульсов. Координаты
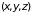 относятся к центру инерции, углы
и
относятся к центру инерции, углы
и
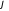 определяют положение оси молекулы в
пространстве, координата
описывает отклонение атомов от
равновесного расстояния
.
Импульсы, соответствующие этим
координатам, равны
определяют положение оси молекулы в
пространстве, координата
описывает отклонение атомов от
равновесного расстояния
.
Импульсы, соответствующие этим
координатам, равны
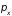 ,
,
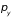 ,
,
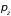 ,
,
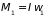 ,
,
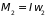 ,
,
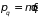 ,
,
где
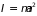 – момент инерции,
– момент инерции,
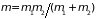 – приведенная масса,
– угловая скорость молекулы. Соответствующее
фазовое пространство имеет
– приведенная масса,
– угловая скорость молекулы. Соответствующее
фазовое пространство имеет
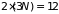 измерений. Считая молекулу квазизамкнутой
системой, воспользуемся распределением
Гиббса
измерений. Считая молекулу квазизамкнутой
системой, воспользуемся распределением
Гиббса
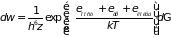 .
.
Элемент фазового пространства двухатомной молекулы может быть представлен в виде
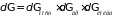 ,
,
где введены обозначения
 ;
;
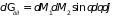 ;
;
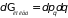 .
.
Очевидно, что
распределение Гиббса распадается на
три независимых множителя, соответствующих
поступательному, вращательному и
колебательному движениям. Каждый из
этих видов движения не влияет на другие
и может рассматриваться независимо.
Применяя теорему о распределении средней
энергии по степеням свободы, получим
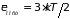 ,
,
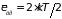 ,
,
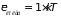 .
Этот результат можно получить через
соответствующее распределение Гиббса
.
Этот результат можно получить через
соответствующее распределение Гиббса
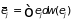 ,
,
учитывая,
что,
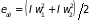 ,
,
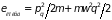 ,
где
,
где
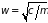 – частота колебаний атомов, связанная
с постоянной квазиупругой силы
.
Поступательное движение двухатомной
молекулы не отличается от движения
одноатомной, поскольку оно сводится к
движению центра тяжести системы. Таким
образом, суммарное значение средней
энергии двухатомной молекулы оказывается
равным
– частота колебаний атомов, связанная
с постоянной квазиупругой силы
.
Поступательное движение двухатомной
молекулы не отличается от движения
одноатомной, поскольку оно сводится к
движению центра тяжести системы. Таким
образом, суммарное значение средней
энергии двухатомной молекулы оказывается
равным
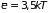 .
.
Алгоритм такого расчета может быть перенесен на случай многоатомных молекул. Рассмотрим, например, линейную трехатомную молекулу с девятью степенями свободы (рис. 2.7). Здесь имеют место следующие виды движения: поступательное (три степени свободы); вращение вокруг двух осей, перпендикулярных оси молекулы (две степени
|
свободы);
колебательное движение (четыре степени
свободы). Возможные типы колебаний
изображены на рис. 2.7, стрелками показаны
направления движения в одной фазе
колебаний,
|
Рис. 2.7. |
двух перпендикулярных плоскостях. Средняя энергия линейной трехатомной молекулы слагается из средней энергии указанных видов движения:
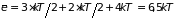 .
.
В газе из молекул его внутренняя энергия и теплоемкость при постоянном объеме имеют значения:
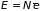 ,
,
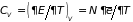 .
.
В частности,
теплоемкости двухатомного и трехатомного
газов, соответственно, равны
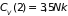 и
и
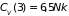 .
Таким образом, теплоемкость идеальных
газов оказывается не зависящей от
температуры и определяется исключительно
структурой молекулы.
.
Таким образом, теплоемкость идеальных
газов оказывается не зависящей от
температуры и определяется исключительно
структурой молекулы.
Приведенные
расчеты
 хорошо совпадают с экспериментальными
данными только для одноатомных молекул.
У газа многоатомных молекул наблюдается
резкое расхождение измеренных и
теоретических данных. Кроме того,
теплоемкость этих газов зависит от
температуры. Общий характер такой
зависимости для газа двухатомных молекул
иллюстрирует рис. 2.8.
хорошо совпадают с экспериментальными
данными только для одноатомных молекул.
У газа многоатомных молекул наблюдается
резкое расхождение измеренных и
теоретических данных. Кроме того,
теплоемкость этих газов зависит от
температуры. Общий характер такой
зависимости для газа двухатомных молекул
иллюстрирует рис. 2.8.
При очень высоких
температурах теплоемкость близка к
теоретическому значению
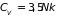 .
С понижением температуры теплоемкость
сначала падает до величины
.
С понижением температуры теплоемкость
сначала падает до величины
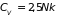 ,
т.е. до значения, которое имела бы молекула
с абсолютно жесткими связями между
атомами (отсутствует
,
т.е. до значения, которое имела бы молекула
с абсолютно жесткими связями между
атомами (отсутствует

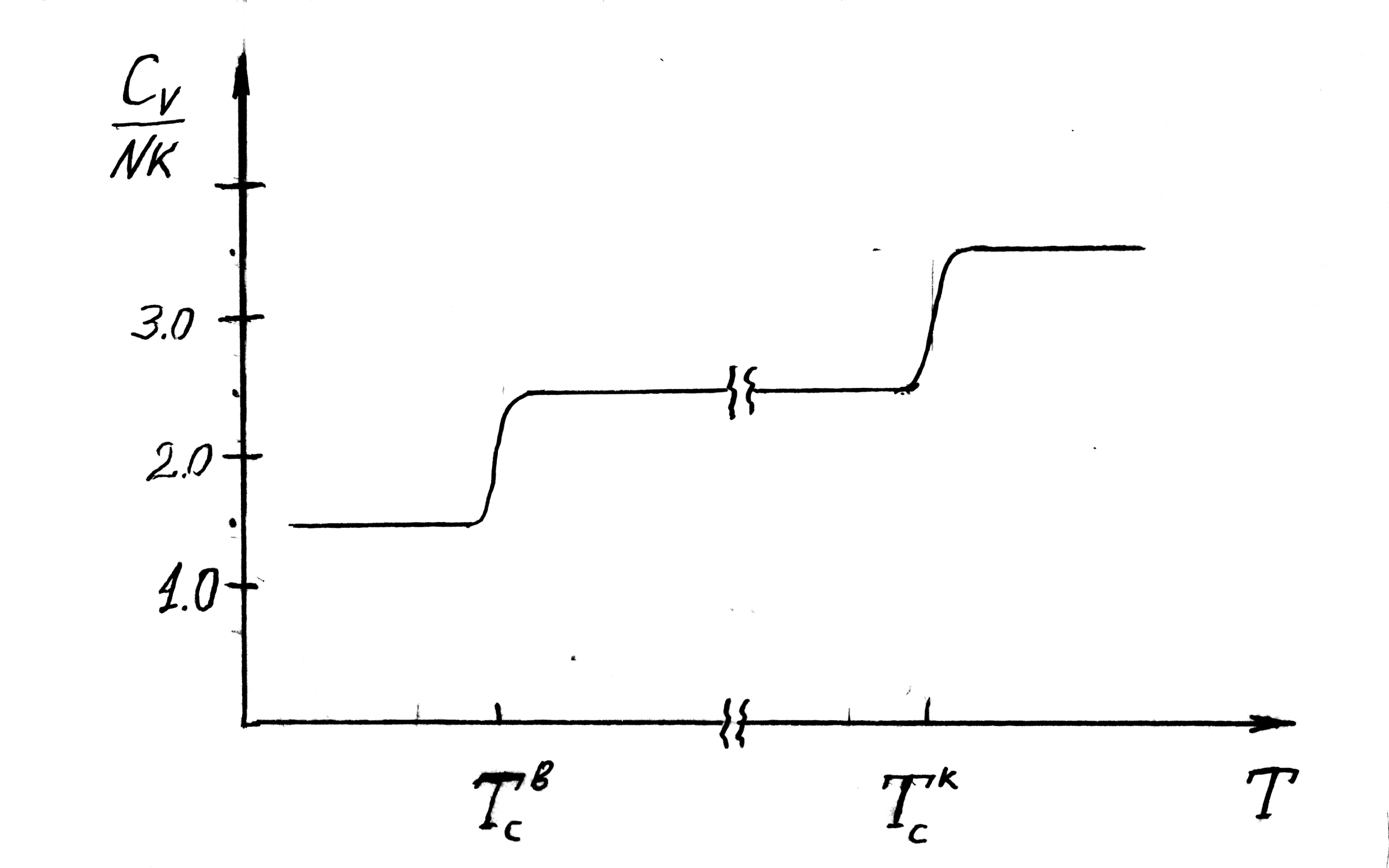
Рис. 2.8.
колебательное
движение). Дальнейшее понижение
температуры приводит к уменьшению
теплоемкости до
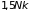 ,
характерного для одноатомного газа,
молекулы которого совершают лишь
поступательное движение. Таким образом,
в процессе уменьшения температуры
происходит ”вымораживание” степеней
свободы молекулы. Исчезновение
колебательного и вращательного движений
находится в резком противоречии с
положением классической механики о
равноправности степеней свободы.
,
характерного для одноатомного газа,
молекулы которого совершают лишь
поступательное движение. Таким образом,
в процессе уменьшения температуры
происходит ”вымораживание” степеней
свободы молекулы. Исчезновение
колебательного и вращательного движений
находится в резком противоречии с
положением классической механики о
равноправности степеней свободы.



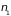 ,
,
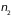 и
и
 – означают их частоты. Колебаний с
частотой
– два, происходят независимо друг от
друга в
– означают их частоты. Колебаний с
частотой
– два, происходят независимо друг от
друга в