
- •1. Основные положения статистической термодинамики
- •1.1. Понятия и начала феноменологической термодинамики.
- •1.2. Микроскопическое (механическое) описание классических систем.
- •1.3. Особенности представления квантовых систем
- •1.4. Вероятность нахождения системы в элементе фазового пространства. Метод ансамблей Гиббса.
- •1.5. Макроскопические величины как фазовые средние
- •1.6. Распределение в системах с постоянным числом частиц
- •1.6.2. Распределения Гиббса.
- •1.6.3. Квазиклассическое приближение.
- •1.7. Свойства распределения Гиббса
- •1.8. Большое каноническое распределение Гиббса
- •2. Статистика идеального газа
- •2.1. Идеальный газ как модель статистической системы
- •2.2. Распределение Максвелла
- •2.3. Столкновения молекул со стенкой сосуда. Давление
- •2.4. Характерные величины идеального газа
- •2.5. Столкновение молекул между собой
- •2.6. Длина свободного пробега
- •2.7. Идеальный газ во внешнем поле
- •2.8. Число и функция состояний идеального газа
- •2.9. Классическая теория теплоемкости газа двухатомных молекул
- •2.10. Квантовая теория теплоемкости газа двухатомных молекул
- •2.11. Распределения в квантовых системах
- •3. Законы термодинамики
- •3.1. Статистическое обоснование первого начала термодинамики
- •3.2. Второе начало термодинамики
- •3.3. Вечный двигатель второго рода. Максимальная работа процессов
- •3.4. Полезная работа тепловых машин
- •3.5. Метод термодинамических потенциалов
- •3.6. Термодинамические коэффициенты. Критерии устойчивости равновесия
- •3.7. Статистическое вычисление термодинамических величин
- •3.8. Третье начало термодинамики (теорема Нернста)
- •3.9. Применения термодинамики
- •4. Статистика сложных систем.
- •4.1. Модель кристаллического твердого тела. Уравнение движения атомов
- •4.2. Дисперсионное уравнение нормальных колебаний кристалла
- •4.3. Кристалл как система линейных гармонических осцилляторов
- •4.4. Статистическая сумма и энергия кристалла (в гармоническом приближении)
- •4.5. Теория теплоемкости Дебая
- •4.6. Электронный газ в металлах
- •4.7. Зависимость энергии электрона от волнового вектора. Эффективная масса
- •4.8. Теория парамагнетизма. Природа и характеристики магнетизма.
- •4.9. Равновесное излучение.
- •4.10. Системы с кулоновским взаимодействием частиц.
- •5. Теория малых флуктуаций
- •5.1. Определение и значение флуктуаций
- •5.2. Мера вероятности и масштаб флуктуаций
- •5.3. Флуктуации термодинамических величин в однородной среде
- •5.4. Предельная чувствительность измерительных приборов
- •5.5. Рассеяния света флуктуациями
- •6. Элементы теории физической кинетики
- •6.1. Определения и характеристики необратимых процессов
- •6.2. Теория стационарных процессов в газе свободных электронов
- •6.3. Газокинетическое уравнение Больцмана
- •6.4. Приближение времени релаксации
- •Раздел 2
- •Раздел 2
- •Раздел 3
- •Раздел 4
- •Раздел 5
- •Раздел 6
- •Список Литературы
3.7. Статистическое вычисление термодинамических величин
Функция состояний играет важную роль в статистической термодинамике: определяет как основные потенциалы, так и термодинамические параметры. В разделе 3.1 получено выражение для внутренней энергии как функцию :
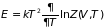 .
.
Подставляя в
определение свободной энергии
значение энтропии
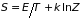 ,
находим
,
находим
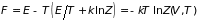 . (3.62)
. (3.62)
Отсюда следует статистические представления давления и энтропии (3.37.а)
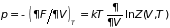 , (3.63)
, (3.63)
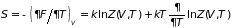 . (3.64)
. (3.64)
Найдем
статистическое выражение для потенциала
Гиббса. В отличие от свободной энергии
он является функцией давления –обобщенной
силы
,
а не объема – обобщенной координаты
(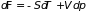 ).
Поэтому при статистическом вычислении
необходимо найти зависимость функции
состояний
).
Поэтому при статистическом вычислении
необходимо найти зависимость функции
состояний
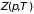 от обобщенной силы (давления ) как
независимой переменной.
от обобщенной силы (давления ) как
независимой переменной.
Рассмотрим в качестве примера идеальный газ в сосуде с подвижной стенкой (поршнем). Если в качестве независимой переменной брать объем, то роль системы выполняет газ в сосуде. Если же независимой переменной является действующая сила – внешнее давление, то подвижную стенку следует включить в состав системы. Теперь расширенную систему образуют молекул газа и поршень. Состояние её характеризуется энергией и координатами молекул газа, а также положением и импульсом подвижной стенки.
Изменение давления смещает энергетические уровни системы:
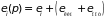 .
.
Выражение в скобках
определяет энергию поршня. Работа,
совершаемая над системой при изменении
давления на
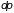 ,
равна
,
равна
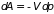 ,
а потенциальная энергия поршня –
,
а потенциальная энергия поршня –
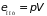 .
Её положительный знак учитывает, что
она относится к поршню. Пренебрегая его
кинетической энергией, поскольку она
создается лишь небольшим числом его
молекул по сравнению с числом молекул
в газе, получаем
.
Её положительный знак учитывает, что
она относится к поршню. Пренебрегая его
кинетической энергией, поскольку она
создается лишь небольшим числом его
молекул по сравнению с числом молекул
в газе, получаем
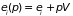 .
.
Для функции состояний расширенной системы имеем
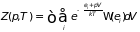 , (3.65)
, (3.65)
где
суммирование ведется по всем уровням
системы (значение
зависит от объема
),
а интегрирование – по всему объему
системы. Теперь в формуле (3.12) следует
заменить
на
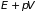 .
С учетом этих замечаний статистическое
представление основного термодинамического
потенциала имеет вид
.
С учетом этих замечаний статистическое
представление основного термодинамического
потенциала имеет вид
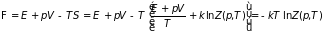 . (3.66)
. (3.66)
Из уравнения Гиббса-Гельмгольца (3.39) находим энтальпию
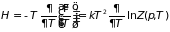 . (3.67)
. (3.67)
Последние формулы показывают, что логарифм функции состояний определяет энергию в широком смысле: и – в случае переменной , а и в случае переменной . Поскольку в предыдущих рассуждениях не фигурировала конкретная природа системы, а также характер обобщенной силы, полученные соотношения остаются справедливыми для любой системы и при любой обобщенной силе. Значение функции (интеграла) состояний определяется молекулярными свойствами равновесной системы – возможными энергетическими состояниями и условиями взаимодействия с окружающей средой. Её знание позволяет провести статистические расчеты термодинамических потенциалов, параметров, теплоемкостей, термических и упругих коэффициентов.
Например, для равновесного идеального газа, используя его функцию состояний (2.42) и следуя указанному ранее алгоритму, определим его внутреннюю и свободную энергии, теплоемкость , химический потенциал , уравнение состояния и энтропию :
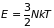 ;
;
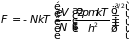 ;
;
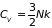 ;
;
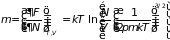 ;
;
 ;
;
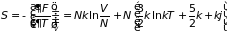 . (3.68)
. (3.68)
Рассмотрим вопрос
о изотермическом смешивании разных
газов с массами атомов
и
,
которые в исходном состоянии
характеризовались объемами
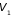 и
и
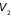 и числом частиц
и числом частиц
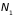 и
.
В процессе смешивания молекулы обоих
порций газа начинают диффундировать,
заполняя весь объем
и
.
В процессе смешивания молекулы обоих
порций газа начинают диффундировать,
заполняя весь объем
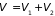 .
Вычислим изменение энтропии при таком
процессе. В начальный момент энтропии
обоих порций газа были равны (3.68)
.
Вычислим изменение энтропии при таком
процессе. В начальный момент энтропии
обоих порций газа были равны (3.68)
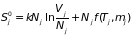 ,
,
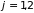
После смешивания каждый газ ведёт себя автономно, и энтропия изменяется в связи с увеличением объема:
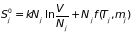 ,
,
Суммарное изменение энтропии при таком процесс определяется выражением
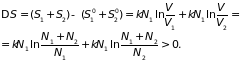
Таким образом,
энтропия после смешивания увеличивается,
процесс необратимый. Это понятно, так
как для обратного разделения газов
требуется затратить некоторую работу.
Другой характер имеет процесс смешивания
одинаковых газов, когда функция
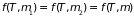 .
Проведя аналогичные предыдущим
рассуждения, легко доказать, что
.
Проведя аналогичные предыдущим
рассуждения, легко доказать, что
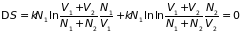 ,
,
и в этом случае процесс обратимый.
