
- •Литейные сплавы и плавка предисловие
- •Литейные свойства сплавов
- •1.1. Технологические свойства сплавов и важность их определения для практики
- •1.2. Номенклатура литейных свойств сплавов
- •1.3. Жидкотекучесть. Технологические пробы
- •Взаимосвязь толщин стенок отливок и площади их поверхности при литье в кокиль
- •Взаимосвязь толщины стенок отливки и площади их поверхности при литье под давлением
- •1.4. Склонность отливок к образованию усадочных раковин и пористости
- •V1, v2, v3 и v0 - объемы сплава при соответствующих температурных условиях
- •Температурные коэффициенты объемного сжатия (ткос) в жидком состоянии (индекс «ж») и объемная усадка затвердевания (индекс «з»)
- •1.5. Линейная усадка сплавов и отливок
- •1.6. Усадочные напряжения в отливках
- •1.7. Склонность сплавов и отливок к горячим трещинам
- •1.8. Склонность сплавов и отливок к холодным трещинам
- •3.9. Склонность сплавов к насыщению газами и образованию газовой пористости
- •Растворимость водорода в металлах
- •1.10. Неметаллические включения и плены в сплавах
- •1.11. Склонность компонентов сплавов к ликвации
- •1.12. Зависимость механических свойств сплавов от толщины стенок отливок
- •Механические свойства и рекомендуемый химический состав серого чугуна по гост 1412-85
- •Механические свойства серых чугунов, не предусмотренные гост 1412-85
- •Физические свойства чугунов
- •5.3. Высокопрочный чугун
- •Механические свойства*1 и рекомендуемый химический состав высокопрочного чугуна с шаровидным графитом по гост 7283—85
- •5.4. Чугун с вермикулярным графитом
- •Зависимость механических свойств и объема усадочных раковин в чвг от содержания шаровидного графита (шг)
- •5.5. Ковкий чугун
- •Содержание с и Si в отливках из ковкого чугуна в зависимости от толщины стенок
- •Механические свойства и рекомендуемый химический состав ковкого чугуна по гост 7293-79 (изм. В 1991 г.)
- •Марки, содержание углерода и механические свойства литейных углеродистых сталей по гост 977-88
- •Средний химический состав легированных сталей, мае. %
- •Механические свойства легированных сталей
- •Литейные сплавы цветных металлов
- •6.1. Алюминиевые сплавы
- •Химический состав и механические свойства алюминиевых литейных сплавов по гост 1583—93
- •* В данной таблице обозначения способов литья те же, что в табл. 6.1; то — термическая обработка; ств — временное сопротивление разрыву; стт — предел текучести; 5 — относительное удлинение.
- •Химический состав литейных титановых сплавов, мае. %
- •Линейная усадка 8/ и объем ву.Р усадочных раковин в отливках титановых сплавов
- •Механические свойства бронз
- •Механические свойства латуней
- •Средний химический состав и прочностные свойства никелевых литейных сплавов при температурах 800 и 900 °с
- •Основные понятия и определения
- •Классификация огнеупорных материалов
- •Типовые операции и процессы плавки литейных сплавов Горение топлива
- •Шлакообразование. Строение шлаковых расплавов
- •8.3. Окислительное рафинирование
- •8.4. Закономерности угара элементов в кислых и основных печах
- •Удаление вредных примесей из железоуглеродистых сплавов
- •8.7. Раскисление металла
- •Науглероживание расплавов железа
- •Взаимодействие футеровки с расплавами шлакаи металла
- •Исходные материалы для плавки литейных сплавов Первичные металлические материалы
- •Соотношение содержаний с и Si в литейных чугунах
- •9.2. Вторичные металлические материалы
- •Вторичные черные металлы
- •Физические характеристики* важнейших шихтовых материалов
- •Топливо
- •Важнейшие характеристики каменноугольного кокса
- •9.4. Флюсы
- •Состав известняка, мае. %
- •9.5. Расчет шихты
- •Список компонентов шихты и ограничений по их содержанию
- •Угар (пригар) химических элементов при плавке чугуна
- •Угар элементов при выплавке цветных сплавов, отн. %
- •Примечание. В числителе — угар при плотной шихте, в знаменателе — угар при некомпактной шихте.
- •Примечание. Минимальное значение функции равно 2720,49 руб./т.
- •10.1. Принцип действия и разновидности конструкций коксовых вагранок
- •Особенности горения кокса в вагранках
- •Изменение температуры и химического состава газовой фазы по высоте вагранки
- •Влияние высоты холостой колоши на процесс плавки в вагранке
- •Влияние размеров рабочих колош на процесс плавления шихты в вагранке
- •Влияние качества кокса на тепловые процессы в вагранке
- •Влияние подготовки шихты на ход ваграночной плавки
- •Влияние величины удельного расхода кокса и воздуха на ход ваграночной плавки
- •Способы интенсификации ваграночного процесса
- •Металлургические процессы плавки в коксовой вагранке
- •Расчет требуемого расхода известняка
- •Данные о характере газовой фазы в зонах вагранки
- •Значение коэфициента к науглероживания в холостой колоше
- •Зависимость концентрации серы в чугуне от содержания ее в коксе
- •Особенности плавки в вагранках с основной футеровкой
- •Особенности плавки в металлургических вагранках
- •Особенности плавки чугуна в коксогазовых вагранках
- •Плавка чугуна в бескоксовых вагранках
- •Стабилизация химического состава чугуна, выплавляемого в вагранках
- •Плавка чугуна в дуговых печах
- •11.2. Технология плавки
- •Особенности конструкции и технологии плавки чугуна в дуговых печах постоянного тока
- •Плавка чугуна в индукционных печах
- •Выбор частоты тока для питания индукционных тигельных печей
- •Электромагнитное перемешивание металла в тигле
- •12.4. Основные элементы конструкции печей промышленной частоты
- •Изготовление футеровки печи
- •Технология плавки чугуна в индукционных тигельных печах промышленной частоты
- •12.7. Особенности плавки чугуна в индукционных тигельных печах средней частоты
- •Индукционные канальные печи в чугунолитейном производстве
- •Преимущества и недостатки индукционных канальных печей.
- •12.9. Сравнительный анализ процессов плавки чугуна в современных чугуноплавильных печах
- •Технологические особенности плавки различных сортов чугуна
- •13.1. Технология получения высококачественного серого чугуна с пластинчатым графитом
- •13.2, Технология получения высокопрочного чугуна с шаровидным графитом
- •13.3. Производство чугуна с вермикулярным графитом
- •13.4. Производство ковкого чугуна
- •Рекомендации по введению легирующих элементов при плавке легированных чугунов
- •Плавка стали
- •14.1. Плавка стали в мартеновских печах
- •Плавка стали в мартеновской печи с основной футеровкой.
- •Плавка стали в основной дуговой печи с окислением примесей.
- •14.4. Плавка стали в индукционных тигельных печах Общая характеристика особенностей плавки стали в индукционных тигельных печах.
- •Плавка в печи с кислой футеровкой.
- •Особенности плавки в индукционных тигельных печах с основной футеровкой.
- •14.6. Электрошлаковый переплав стали
- •Плавка сплавов цветных металлов
- •15.1. Плавка сплавов на основе алюминия
- •Характеристики двойных алюминиевых лигатур
- •Состав модификаторов и параметры процесса модифицирования алюминиевых сплавов
- •15.2. Плавка сплавов на основе магния
- •Режимы модифицирования магниевых сплавов
- •15.3. Плавка сплавов на основе цинка
- •Составы лигатур для плавки медных сплавов
- •Список литературы к разделу 1
- •К разделу II
8.3. Окислительное рафинирование
Процессы образования и диссоциации оксидов играют ведущую роль в технологических процессах плавки. В большинстве случаев при плавке литейных сплавов окисление основного металла и легирующих элементов является нежелательным явлением, так как приводит к потерям металла — к его угару. Однако в ряде случаев именно окислением удается удалить из расплава вредные элементы или снизить содержание легирующих элементов до заданного значения.
На практике рассматриваемая,проблема заключается в том, что в шихтовых материалах легирующие элементы и вредные примеси могут содержаться в количествах, превышающих допустимые по техническим условиям.
Как правило, нежелательные элементы или их химические соединения с основным металлом хорошо растворяются в расплаве. Отделить их от основного металла физическими методами, например, процеживанием или центрифугированием, не удается. Поэтому для удаления из расплава нежелательных элементов стремятся получить такие их соединения, которые не растворяются в расплаве, но переходят в шлак или газовую фазу печи.
В большом числе случаев такие нерастворимые в расплаве вещества могут быть получены путем окисления нежелательных элементов. Так, например, избыток углерода в стали при его окислении превращается в газ СО, нерастворимый в металле и выделяющийся в атмосферу печи. При окислении кремния, марганца, хрома образуются тугоплавкие твердые оксиды, не растворяющиеся в расплаве основного металла и всплывающие в шлак.
Ввод кислорода в расплав металла может осуществляться прямым вдуванием технически чистого кислорода, диффузией его из газовой фазы через шлак в расплав и другими способами. Связанные с этим изменения механизма и кинетики процессов целесообразно рассмотреть при изучении конкретных технологических процессов плавки. Однако термодинамические основы процессов образования и диссоциации оксидов остаются общими для всех этих способов.
Для двухвалентных металлов реакции окисления можно представить в общем виде:
2Me + 02 = 2МеО - ∆Н, (8)
где ∆Н — изменение энтальпии реакции (в данном случае экзотермической).
Качественные выводы из анализа этой реакции не меняются и для металлов с иной валентностью.
Из физической химии известно, что о химическом сродстве элементов к кислороду можно судить по величине свободной энергии образования оксидов этих элементов — A G°T. На рис. 4 приве-
Рис. 8.4. Зависимость
AG°
реакций образования оксидов металлов
от температуры:
□ — точка
плавления металла; щ — точка плавления
оксида; О ~~ точка кипения
металла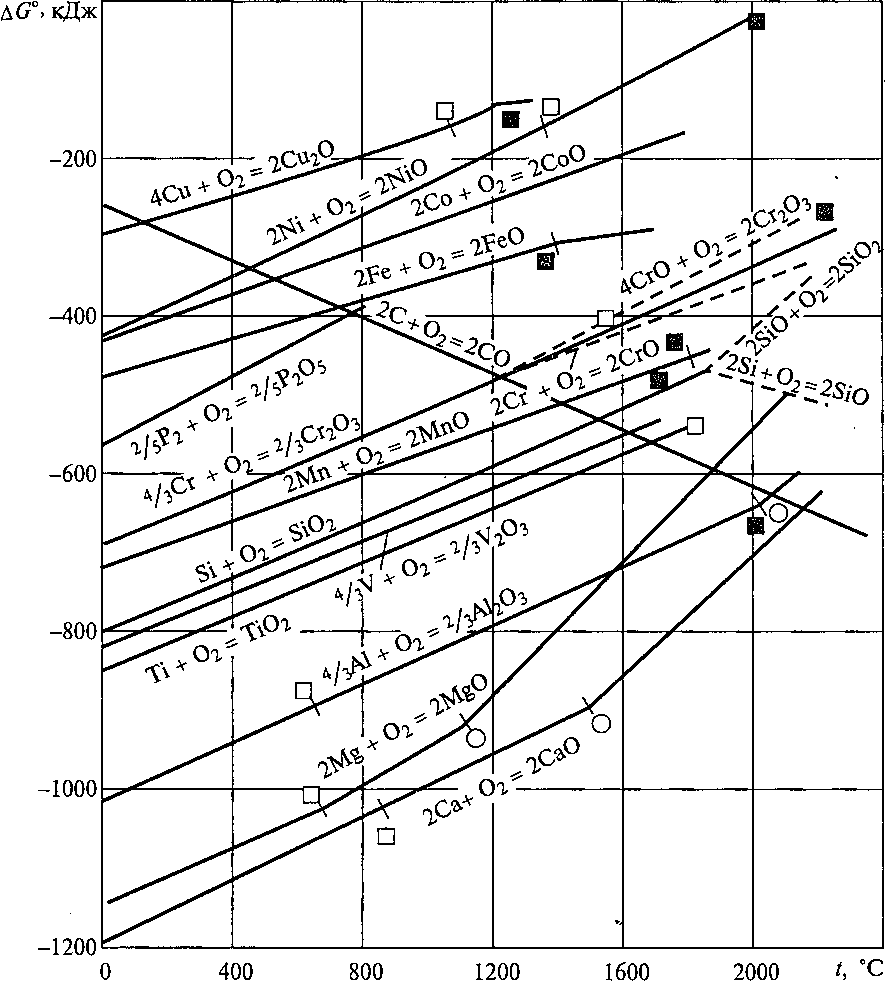
дена диаграмма зависимости ∆G°T от температуры для металлов, входящих в состав литейных сплавов.
Термодинамический анализ диаграммы ∆G°T — То помощью уравнения Гиббса (8.5) позволяет сделать ряд практически важных выводов.
1. Величина ∆G°T для всех металлов в области температур, характерных для плавки, имеет отрицательное значение, а это означает, что при этих температурах все металлы окисляются самопроизвольно.
Единственно возможной движущей силой этих реакций является энергетический фактор — стремление системы к минимуму энергии (т.е. значение ∆Н — отрицательное). Вторая из возможных движущих сил — энтропийная составляющая энергии Гиббса (T∆S°) — противодействует прямой реакции, так как в результате реакции энтропия уменьшается. Об уменьшении энтропии реакций окисления металлов можно судить и не прибегая к таблицам стандартных термодинамических величин. Достаточно обратить внимание на то, что в результате этих реакций исчезает 1 моль газообразного кислорода, но появляется твердый оксид, энтропия которого существенно ниже, чем у газа.
При повышении температуры прочность оксидов металлов уменьшается (линии на диаграмме рис. 4 наклонены в сторону уменьшения абсолютной величины ∆G°T. Таким образом, с повышением температуры процесс восстановления оксидов металлов облегчается. Однако при температурах, характерных для плавки литейных сплавов, самопроизвольная диссоциация оксидов металлов не происходит — величины ∆G°T остаются в области отрицательных значений.
4. Углы наклона линий диаграммы для разных металлов при температурах ниже температуры кипения различаются незначительно. Это объясняется следующим. Как известно из физической химии, изменение АЩ вычисляется по формуле
∆Н°т = ∆H°298 + ∫∆cpdT.
При больших значениях Апоправка на температуру не оказывает практического влияния на величину ∆Н°т, поэтому можно считать, что производная уравнения (8.5)
d∆G°/dT ≈ -AS°.
Следовательно, тангенс угла наклона линий ∆G° - Т практически равен величине -AS?, которая, будучи связанной главным образом с изменением количества газов в результате реакции, остается практически неизменной, так как число молей газов уменьшается во всех реакциях на единицу.
При температурах кипения металлов на линиях ∆G°T— Тнаблюдается перелом, снижение прочности оксида происходит значительно быстрее, чем на предыдущем участке. Причина этого состоит в том, что при данных температурах количество газов по реакциям типа (8.8) уменьшается уже не на 1 моль 02, но еще и на количество молей паров металла.
Таким же образом объясняется перелом линий для серы в точке ее сублимации.
Прочность оксида углерода (IV) (С02) почти не изменяется под влиянием температуры, так как число молей газов в реакции полного окисления углерода (8.1) не изменяется.
Прочность оксида углерода (И) (СО) в противоположность всем другим оксидам возрастает с повышением температуры, причем весьма существенно. Нетрудно видеть, что причиной такого аномального поведения этого оксида является специфика реакции (8.2) неполного сгорания углерода. В результате этой реакции количество газа не уменьшается, а, наоборот, увеличивается до 1 моль. Как уже отмечалось, движущими силами этой реакции являются как энергетический, так и энтропийный факторы.
Оксид может быть восстановлен лишь теми элементами, для которых линии зависимости ∆G°T— расположены ниже, чем для данного оксида при заданной температуре.
При высоких температурах восстановительная способность углерода повышается. Например, при температуре выше 1750 °С углерод может восстанавливать даже такой активный элемент, как алюминий.
Диаграмма зависимости свободной энергии образования оксидов от температуры позволяет судить о сравнительной прочности оксидов и вычислять константы равновесия реакций образования этих оксидов из чистых веществ. Однако расплавы всех литейных сплавов являются растворами, что существенно влияет на полноту протекания реакций. Поэтому для вычисления констант равновесия реакций в расплавах используют не концентрации веществ, а их активности в растворах:
ai =fiNh
где ai — активность элемента в растворе; fi— коэффициент активности; Ni — молярная доля элемента в растворе.
Для многокомпонентных растворов, например чугуна и стали, учитывают взаимное влияние элементов в растворе. В этом случае коэффициенты активности вычисляют, учитывая параметры взаимодействия, что существенно усложняет расчеты.
В реальных металлургических процессах полнота протекания химических реакций определяется не только термодинамическими факторами, но и кинетикой массопереноса во взаимодействующих фазах. Поэтому расчеты равновесия химических реакций весьма затруднительны в условиях литейных цехов. Однако термодинамические и кинетические закономерности протекания процессов позволяют определить направление изменения технологических режимов плавки, обеспечивающее требуемую полноту их протекания.
