
- •Литейные сплавы и плавка предисловие
- •Литейные свойства сплавов
- •1.1. Технологические свойства сплавов и важность их определения для практики
- •1.2. Номенклатура литейных свойств сплавов
- •1.3. Жидкотекучесть. Технологические пробы
- •Взаимосвязь толщин стенок отливок и площади их поверхности при литье в кокиль
- •Взаимосвязь толщины стенок отливки и площади их поверхности при литье под давлением
- •1.4. Склонность отливок к образованию усадочных раковин и пористости
- •V1, v2, v3 и v0 - объемы сплава при соответствующих температурных условиях
- •Температурные коэффициенты объемного сжатия (ткос) в жидком состоянии (индекс «ж») и объемная усадка затвердевания (индекс «з»)
- •1.5. Линейная усадка сплавов и отливок
- •1.6. Усадочные напряжения в отливках
- •1.7. Склонность сплавов и отливок к горячим трещинам
- •1.8. Склонность сплавов и отливок к холодным трещинам
- •3.9. Склонность сплавов к насыщению газами и образованию газовой пористости
- •Растворимость водорода в металлах
- •1.10. Неметаллические включения и плены в сплавах
- •1.11. Склонность компонентов сплавов к ликвации
- •1.12. Зависимость механических свойств сплавов от толщины стенок отливок
- •Механические свойства и рекомендуемый химический состав серого чугуна по гост 1412-85
- •Механические свойства серых чугунов, не предусмотренные гост 1412-85
- •Физические свойства чугунов
- •5.3. Высокопрочный чугун
- •Механические свойства*1 и рекомендуемый химический состав высокопрочного чугуна с шаровидным графитом по гост 7283—85
- •5.4. Чугун с вермикулярным графитом
- •Зависимость механических свойств и объема усадочных раковин в чвг от содержания шаровидного графита (шг)
- •5.5. Ковкий чугун
- •Содержание с и Si в отливках из ковкого чугуна в зависимости от толщины стенок
- •Механические свойства и рекомендуемый химический состав ковкого чугуна по гост 7293-79 (изм. В 1991 г.)
- •Марки, содержание углерода и механические свойства литейных углеродистых сталей по гост 977-88
- •Средний химический состав легированных сталей, мае. %
- •Механические свойства легированных сталей
- •Литейные сплавы цветных металлов
- •6.1. Алюминиевые сплавы
- •Химический состав и механические свойства алюминиевых литейных сплавов по гост 1583—93
- •* В данной таблице обозначения способов литья те же, что в табл. 6.1; то — термическая обработка; ств — временное сопротивление разрыву; стт — предел текучести; 5 — относительное удлинение.
- •Химический состав литейных титановых сплавов, мае. %
- •Линейная усадка 8/ и объем ву.Р усадочных раковин в отливках титановых сплавов
- •Механические свойства бронз
- •Механические свойства латуней
- •Средний химический состав и прочностные свойства никелевых литейных сплавов при температурах 800 и 900 °с
- •Основные понятия и определения
- •Классификация огнеупорных материалов
- •Типовые операции и процессы плавки литейных сплавов Горение топлива
- •Шлакообразование. Строение шлаковых расплавов
- •8.3. Окислительное рафинирование
- •8.4. Закономерности угара элементов в кислых и основных печах
- •Удаление вредных примесей из железоуглеродистых сплавов
- •8.7. Раскисление металла
- •Науглероживание расплавов железа
- •Взаимодействие футеровки с расплавами шлакаи металла
- •Исходные материалы для плавки литейных сплавов Первичные металлические материалы
- •Соотношение содержаний с и Si в литейных чугунах
- •9.2. Вторичные металлические материалы
- •Вторичные черные металлы
- •Физические характеристики* важнейших шихтовых материалов
- •Топливо
- •Важнейшие характеристики каменноугольного кокса
- •9.4. Флюсы
- •Состав известняка, мае. %
- •9.5. Расчет шихты
- •Список компонентов шихты и ограничений по их содержанию
- •Угар (пригар) химических элементов при плавке чугуна
- •Угар элементов при выплавке цветных сплавов, отн. %
- •Примечание. В числителе — угар при плотной шихте, в знаменателе — угар при некомпактной шихте.
- •Примечание. Минимальное значение функции равно 2720,49 руб./т.
- •10.1. Принцип действия и разновидности конструкций коксовых вагранок
- •Особенности горения кокса в вагранках
- •Изменение температуры и химического состава газовой фазы по высоте вагранки
- •Влияние высоты холостой колоши на процесс плавки в вагранке
- •Влияние размеров рабочих колош на процесс плавления шихты в вагранке
- •Влияние качества кокса на тепловые процессы в вагранке
- •Влияние подготовки шихты на ход ваграночной плавки
- •Влияние величины удельного расхода кокса и воздуха на ход ваграночной плавки
- •Способы интенсификации ваграночного процесса
- •Металлургические процессы плавки в коксовой вагранке
- •Расчет требуемого расхода известняка
- •Данные о характере газовой фазы в зонах вагранки
- •Значение коэфициента к науглероживания в холостой колоше
- •Зависимость концентрации серы в чугуне от содержания ее в коксе
- •Особенности плавки в вагранках с основной футеровкой
- •Особенности плавки в металлургических вагранках
- •Особенности плавки чугуна в коксогазовых вагранках
- •Плавка чугуна в бескоксовых вагранках
- •Стабилизация химического состава чугуна, выплавляемого в вагранках
- •Плавка чугуна в дуговых печах
- •11.2. Технология плавки
- •Особенности конструкции и технологии плавки чугуна в дуговых печах постоянного тока
- •Плавка чугуна в индукционных печах
- •Выбор частоты тока для питания индукционных тигельных печей
- •Электромагнитное перемешивание металла в тигле
- •12.4. Основные элементы конструкции печей промышленной частоты
- •Изготовление футеровки печи
- •Технология плавки чугуна в индукционных тигельных печах промышленной частоты
- •12.7. Особенности плавки чугуна в индукционных тигельных печах средней частоты
- •Индукционные канальные печи в чугунолитейном производстве
- •Преимущества и недостатки индукционных канальных печей.
- •12.9. Сравнительный анализ процессов плавки чугуна в современных чугуноплавильных печах
- •Технологические особенности плавки различных сортов чугуна
- •13.1. Технология получения высококачественного серого чугуна с пластинчатым графитом
- •13.2, Технология получения высокопрочного чугуна с шаровидным графитом
- •13.3. Производство чугуна с вермикулярным графитом
- •13.4. Производство ковкого чугуна
- •Рекомендации по введению легирующих элементов при плавке легированных чугунов
- •Плавка стали
- •14.1. Плавка стали в мартеновских печах
- •Плавка стали в мартеновской печи с основной футеровкой.
- •Плавка стали в основной дуговой печи с окислением примесей.
- •14.4. Плавка стали в индукционных тигельных печах Общая характеристика особенностей плавки стали в индукционных тигельных печах.
- •Плавка в печи с кислой футеровкой.
- •Особенности плавки в индукционных тигельных печах с основной футеровкой.
- •14.6. Электрошлаковый переплав стали
- •Плавка сплавов цветных металлов
- •15.1. Плавка сплавов на основе алюминия
- •Характеристики двойных алюминиевых лигатур
- •Состав модификаторов и параметры процесса модифицирования алюминиевых сплавов
- •15.2. Плавка сплавов на основе магния
- •Режимы модифицирования магниевых сплавов
- •15.3. Плавка сплавов на основе цинка
- •Составы лигатур для плавки медных сплавов
- •Список литературы к разделу 1
- •К разделу II
Науглероживание расплавов железа
Процесс растворения углерода в расплавах железа имеет большое практическое значение в связи с широким распространением так называемых «синтетических» чугунов. Производство отливок из синтетических чугунов, выплавляемых с использованием в шихте повышенного количества стального лома, оказалось экономически и экологически выгодным. Однако в процессе переплава дешевых стальных, отходов требуется существенно повысить содержание углерода в расплаве.
В общем виде процесс растворения углерода с поверхности на- углероживателя в расплаве железа можно представить в виде схемы, изображенной на рис. 11.
На схеме косой штриховкой обозначен науглероживатель, по поверхности которого со скоростью v движется расплав железа. В слое толщиной 8 характер движения расплава ламинарный (т. е. траектории движения струек металла параллельна одна другой). Выше ламинарного слоя характер движения потока расплава турбулентный, что обозначено завихренными стрелками.
В слое с ламинарным характером движения массоперенос углерода от одной струйки расплава к другой происходит так же, как в неподвижной жидкости, путем диффузии. Поэтому этот слой называют ламинарным диффузионным.
Рис. 11. Схема
процесса науглероживания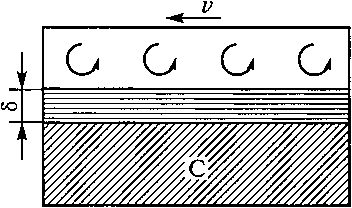
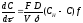 (8.17)
(8.17)
где С — концентрация углерода в расплаве; т — время науглероживания; F — площадь поверхности контакта расплава с наугле- роживателем; V— объем науглероживаемого металла; D — коэффициент диффузии углерода, зависящий от химического состава и температуры расплава; 8 — толщина ламинарного диффузионного слоя, зависящая от кинематической вязкости расплава и скорости его движения по поверхности науглероживателя; / — коэффициент качества науглероживателя (его значения равны: для графита электродного — 0,95; для кокса — 0,32; для антрацита — 0,29); Сн — концентрация насыщенного раствора углерода в расплаве.
Численное значение Сн зависит от температуры расплава и от его химического состава и определяется эмпирической формулой
Сн = 1,30 + 2,57 • I0~3t-0,31Si - 0,37Р - 0,22S - 0,1 lCu +
+ 0,03Mn + 0,075Cr + 0,15Ti +0,1V. (8.18)
Два первых слагаемых уравнения (8.18) характеризуют растворимость углерода в чистом железе при температуре °С, а последующие — влияние легирующих элементов. Из формулы следует, что при температуре 1550 °С в расплаве чистого железа может раствориться 5,28 % С. Введение в расплав 1 % Si приводит к уменьшению Сн до 5,28 - 0,31 = 4,97 %.
Результаты исследований кинетики растворения углерода в расплаве железа позволяют оптимизировать режимы науглероживания при плавке чугуна в разных печах.
Взаимодействие футеровки с расплавами шлакаи металла
Многообразные процессы взаимодействия расплавов металла и шлака с футеровкой можно подразделить на пять видов, описываемых соответствующими типовыми реакциями.
1. Переход оксидов из футеровки в шлак в результате оплавления футеровки4:
. (Me О)(Me О).
Оплавление футеровки в результате химического взаимодействия оксидов футеровки с оксидами шлака и образования легкоплавкой соли. Ярче всего это взаимодействие проявляется между кислой футеровкой и основным шлаком:
(Me О) + (Ме'О) -> (Me О • Ме'О).
Взаимодействие оксидов легирующих элементов с оксидами шлака и футеровки (эти взаимодействия рассмотрены в подразд. 8.4. «Закономерности угара элементов в кислых и основных печах»):
[Me О] + (Ме'О) -> (Me О • Ме'О),
[Me О] + (Ме'О) -> (Me О • Ме'О).
Восстановление оксида футеровки основным металлом расплава. Примером этого взаимодействия является реакция восстановления кремнезема кислой футеровки при плавке алюминиевых сплавов:
3<Si02> + 4[А1] = 2(А1203) + 3[Si]
или в общем виде восстановление оксида футеровки легирующим элементом расплава
(Me О) +[Меи] = (Меп О) + [Ме].
Примером такого взаимодействия является так называемая тигельная реакция.
В процессе плавки железоуглеродистых сплавов в печах с кислой футеровкой нередко наблюдается увеличение содержания кремния в расплаве — пригар кремния.
Этот пригар является результатом взаимодействия углерода, содержащегося в чугунах и сталях, с кремнеземом кислой футеровки и кислого шлака. Взаимодействие описывается тигельной реакцией:
<Si02> + 2[С] = [Si] + 2{СО}Т - Q,

Движущей силой этой эндотермической реакции (-Q) является только энтропийный фактор (об увеличении энтропии в результате реакции свидетельствует увеличение количества газов на 2 моль).
Из этого следует, что реакция может протекать только при высоких температурах, способствующих возрастанию восстанавливающей способности углерода.
Другим важнейшим условием ее протекания является раскис- ленностъ металла. В нераскисленном металле углерод будет восстанавливать железо из FeO.
Анализ уравнения тигельной реакции с позиций закона действующих масс показывает, что полноте ее протекания способствуют: 1) высокая концентрация углерода в расплаве; 2) низкая концентрация кремния в нем; 3) низкое парциальное давление СО над зеркалом металла.
Протекание
тигельной реакции приводит к разрушению
футеровки, поэтому в большинстве
случаев в ходе плавки следует по
возможности учитывать приведенные
выше соображения для уменьшения разгара
футеровки.
