
- •Литейные сплавы и плавка предисловие
- •Литейные свойства сплавов
- •1.1. Технологические свойства сплавов и важность их определения для практики
- •1.2. Номенклатура литейных свойств сплавов
- •1.3. Жидкотекучесть. Технологические пробы
- •Взаимосвязь толщин стенок отливок и площади их поверхности при литье в кокиль
- •Взаимосвязь толщины стенок отливки и площади их поверхности при литье под давлением
- •1.4. Склонность отливок к образованию усадочных раковин и пористости
- •V1, v2, v3 и v0 - объемы сплава при соответствующих температурных условиях
- •Температурные коэффициенты объемного сжатия (ткос) в жидком состоянии (индекс «ж») и объемная усадка затвердевания (индекс «з»)
- •1.5. Линейная усадка сплавов и отливок
- •1.6. Усадочные напряжения в отливках
- •1.7. Склонность сплавов и отливок к горячим трещинам
- •1.8. Склонность сплавов и отливок к холодным трещинам
- •3.9. Склонность сплавов к насыщению газами и образованию газовой пористости
- •Растворимость водорода в металлах
- •1.10. Неметаллические включения и плены в сплавах
- •1.11. Склонность компонентов сплавов к ликвации
- •1.12. Зависимость механических свойств сплавов от толщины стенок отливок
- •Механические свойства и рекомендуемый химический состав серого чугуна по гост 1412-85
- •Механические свойства серых чугунов, не предусмотренные гост 1412-85
- •Физические свойства чугунов
- •5.3. Высокопрочный чугун
- •Механические свойства*1 и рекомендуемый химический состав высокопрочного чугуна с шаровидным графитом по гост 7283—85
- •5.4. Чугун с вермикулярным графитом
- •Зависимость механических свойств и объема усадочных раковин в чвг от содержания шаровидного графита (шг)
- •5.5. Ковкий чугун
- •Содержание с и Si в отливках из ковкого чугуна в зависимости от толщины стенок
- •Механические свойства и рекомендуемый химический состав ковкого чугуна по гост 7293-79 (изм. В 1991 г.)
- •Марки, содержание углерода и механические свойства литейных углеродистых сталей по гост 977-88
- •Средний химический состав легированных сталей, мае. %
- •Механические свойства легированных сталей
- •Литейные сплавы цветных металлов
- •6.1. Алюминиевые сплавы
- •Химический состав и механические свойства алюминиевых литейных сплавов по гост 1583—93
- •* В данной таблице обозначения способов литья те же, что в табл. 6.1; то — термическая обработка; ств — временное сопротивление разрыву; стт — предел текучести; 5 — относительное удлинение.
- •Химический состав литейных титановых сплавов, мае. %
- •Линейная усадка 8/ и объем ву.Р усадочных раковин в отливках титановых сплавов
- •Механические свойства бронз
- •Механические свойства латуней
- •Средний химический состав и прочностные свойства никелевых литейных сплавов при температурах 800 и 900 °с
- •Основные понятия и определения
- •Классификация огнеупорных материалов
- •Типовые операции и процессы плавки литейных сплавов Горение топлива
- •Шлакообразование. Строение шлаковых расплавов
- •8.3. Окислительное рафинирование
- •8.4. Закономерности угара элементов в кислых и основных печах
- •Удаление вредных примесей из железоуглеродистых сплавов
- •8.7. Раскисление металла
- •Науглероживание расплавов железа
- •Взаимодействие футеровки с расплавами шлакаи металла
- •Исходные материалы для плавки литейных сплавов Первичные металлические материалы
- •Соотношение содержаний с и Si в литейных чугунах
- •9.2. Вторичные металлические материалы
- •Вторичные черные металлы
- •Физические характеристики* важнейших шихтовых материалов
- •Топливо
- •Важнейшие характеристики каменноугольного кокса
- •9.4. Флюсы
- •Состав известняка, мае. %
- •9.5. Расчет шихты
- •Список компонентов шихты и ограничений по их содержанию
- •Угар (пригар) химических элементов при плавке чугуна
- •Угар элементов при выплавке цветных сплавов, отн. %
- •Примечание. В числителе — угар при плотной шихте, в знаменателе — угар при некомпактной шихте.
- •Примечание. Минимальное значение функции равно 2720,49 руб./т.
- •10.1. Принцип действия и разновидности конструкций коксовых вагранок
- •Особенности горения кокса в вагранках
- •Изменение температуры и химического состава газовой фазы по высоте вагранки
- •Влияние высоты холостой колоши на процесс плавки в вагранке
- •Влияние размеров рабочих колош на процесс плавления шихты в вагранке
- •Влияние качества кокса на тепловые процессы в вагранке
- •Влияние подготовки шихты на ход ваграночной плавки
- •Влияние величины удельного расхода кокса и воздуха на ход ваграночной плавки
- •Способы интенсификации ваграночного процесса
- •Металлургические процессы плавки в коксовой вагранке
- •Расчет требуемого расхода известняка
- •Данные о характере газовой фазы в зонах вагранки
- •Значение коэфициента к науглероживания в холостой колоше
- •Зависимость концентрации серы в чугуне от содержания ее в коксе
- •Особенности плавки в вагранках с основной футеровкой
- •Особенности плавки в металлургических вагранках
- •Особенности плавки чугуна в коксогазовых вагранках
- •Плавка чугуна в бескоксовых вагранках
- •Стабилизация химического состава чугуна, выплавляемого в вагранках
- •Плавка чугуна в дуговых печах
- •11.2. Технология плавки
- •Особенности конструкции и технологии плавки чугуна в дуговых печах постоянного тока
- •Плавка чугуна в индукционных печах
- •Выбор частоты тока для питания индукционных тигельных печей
- •Электромагнитное перемешивание металла в тигле
- •12.4. Основные элементы конструкции печей промышленной частоты
- •Изготовление футеровки печи
- •Технология плавки чугуна в индукционных тигельных печах промышленной частоты
- •12.7. Особенности плавки чугуна в индукционных тигельных печах средней частоты
- •Индукционные канальные печи в чугунолитейном производстве
- •Преимущества и недостатки индукционных канальных печей.
- •12.9. Сравнительный анализ процессов плавки чугуна в современных чугуноплавильных печах
- •Технологические особенности плавки различных сортов чугуна
- •13.1. Технология получения высококачественного серого чугуна с пластинчатым графитом
- •13.2, Технология получения высокопрочного чугуна с шаровидным графитом
- •13.3. Производство чугуна с вермикулярным графитом
- •13.4. Производство ковкого чугуна
- •Рекомендации по введению легирующих элементов при плавке легированных чугунов
- •Плавка стали
- •14.1. Плавка стали в мартеновских печах
- •Плавка стали в мартеновской печи с основной футеровкой.
- •Плавка стали в основной дуговой печи с окислением примесей.
- •14.4. Плавка стали в индукционных тигельных печах Общая характеристика особенностей плавки стали в индукционных тигельных печах.
- •Плавка в печи с кислой футеровкой.
- •Особенности плавки в индукционных тигельных печах с основной футеровкой.
- •14.6. Электрошлаковый переплав стали
- •Плавка сплавов цветных металлов
- •15.1. Плавка сплавов на основе алюминия
- •Характеристики двойных алюминиевых лигатур
- •Состав модификаторов и параметры процесса модифицирования алюминиевых сплавов
- •15.2. Плавка сплавов на основе магния
- •Режимы модифицирования магниевых сплавов
- •15.3. Плавка сплавов на основе цинка
- •Составы лигатур для плавки медных сплавов
- •Список литературы к разделу 1
- •К разделу II
Удаление вредных примесей из железоуглеродистых сплавов
Десульфурация (обессеривание) железоуглеродистых расплавов.
Сера, являющаяся, как известно, вредной примесью для литейных сплавов на основе железа, имеет неограниченную растворимость в жидком железе. Удаление серы из расплава железа затруднено тем, что ее сродство к кислороду меньше, чем у основного металла — железа. Кроме того, концентрация серы в металле значительно меньше, чем основного металла. Поэтому при вводе кислорода в расплав окисляется не сера, а железо. Таким образом, термодинамические предпосылки для удаления серы из расплавов железа путем окислительного рафинирования отсутствуют.
Для десулъфурации железоуглеродистых сплавов необходимо получить соединения серы, прочные и нерастворимые в железе, переходящие в шлак. Этого можно добиться двумя путями: 1) диффузионным способом и 2) осаждением.
В первом случае, при диффузионном способе процесс десульфурации протекает на границе металл—шлак. В качестве реагента, обеспечивающего получение прочного соединения серы, нерастворимого в металле, используется оксид кальция — СаО, дешевый и недефицитный материал (известь).
В плавильных печах процесс сводится к взаимодействию шлака, содержащего избыток СаО, с металлом по реакции3:
[FeS] + (СаО) = [FeO] + (CaS), (8.9)
коэффициент распределения серы между шлаком и металлом при этом составляет:
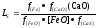
Константа равновесия реакции (8.9) выражается уравнением, в котором задействованы не концентрации, а активности компонентов шлака:
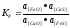
где a(cas), a(СаО) ~ активность соответственно CaS и СаО в шлаке; a[FeS], a[Feo] ~ активность FeS и FeO в металле.
Учитывая, что активности веществ пропорциональны их концентрациям, анализ уравнения (8.10) позволяет сформулировать два важнейших условия успешного развития процесса десульфурации в простейшем для понимания и практического использования виде:
высокая концентрация СаО в шлаке, или в металлургических терминах — высокая основность шлака;
низкая концентрация FeO в металле и шлаке.
Зависимость А (/реакции (8.9) от температуры выражается уравнением: AG = -11 900 + 5,8Г, из которого видно, что температура не оказывает практически значимого влияния на константу равновесия.
Однако полнота протекания процесса десульфурации зависит не только от термодинамических факторов. В значительной мере она определяется кинетикой взаимодействия веществ, поскольку эти процессы далеки от равновесных. Исследования, подтвержденные практикой, показали, что процесс десульфурации в боль- хиинстве случаев лимитируется диффузией в шлаке исходных веществ и продуктов реакции. Скорость диффузионных процессов в шлаке возрастает со снижением вязкости шлака, с повышением его температуры. Из этого следует третье важнейшее условие успешного протекания процесса десульфурации:
3) высокая температура шлака.
Чрезвычайно важно отметить также, что высокотемпературный режим плавки интенсифицирует процесс раскисления металла, способствуя выполнению второго условия из названных — снижению окисленности шлака и металла.
Это объясняется тем, что, как уже отмечалось (см. подразд. 8.3, вывод 9), восстановительная способность углерода с повышением температуры возрастает. Поэтому с повышением температуры концентрация FeO в металле и шлаке уменьшается по реакции:
[FeO] + [С] = [Fe] + {СО}Т -Q,
(FeO) + [С] = [Fe] + {СО}Т -Q.
В этой связи процесс десульфурации сплавов железо—углерод часто описывают реакцией:
[FeS] + (СаО) + (С) = (CaS) + [Fe] + {СО}Т -Q. (8.11)
Во втором случае при десульфурации осаждением реагент, образующий не растворимое в металле соединение серы, вводят в расплав металла. Таким реагентом обычно является марганец, имеющий большее сродство к сере, чем железо. Процесс описывается реакцией
[FeS] + [Mn] = (MnS) + [Fe]; AG° = -141 ООО + 19,8Г. (8.12)
Константа равновесия при этом составляет
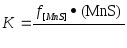
а коэффициент распределения серы между металлом и шлаком определяется формулой:
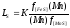
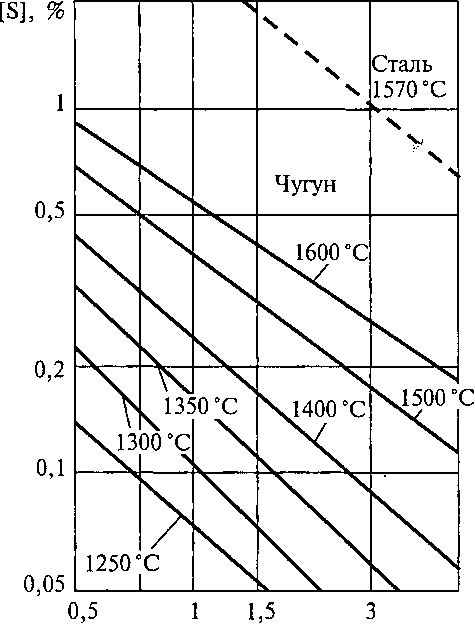
Рис. 6. Влияние концентрации марганца на растворимость серы в расплавах стали и чугуна
Образующийся тугоплавкий сульфид марганца (tпл = 1620 °С) выделяется в самостоятельную фазу и переходит в шлак. На рис. 8.6 показана зависимость содержания серы в чугуне и стали от содержания марганца при разных температурах. Из графиков видно, что эффективность десульфурации осаждением уменьшается с повышением температуры процесса. Такой же вывод можно сделать на основании выражения для ∆G°, приведенного в реакции (8.12).
Кроме того, активность FeS в растворе металла увеличивается при увеличении концентрации в нем углерода и кремния.
При плавке стали температура ванны всегда выше, а содержание углерода и кремния ниже, чем при плавке чугуна, поэтому эффективность десульфурации осаждением стали меньше, чем для чугуна.
2Р + 5FeO = Р205 + 5Fe + 202377 Дж, Р205 + 3FeO = (FeO)3- Р205 + 182 214 Дж, или суммарно и с указанием фаз
2[Р] + 8(FeO) = 5[Fe] + ((Fe0)3-P205) + 384591 Дж. (8.13)
Реакции (8.13) протекают с большим выделением теплоты и при повышении температуры смещаются влево, в сторону исходных веществ.
Исследования показали, что константа равновесия реакции (8.13) при температурах плавки чугуна и стали не сильно отличается от единицы и, следовательно, в этих условиях реакция обратима и не обеспечивает высокой степени дефосфорации. Кроме того, углерод, содержащийся в чугунах и сталях, по мере повышения температуры увеличивает свою восстановительную способность, и при температурах выше 1320 °С восстанавливает образующиеся соединения фосфора. При этом фосфор возвращается в металл.
Таким образом, для окислительного рафинирования металла от фосфора недостаточно получить нерастворимое в металле соединение, необходимо еще, чтобы это соединение было стойким к воздействию температуры и раскислите л ей.
Такое соединение получают при наличии избытка СаО в шлаке, т.е. при наличии основного шлака. Суммарно процесс дефосфорации при основном шлаке описывается уравнением:
2 [Р] + 5 [FeO] + 4 (СаО) = (4СаО. Р205) + 5 Fe. (8.14)
Константа равновесия этой реакции имеет вид
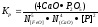
где N(CaO, N[FeO] ~ молярная доля свободных оксидов кальция и железа.
На основании приведенных рассуждений можно сделать вывод о том, что для увеличения степени дефосфорации чугунов и сталей необходимо соблюдение трех условий, а именно:
высокая окисленность металла и шлака (для реализации первой стадии десульфурации — окисления фосфора);
низкотемпературный режим плавки (для увеличения константы равновесия экзотермических реакций окисления фосфора);
наличие основного шлака (для фиксации степени дефосфорации, достигнутой на первой стадии процесса).
Сопоставляя условия, необходимые для удаления серы и фосфора, важно отметить, что два из трех условий диаметрально противоположны по характеру воздействия (окисленность металла и шлака и температурный режим). Третье условие — основность шлака — также различается не только формулировкой соответствующих пунктов. Для дефосфорации металла нельзя использовать шлаки с высокой основностью, так как при низкотемпературном режиме плавки такие шлаки имеют низкие текучесть (см. подразд. 8.2. рис. 8.2) и химическую активность.
Дегазация расплавов металлов
Плавка в открытых печах сопровождается растворением в металле водорода и азота. Главным источником этих газов является газовая фаза печи. Азот поступает в газовую фазу с атмосферным воздухом. Водород образуется в результате диссоциации паров воды, находящейся во влажном воздухе, на поверхности шихты, а также паров воды, образующихся при сгорании топлива:
2Н20 = 4Н + 02. (8.15)
Как отмечалось в подразд. 3.9, растворимость водорода и азота в жидких металлах при температурах металлургических процессов подчиняется закону квадратного корня (закону Сивертса — см. уравнение (3.26)).
С повышением температуры растворимость газов в металлах возрастает. Процесс растворения газов начинается уже в первый период расплавления шихты в результате контакта атмосферы печи с каплями и струйками металла. В этот период растворение происходит быстро вследствие большой поверхности контакта металла с газами и отсутствия сплошного шлакового покрова.
После образования сплошного слоя шлака растворение газов замедляется в большей или меньшей степени в зависимости от физико-химических свойств шлака. При плавке в открытой печи содержание азота в расплаве железа может достигать 0,04 мае. %, а водорода — 0,0025 мае. %.
Газы, растворившиеся в металле в процессе плавки, при кристаллизации отливки образуют в ней усадочные или газоусадочные раковины или поры. Поэтому дегазация расплава перед заливкой является одной из важнейших задач плавки.
В настоящее время существуют многочисленные способы дегазации расплавов металлов. Наибольшее распространение при плавке литейных сплавов получили:
вакуумирование;
продувка нейтральными газами;
обработка солями, образующими газообразные продукты;
обработка ультразвуком.
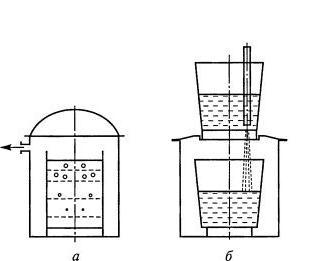
Дегазация вакуумированием. Процесс растворения газов при плавке металла стремится к равновесию, описываемому законом Сивертса. Если над поверхностью выплавленного металла создать разрежение, уменьшить парциальное давление растворенного газа, то такое изменение приведет к активизации перехода газа из расплава в газовую фазу (рис. 8.7, а).
Однако зарождение пузырька газа в толще металла связано с необходимостью преодолеть давление pMQ слоя металла, расположенного над зарождающимся пузырьком, давление ргтм атмосферы печи, давление р^ слоя шлака, а также силы рпов>нат поверхностного натяжения металла. Таким образом, должно выполняться условие
Рис7.
Схемы вакуумной дегазации:
а
— в ковше; б — струйная дегазация
Ръът. газа — Put Раты Ршл Рпов. нат» (8.16)
Как отмечалось в подразд. 3.9, зарождение пузырька так называемого «критического радиуса» в объеме чистого металла теоретически невозможно. Но реально на практике в толще жидкого металла всегда существуют поверхности раздела металла с твердыми фазами, такие как металл—футеровка, металл—неметаллические включения. Эти поверхности не смачиваются металлом, что облегчает процесс зарождения на них пузырьков газа. Этим объясняется тот факт, что образование зародышей пузырьков газов происходит именно на поверхности твердых фаз.
Тем не менее, из неравенства (8.16) очевидно, что с увеличением глубины ванны печи или ковша и увеличением толщины шлакового покрова эффективность процесса вакуумной дегазации снижается. Поэтому для больших объемов металла применяют вакуумную дегазацию струи металла при его переливе из одного ковша в другой в вакуумной камере (рис. 8.7, б).
Рафинирование вакуумированием применяется для стали и цветных металлов.
Дегазация стали в процессе кипения. В окислительном периоде плавки стали после окисления кремния, марганца и фосфора и разогрева ванны начинается окисление углерода:
[FeO] + [С] = Fe + {СО}Т - Q.
В результате выделения из толщи жидкого металла пузырьков СО происходит бурление жидкой ванны (сталь «кипит»), поэтому данный период плавки получил название «период кипения», хотя явление это кажущееся, так как температура металла далека от температуры кипения.
Установлено, что в процессе кипения из металла наряду с растворенными в нем газами удаляются твердые неметаллические
 Рис.
8 схема дегазации стали в процессе
кипения
Рис.
8 схема дегазации стали в процессе
кипения
включения — Si02 и МnО. Мельчайшие частицы этих оксидов, образовавшиеся в начале окислительного периода во всей толще ванны, создают так называемую «неметаллическую муть». Они очень медленно всплывают в шлак и, в конечном счете, ухудшают качество стали.
В то же время, наличие твердых неметаллических включений способствует зарождению пузырьков СО, а сами пузырьки газа приводят к всплытию твердых частиц в шлак. Это явление, называемое «флотацией неметаллической мути», способствует улучшению качества стали.
Одновременно с флотацией происходит дегазация стали. Суть процесса дегазации стали при кипении аналогична вакуумной дегазации, несмотря на внешнее различие этих процессов. Действительно, поверхность каждого пузырька СО в расплаве является границей раздела газообразной и жидкой фаз. Для этих контактирующих фаз выполняется уравнение Сивертса, устанавливающее равновесное соотношение концентрации газа в расплаве металла и парциального давления газа над поверхностью раздела фаз. Поскольку внутри пузырьков СО парциальные давления водорода и азота равны нулю, газы диффундируют внутрь пузырьков и, всплывая, оказываются в атмосфере печи. Таким образом, пространство внутри пузырьков СО является вакуумом для азота и водорода. На рис. 8.8 процесс дегазации кипением показан схематично.
Успешному протеканию процесса кипения способствуют следующие условия:
® высокая температура металла, так как движущей силой реакции является только энтропийный фактор;
низкое содержание кремния, марганца и фосфора, имеющих большее по сравнению с углеродом сродство к кислороду при низких температурах;
высокая концентрация углерода в расплаве.
Дегазация расплавов продувкой газами. При плавке стали образование в ней пузырьков СО, способствующих дегазации, происходит естественным образом вследствие наличия в ней углерода и окисленности расплава. При плавке сплавов на основе алюминия, меди и других металлов самопроизвольного «кипения» не происходит. Поэтому для дегазации таких расплавов прибегают к искусственному «кипению», применяя продувку металла газами.
Суть процесса, как и при кипении, состоит в том, что внутри пузырьков продуваемого газа парциальное давление водорода и азота изначально равно нулю. Поэтому азот и водород диффундируют внутрь пузырьков продуваемого газа и всплывают на поверхность ванны.
Для продувки выбирают газы, которые имеют минимальную растворимость в выплавляемом металле. Таковыми являются газы с большим размером атомов, например аргон и хлор.
Дегазация продувкой газами сопровождается, так же, как и процесс кипения стали, рафинированием расплава от твердых неметаллических включений.
Дегазация ультразвуковой обработкой. При дегазации ультразвуковыми колебаниями торцы волноводов приводят в соприкосновение с поверхностью расплава, очищенного от шлака (рис. 8.9, а). Суть процесса в том, что под действием ультразвуковых колебаний в расплаве развиваются явления кавитации (образования полостей, пузырьков). В образующиеся при этом пустоты диффундируют растворенные в металле газы в соответствии с законом Сивертса. Метод используется при плавке алюминиевых сплавов.
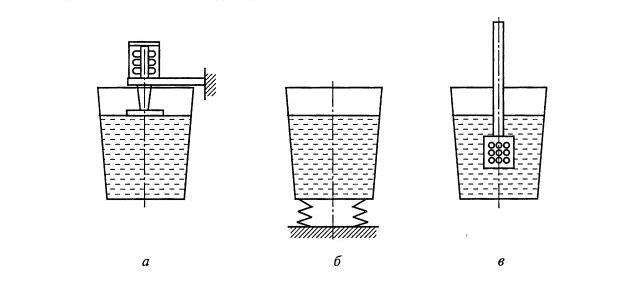
Рис. 8.9. Схемы дегазации расплавов: ультразвуком; б — вибрацией; в — под колокольчиком солями хлора
Спокойное, неподвижное состояние жидкости способствует фиксации растворенных в ней газов. Наоборот, перемешивание, вибрация и другое возмущение жидкости приводит к выделению растворенных в жидкости газов. На рис. 8.9, б показана схема установки, предназначенной для дегазации расплавов с использованием данного явления.
Дегазация алюминиевых расплавов. Для дегазации алюминиевых расплавов могут применяться многочисленные способы: ва- куумирование, продувка газами, обработка ультразвуком, вымораживание.
Дегазация вакуумированием и ультразвуковой обработкой. Для
алюминиевых сплавов подобные варианты обработки требуют повышенных затрат по сравнению с другими, более эффективными способами.
Продувка газами. Продувка хлором является эффективным способом дегазации, но практически не применяется в связи с высокой токсичностью хлора. Продувку аргоном или азотом ведут при 720...730 °С в течение 5...20 мин; расход газа 0,5... 1 м3/т расплава.
Дегазация хлористыми солями. В качестве дегазаторов алюминиевых сплавов используют хлориды различных элементов: хлористый цинк ZnCl2, хлористый марганец МпС12, хлористый барий ВаС13, гексахлорэтан С2С16 и др. Дегазирующие соли вводятся в глубину расплава с помощью колокольчика, показанного на рис. 8.9, в.
Действие хлоридов основано на том, что в результате их взаимодействия с алюминием в расплаве образуется летучий хлористый алюминий (температура кипения А1С13 равна 183 °С):
3ZnCl2 + 2А1 = 2А1С13Т + 3Zn, ЗМпС12 + 2А1 = 2А1С13Т + ЗМп, 4ВС13 + 4А1 = 4А1С13Т + 4В, С2С16 + 2А1 = 2А1С13Т + 2С.
Пузырьки хлористого алюминия, выходя на поверхность ванны, уносят с собой газы и твердые неметаллические включения, т. е. действуют аналогично пузырькам СО при кипении стали.
Сущность всех рассмотренных способов дегазации состоит в том, чтобы создать поверхность раздела металл—газовая фаза, над которой парциальное давление растворенного газа меньше равновесного, описываемого уравнением Сивертса.
Вымораживание. Способ основан на том, что растворимость водорода в расплаве алюминия в процессе кристаллизации снижается примерно в 10 раз. При охлаждении расплавленного металла в печи до температуры солидуса из него удаляются газы, растворившиеся в процессе расплавления, когда защита покровным шлаком была недостаточно эффективной. После этого металл перегревают до заданной температуры, но это происходит под сплошным слоем покровного флюса и не приводит к насыщению металла газами.
Метод практически не применяется в связи с низкой производительностью и большими энергозатратами.
