
- •Литейные сплавы и плавка предисловие
- •Литейные свойства сплавов
- •1.1. Технологические свойства сплавов и важность их определения для практики
- •1.2. Номенклатура литейных свойств сплавов
- •1.3. Жидкотекучесть. Технологические пробы
- •Взаимосвязь толщин стенок отливок и площади их поверхности при литье в кокиль
- •Взаимосвязь толщины стенок отливки и площади их поверхности при литье под давлением
- •1.4. Склонность отливок к образованию усадочных раковин и пористости
- •V1, v2, v3 и v0 - объемы сплава при соответствующих температурных условиях
- •Температурные коэффициенты объемного сжатия (ткос) в жидком состоянии (индекс «ж») и объемная усадка затвердевания (индекс «з»)
- •1.5. Линейная усадка сплавов и отливок
- •1.6. Усадочные напряжения в отливках
- •1.7. Склонность сплавов и отливок к горячим трещинам
- •1.8. Склонность сплавов и отливок к холодным трещинам
- •3.9. Склонность сплавов к насыщению газами и образованию газовой пористости
- •Растворимость водорода в металлах
- •1.10. Неметаллические включения и плены в сплавах
- •1.11. Склонность компонентов сплавов к ликвации
- •1.12. Зависимость механических свойств сплавов от толщины стенок отливок
- •Механические свойства и рекомендуемый химический состав серого чугуна по гост 1412-85
- •Механические свойства серых чугунов, не предусмотренные гост 1412-85
- •Физические свойства чугунов
- •5.3. Высокопрочный чугун
- •Механические свойства*1 и рекомендуемый химический состав высокопрочного чугуна с шаровидным графитом по гост 7283—85
- •5.4. Чугун с вермикулярным графитом
- •Зависимость механических свойств и объема усадочных раковин в чвг от содержания шаровидного графита (шг)
- •5.5. Ковкий чугун
- •Содержание с и Si в отливках из ковкого чугуна в зависимости от толщины стенок
- •Механические свойства и рекомендуемый химический состав ковкого чугуна по гост 7293-79 (изм. В 1991 г.)
- •Марки, содержание углерода и механические свойства литейных углеродистых сталей по гост 977-88
- •Средний химический состав легированных сталей, мае. %
- •Механические свойства легированных сталей
- •Литейные сплавы цветных металлов
- •6.1. Алюминиевые сплавы
- •Химический состав и механические свойства алюминиевых литейных сплавов по гост 1583—93
- •* В данной таблице обозначения способов литья те же, что в табл. 6.1; то — термическая обработка; ств — временное сопротивление разрыву; стт — предел текучести; 5 — относительное удлинение.
- •Химический состав литейных титановых сплавов, мае. %
- •Линейная усадка 8/ и объем ву.Р усадочных раковин в отливках титановых сплавов
- •Механические свойства бронз
- •Механические свойства латуней
- •Средний химический состав и прочностные свойства никелевых литейных сплавов при температурах 800 и 900 °с
- •Основные понятия и определения
- •Классификация огнеупорных материалов
- •Типовые операции и процессы плавки литейных сплавов Горение топлива
- •Шлакообразование. Строение шлаковых расплавов
- •8.3. Окислительное рафинирование
- •8.4. Закономерности угара элементов в кислых и основных печах
- •Удаление вредных примесей из железоуглеродистых сплавов
- •8.7. Раскисление металла
- •Науглероживание расплавов железа
- •Взаимодействие футеровки с расплавами шлакаи металла
- •Исходные материалы для плавки литейных сплавов Первичные металлические материалы
- •Соотношение содержаний с и Si в литейных чугунах
- •9.2. Вторичные металлические материалы
- •Вторичные черные металлы
- •Физические характеристики* важнейших шихтовых материалов
- •Топливо
- •Важнейшие характеристики каменноугольного кокса
- •9.4. Флюсы
- •Состав известняка, мае. %
- •9.5. Расчет шихты
- •Список компонентов шихты и ограничений по их содержанию
- •Угар (пригар) химических элементов при плавке чугуна
- •Угар элементов при выплавке цветных сплавов, отн. %
- •Примечание. В числителе — угар при плотной шихте, в знаменателе — угар при некомпактной шихте.
- •Примечание. Минимальное значение функции равно 2720,49 руб./т.
- •10.1. Принцип действия и разновидности конструкций коксовых вагранок
- •Особенности горения кокса в вагранках
- •Изменение температуры и химического состава газовой фазы по высоте вагранки
- •Влияние высоты холостой колоши на процесс плавки в вагранке
- •Влияние размеров рабочих колош на процесс плавления шихты в вагранке
- •Влияние качества кокса на тепловые процессы в вагранке
- •Влияние подготовки шихты на ход ваграночной плавки
- •Влияние величины удельного расхода кокса и воздуха на ход ваграночной плавки
- •Способы интенсификации ваграночного процесса
- •Металлургические процессы плавки в коксовой вагранке
- •Расчет требуемого расхода известняка
- •Данные о характере газовой фазы в зонах вагранки
- •Значение коэфициента к науглероживания в холостой колоше
- •Зависимость концентрации серы в чугуне от содержания ее в коксе
- •Особенности плавки в вагранках с основной футеровкой
- •Особенности плавки в металлургических вагранках
- •Особенности плавки чугуна в коксогазовых вагранках
- •Плавка чугуна в бескоксовых вагранках
- •Стабилизация химического состава чугуна, выплавляемого в вагранках
- •Плавка чугуна в дуговых печах
- •11.2. Технология плавки
- •Особенности конструкции и технологии плавки чугуна в дуговых печах постоянного тока
- •Плавка чугуна в индукционных печах
- •Выбор частоты тока для питания индукционных тигельных печей
- •Электромагнитное перемешивание металла в тигле
- •12.4. Основные элементы конструкции печей промышленной частоты
- •Изготовление футеровки печи
- •Технология плавки чугуна в индукционных тигельных печах промышленной частоты
- •12.7. Особенности плавки чугуна в индукционных тигельных печах средней частоты
- •Индукционные канальные печи в чугунолитейном производстве
- •Преимущества и недостатки индукционных канальных печей.
- •12.9. Сравнительный анализ процессов плавки чугуна в современных чугуноплавильных печах
- •Технологические особенности плавки различных сортов чугуна
- •13.1. Технология получения высококачественного серого чугуна с пластинчатым графитом
- •13.2, Технология получения высокопрочного чугуна с шаровидным графитом
- •13.3. Производство чугуна с вермикулярным графитом
- •13.4. Производство ковкого чугуна
- •Рекомендации по введению легирующих элементов при плавке легированных чугунов
- •Плавка стали
- •14.1. Плавка стали в мартеновских печах
- •Плавка стали в мартеновской печи с основной футеровкой.
- •Плавка стали в основной дуговой печи с окислением примесей.
- •14.4. Плавка стали в индукционных тигельных печах Общая характеристика особенностей плавки стали в индукционных тигельных печах.
- •Плавка в печи с кислой футеровкой.
- •Особенности плавки в индукционных тигельных печах с основной футеровкой.
- •14.6. Электрошлаковый переплав стали
- •Плавка сплавов цветных металлов
- •15.1. Плавка сплавов на основе алюминия
- •Характеристики двойных алюминиевых лигатур
- •Состав модификаторов и параметры процесса модифицирования алюминиевых сплавов
- •15.2. Плавка сплавов на основе магния
- •Режимы модифицирования магниевых сплавов
- •15.3. Плавка сплавов на основе цинка
- •Составы лигатур для плавки медных сплавов
- •Список литературы к разделу 1
- •К разделу II
8.7. Раскисление металла
Как уже отмечалось, в подавляющем большинстве случаев плавка литейных сплавов сопровождается преднамеренным или нежелательным, но неизбежным, окислением основного металла и легирующих элементов. При плавке стали и медных сплавов оксиды основного металла растворяются в нем, ухудшая качество сплава. Поэтому в конце плавки стали и медных сплавов проводят раскисление металла, т. е. восстановление оксидов основного металла.
В качестве раскислителей применяют элементы, имеющие большее сродство к кислороду, чем основной металл. При этом важно, чтобы образующиеся оксиды раскислителя не растворялись в металле, но удалялись в шлак или газовую фазу.
Кроме двух указанных свойств раскислители должны быть экологически чистыми, недорогими и недефицитными.
Сплавы на основе алюминия и магния не раскисляют, так как эти металлы обладают исключительно высоким сродством к кислороду, сами образуют прочные нерастворимые оксиды, которые можно удалить из расплава в процессе дегазации.
При плавке чугуна специальной операции раскисления не проводят в связи с тем, что функцию раскисления выполняет легирующий элемент чугуна — кремний, содержание которого в металле всегда превышает требуемое количество раскислителя, вводимого в расплав. По той же причине не раскисляют сплавы на основе цинка, содержащие не менее 4 % А1.
Таким образом, закономерности процесса раскисления имеют существенное значение только для плавки стали и медных сплавов. При плавке литейных сталей чаще всего используется глубинное или осаждающее раскисление. В качестве раскислителей применяют марганец (в виде ферромарганца), кремний (в виде ферросилиция). Содержание элемента-раскислителя в ферросплаве составляет 45... 75 %. Раскисление протекает по следующим реакциям с положительным тепловым эффектом Q:
[FeO] + [Mn] = [Fe] + (MnO) + Q,
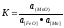
или
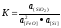
2[FeO] + [Si] = 2[Fe] + (Si02) + Q,

В результате
реакций образуются малорастворимые в
металле оксиды марганца или кремния,
плотность которых меньше плотности
стали, т.е. образующийся «осадок»
всплывает в шлак, отсюда название
метода — «осаждающий». Этот метод
называют также «глубинным», так как
раскислитель вводят в глубь ванны металла.
вводят в глубь ванны металла.
Важно отметить, что всплытие продуктов раскисления затруднено из-за малых размеров образующихся частиц МпО и Si02, а также по причине значительной вязкости расплава. Кроме того, в результате раскисления прекращается кипение стали и выделение пузырьков СО, которое способствовало флотации неметаллической мути при кипении. Поэтому при осаждающем раскислении невозможно получить сталь, чистую от неметаллических включений, что является существенным недостатком рассматриваемого метода. Однако этот метод получил наибольшее распространение как самый простой и дешевый.
Уменьшения количества оставшихся в стали неметаллических включений добиваются применением комплексных раскислите - лей. Они представляют собой сплавы нескольких раскислителей: силикомарганец (Si + Мп), силикокальций (Si + Са), сплав АМС (А1 + Мп + Si), сплав КМК (Si + Мп + Са) и др. При использовании комплексных раскислителей продукты реакций раскисления вступают во взаимодействие между собой, образуя более крупные и легко всплывающие включения. (Напомним, что Si02 является кислотным, или, что у практиков чаще используется, «кислым» оксидом, а МпО и СаО — это основные оксиды).
Кроме того, взаимодействие продуктов реакций раскисления между собой приводит к уменьшению их активности и смещению равновесия реакций в сторону более полного раскисления. Количество вводимого раскислителя должно быть необходимым и достаточным для полного восстановления оксида железа, растворенного в металле. Присадка избыточного количества раскислителя приводит к увеличению содержания в металле элемента-раскис- лителя по сравнению с заданным химическим составом стали. Поэтому в процессе раскисления отбирают пробы «на раскислен- ность металла», в частности «на ковкость» и «на рост».
Технологическая проба «на ковкость» основана на том, что оксид железа сообщает сталям красноломкость. Поэтому после введения первой порции раскислителя отливают небольшой цилиндрический образец, и после затвердевания его расковывают в лепешку. Образование трещин по краям лепешки свидетельствует о красноломкости стали и необходимости введения дополнительной порции раскислителя.
Проба «на рост» основана на том, что в процессе кристаллизации недостаточно раскисленной стали происходит реакция кипения:
FeO + С = Fe + COt - Q.
Рис. 10. Технологическая
проба раскисленности стали (проба «на
рост»):
а
— образец раскисленной стали; б —
образец недораскисленной
стали
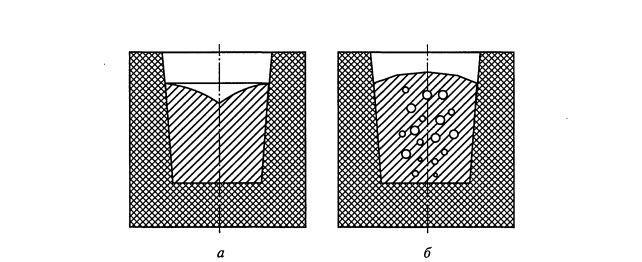
Эта эндотермическая реакция протекает при относительно низкой температуре (в интервале кристаллизации) благодаря тому, что зарождение пузырьков СО облегчается образованием твердых кристаллов металла, а также выделением скрытой теплоты кристаллизации. Образующиеся при этом пузырьки СО заполняют усадочные пустоты в затвердевающем образце и препятствуют образованию утяжины на его свободной поверхности. Поэтому образец недораскисленной стали имеет выпуклую или плоскую свободную поверхность, тогда как наличие утяжины на образце свидетельствует о раскисленности стали (рис. 8.10).
После получения образца раскисленной стали предварительное раскисление заканчивают. При выпуске стали из печи проводят окончательное раскисление алюминием, который задают на желоб печи или в ковш, под струю металла. Раскислительная способность алюминия настолько велика, что при остаточном содержании его в стали 0,001 % содержание растворенного кислорода в стали составляет около 0,001 %, что приближается к пределу определения концентрации кислорода.
Для каждой марки или группы марок стали разрабатывают и используют свою технологию раскисления.
Диффузионное раскисление основано на применении закона распределения, согласно которому равновесное отношение концентраций оксида железа в шлаке (FeO) и в металле [FeO] является постоянной величиной при данной температуре, не зависящей от абсолютного количества оксида в системе, т.е.
а
С позиции закона распределения безразлично, куда вводится раскислитель — в шлак или в металл — в обоих случаях фазы будут раскисляться пропорционально благодаря диффузии FeO из одной несмешивающейся фазы в другую.
При диффузионном раскислении стали раскислитель вводят в шлак. Обычно при диффузионном раскислении используют сильные восстановители: углерод (в виде электродного боя, древесного угля), ферросилиций, алюминий.
Преимущество диффузионного раскисления состоит в том, что продукты реакций раскисления образуются и остаются в шлаке и не «замутняют» металл. Однако скорость процесса диффузионного раскисления значительно меньше скорости глубинного (осаждающего) раскисления даже при высокой температуре металла и шлака. Это приводит к существенному уменьшению производительности печи.
Раскисление медных сплавов проводится введением раскислителей как в расплав, так и в шлак (поверхностное раскисление). Некоторые из используемых раскислителей способствуют дегазации расплава и увеличению электропроводности медных отливок.
