
- •Глава 1. Основы теоретических представлений в органической химии
- •1.1. Учение а.М. Бутлерова
- •1.2. Теория гибридизации атомных орбиталей
- •1.3. Ковалентная связь
- •1.3.3. Водородные связи
- •1.4. Теория электронных смещений
- •1.5. Классификация и номенклатура органических соединений
- •1.5.1. Заместительная номенклатура
- •1.5.2. Радикало-функциональная номенклатура
- •1.5.4. Рациональная Номенклатура
- •1.6. Представление о Кислотно-оснÓвных свойствах органических соединений
- •1.7. Основы стереохимии
- •1.7.1. Оптическая изомерия
- •1.7.2. Геометрическая изомерия
- •1.7.3. Конформационная изомерия
- •1.8. Классификация органических реакций. Понятие о механизме реакций. Растворители и катализаторы
- •1.9. Методы идентификации органических соединений. Основные физические константы
- •1.10. Методы разделения и очистки органических веществ
- •1.10.1. Разделение твёрдых смесей и очистка твёрдых веществ
- •1.10.2. Разделение жидких смесей и очистка жидкостей
- •1.11. Представление о биологическом действии и метаболизме органических соединений
- •Глава 2. Алканы
- •2.1. Номенклатура. Изомерия
- •2.2. Строение
- •2.3. Физические свойства
- •2.4. Химические свойства
- •2.4.1. Реакции радикального замещения
- •2.4.2. Реакции дегидрирования и разложения
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •2.6. Применение и физиологическая роль
- •Глава 3. Функциональные производные алканов
- •3.1. ОбщноСть Химических свойств
- •3.1.1. Реакции нуклеофильного замещения
- •3.1.2. Реакции отщепления (элиминирования)
- •3.2. Галогеналканы
- •3.2.1. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •3.2.3. Способы получения
- •3.2.4. Полигалогеналканы
- •3.2.5. Физиологическая роль и Важнейшие представители
- •3.3. Насыщенные спирты
- •3.3.1. Классификация, номенклатура, изомерия
- •3.3.2. Строение и физические свойства
- •3.3.3. Химические свойства
- •3.3.4. Способы получения
- •3.3.5. Многоатомные спирты
- •3.3.6. Физиологическое действие
- •3.3.7. Важнейшие представители
- •3.4. Простые насыщенные эфиры
- •3.4.1. Номенклатура и изомерия
- •3.4.2. Физические и химические свойства
- •3.4.3. Способы получения
- •3.4.4. Циклические простые эфиры
- •3.4.5. Физиологическая роль и Важнейшие представители
- •3.5. Эфиры минеральных кислот
- •3.5.1. Эфиры серной кислоты
- •3.5.2. Эфиры фосфорной кислоты
- •3.6. Тиоспирты и тиоэфиры
- •3.7. Насыщенные амины
- •3.7.1. Классификация, номенклатура, изомерия
- •3.7.2. Физические свойства
- •3.7.3. Строение и химические свойства
- •3.7.4. Способы получения
- •3.7.5. Физиологическая роль и Важнейшие представители
- •3.8. Нитроалканы
- •3.8.1. Строение
- •3.8.2. Свойства
- •3.8.3. Способы получения
- •3.8.4. Физиологическое действие и Важнейшие представители
- •3.9. Кремний-, фосфор- и мышьякорганические соединения
- •3.9.1. Кремнийорганические соединения
- •3.9.2. Фосфорорганические соединения
- •3.9.3. Мышьякорганические соединения
- •Глава 4. Непредельные углеводороды
- •4.1. ОБщность строения и химических свойств
- •4.1.1. Реакции электрофильного присоединения
- •4.1.2. Реакции радикального присоединения
- •4.1.3. Реакции радикального замещения
- •4.1.4. Другие реакции
- •4.2. Этиленовые углеводороды
- •4.2.1. Номенклатура, изомерия
- •4.2.2. Физические свойства
- •4.2.3. Химические свойства
- •4.2.4. Способы получения
- •4.2.5. Физиологическое действие и Важнейшие представители
- •4.3. Диеновые (и полиеновые) углеводороды
- •4.3.1. Классификация, номенклатура
- •4.3.5. Способы получения
- •4.3.6. Важнейшие представители
- •4.4. Ацетиленовые углеводороды
- •4.4.1. Номенклатура, изомерия
- •4.4.2. Особенности строения и свойств
- •4.4.3. Способы получения
- •4.4.4. Физиологическое действие и Важнейшие представители
- •Глава 5. Функциональные производные непредельнЫх углеводороДов
- •5.1. ОБщность строения и химических свойств
- •5.1.1. Классификация
- •5.1.2. Субстраты винильного типа
- •5.1.3. Субстраты аллильного типа
- •5.2. Галогеналкены
- •5.2.1. Винилгалогениды
- •5.2.2. Аллилгалогениды
- •5.2.3. Способы получения
- •5.2.4. Важнейшие представители
- •5.3. Непредельные спирты и эфиры
- •5.3.1. Виниловый спирт и его эфиры
- •5.3.2. Аллиловый и пропаргиловый спирты
- •5.3.3. Способы получения
- •5.3.4. Важнейшие представители
- •Глава 6. Алифатические альдегиды, кетоны и карбоновые кислоты
- •6.1. Насыщенные альдегиды и кетоны
- •6.1.1. Изомерия, номенклатура
- •6.1.2. Строение карбонильной группы
- •6.1.3. Физические свойства
- •6.1.4. Химические свойства
- •6.1.5. Способы получения
- •6.1.6. Физиологическая роль
- •6.1.7. Важнейшие представители
- •6.2. Непредельные альдегиды и кетоны
- •6.2.1. Кетен
- •6.2.2. Непредельные карбонильные соединения
- •Примерами соединений с сопряжёнными -связями являются
- •6.2.3. Важнейшие представители
- •6.3. Дикарбонильные соединения
- •6.3.3. Важнейшие представители
- •6.4. Насыщенные монокарбоновые кислоты и их производные
- •6.4.1. Номенклатура
- •6.4.2. Строение функциональной группы
- •6.4.3. Физические свойства
- •6.4.4. Химические свойства
- •6.4.5. Способы получения
- •6.4.6. Пероксикарбоновые кислоты и ацилпероксиды
- •6.4.7. Физиологическая роль и Важнейшие представители
- •6.5. Непредельные монокарбоновые кислоты
- •6.5.1. Номенклатура, изомерия
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •6.5.4. Способы получения
- •6.5.5. Физиологическая роль и Важнейшие представители
- •6.5.6. Омыляемые липиды
- •6.6. Дикарбоновые кислоты и их производные
- •6.6.1. Особенности химического поведения
- •6.6.2. Малоновый эфир и синтезы на его основе
- •2 H5c2ooc-ch2-cooc2h5
- •2 H5c2ooc-ch2-cooc2h5
- •6.6.3. Способы получения
- •2 Rooc-(ch2)n-сoo¯ 2 rooc-(ch2)n-сoo rooc-(ch2)2n-coor hooc-(ch2)2n-cooh
- •6.6.4. Важнейшие представители
- •6.7. Гидроксикислоты
- •6.7.1. Классификация, номенклатура, изомерия
- •6.7.2. Химические свойства
- •6.7.3. Способы получения
- •6.7.4. Физиологическая роль и Важнейшие представители
- •6.8. Оксокислоты
- •6.8.1. Особенности химического поведения
- •6.8.2. Ацетоуксусный эфир и синтезы на его основе
- •6.8.3. Способы получения
- •6.8.4. Важнейшие представители
- •6.9. Аминокарбоновые кислоты. Пептиды
- •6.9.1. Классификация, номенклатура, изомерия аминокислот
- •6.9.2. Строение, физические и Химические свойства
- •6.9.3. Способы получения аминокислот
- •6.9.4. Важнейшие представители аминокислот
- •6.9.5. Пептиды
- •Глава 7. Углеводы
- •7.1. Моносахариды
- •7.1.1. Изомерия, номенклатура
- •7.1.2. Химические свойства
- •7.1.3. Важнейшие представители моносахаридов и их производных
- •7.2. Олигосахариды
- •7.2.1. Классификация и номенклатура дисахаридов
- •7.2.2. Химические свойства дисахаридов
- •7.2.3. Важнейшие представители дисахаридов
- •7.3. Полисахариды
- •7.3.1. Целлюлоза
- •7.3.2. Амилоза и амилопектин
- •7.3.3. Гликоген
- •7.3.4. Декстраны
- •7.3.5. Хитин
- •7.3.6. Пектовая кислота
- •7.3.7. Гетерополисахариды
- •Глава 8. Алициклические углеводороды и их производные
- •8.1. Номенклатура моно- и бициклических соединений
- •8.2. Пространственное строение и изомерия циклоалканов
- •8.2.1. Циклопропан
- •8.2.2. Циклобутан
- •8.2.3. Циклопентан
- •8.2.4. Циклогексан
- •8.3. Химические свойства
- •8.3.1. Реакции циклопропана, циклопропена и их производных
- •8.3.2. Реакции циклобутана и его производных
- •8.3.3. Реакции средних циклов
- •8.3.4. Реакции изомеризации цикла
- •8.4. Способы получения циклоалканов
- •8.5. Терпены и терпеноиды. Каротиноиды
- •8.5.1. Ациклические терпены и терпеноиды
- •8.5.2. Моноциклические терпены и терпеноиды
- •8.5.3. Бициклические терпены и терпеноиды
- •8.5.4. Каротиноиды
- •8.6. Физиологическая роль и важнейшие представители
- •8.7. Стероиды
- •Глава 9. Бензол. Ароматичность. Углеводороды ряда бензола
- •9.1. Строение бензола
- •Тепловой эффект реакции гидрирования бензола составляет
- •9.2. Номенклатура и изомерия аренов
- •9.3. Строение аренов
- •9.3.1. Строение толуола
- •9.3.2. Строение винилбензола
- •9.4. Физические свойства
- •9.5. Химические Свойства
- •9.5.1. Химические свойства бензола
- •9.5.2. Химические свойства аренов
- •9.6. Способы получения
- •9.7. Физиологическое действие и важнейшие представители аренов
- •9.8. Небензоидные ароматические системы
- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.10. Физиологическая роль функциональных производных бензола
- •Глава 11. Полициклические ароматические углеводороды и их производные
- •11.1. Классификация углеводородов с конденсированными циклами
- •11.2. Нафталин
- •11.2.1. Строение, изомерия, номенклатура
- •11.2.2. Свойства
- •11.2.3. Способы получения
- •11.2.4. Важнейшие представители
- •11.3. Антрацен
- •11.3.1. Строение, изомерия, номенклатура
- •11.3.2. Свойства
- •Продукт исчерпывающего гидрирования (пергидроантрацен) можно получить, проводя реакцию в жёстких условиях с применением металлических катализаторов.
- •11.3.3. Способы получения
- •11.3.4. Важнейшие представители
- •11.4. Фенантрен
- •11.4.1. Строение, изомерия, номенклатура
- •11.4.2. Свойства
- •11.4.3. Способы получения
- •11.5. Физиологическое действие полициклических углеводородов
- •Глава 12. Гетероциклические соединения
- •12.1. Классификация и номенклатура
- •12.2. Пятичленные гетероциклические
- •12.2.1. Номенклатура пиррола, фурана и тиофена и их производных
- •12.2.2. Строение пиррола, фурана и тиофена
- •12.2.3. Физические и химические свойства пиррола, фурана и тиофена
- •12.2.4. Особенности индола
- •12.2.5. Способы получения пиррола, фурана, тиофена, индола
- •12.2.6. Важнейшие представители и медико-биологическое значение
- •12.3. Пятичленные гетероциклические
- •12.3.1. Номенклатура имидазола и пиразола
- •12.3.2. Строение имидазола и пиразола
- •12.3.3. Физические и химические свойства имидазола и пиразола
- •12.3.4. Способы получения
- •12.3.5. Важнейшие представители и медико-биологическое значение
- •12.4. Шестичленные гетероциклические
- •12.4.1. Номенклатура пиридина и его производных
- •12.4.2. Строение пиридина
- •12.4.3. Химические свойства пиридина
- •Но если оба -положения заняты, то замещается водород в-положении. При нагревании с избытком амида натрия можно получить 2,6-диаминопиридин.
- •12.4.4. Особенности химического поведения пиколинов и функциональных производных пиридина
- •12.4.5. Хинолин и изохинолин
- •12.4.7. Способы получения
- •Реакция аналогична получению бензола, протекает при высоких температурах, но представляет только теоретический интерес.
- •12.4.8. Важнейшие представители и медико-биологическое значение
- •12.5. Шестичленные гетероциклические
- •12.5.1. Строение и свойства диазинов
- •12.5.2. Пурин
- •12.5.3. Способы получения
- •12.5.4. Важнейшие представители и медико-биологическое значение
- •12.5.5. Нуклеозиды, нуклеотиды и нуклеиновые кислоты
- •12.6. Алкалоиды
10.9. Ароматические карбоновые кислоты и их производные
В соответствии с названием ароматические карбоновые кислоты должны содержать ароматическое кольцо и карбоксильную группу (возможно, не одну). При этом чаще всего предполагается, что эти структурные фрагменты непосредственно связаны друг с другом.
Как и алифатические аналоги, ароматические карбоновые кислоты могут образовывать ацильные производные (ангидриды, галогенангидриды, сложные эфиры, амиды, соли) и нитрилы.
10.9.1. Классификация, номенклатура
Молекулы ароматических карбоновых кислот могут содержать одну или несколько карбоксильных групп, и по этому признаку их можно разделить на монокарбоновые, дикарбоновые, трикарбоновые и т. д. кислоты.
Для названия ароматических карбоновых кислот наиболее применима заместительная номенклатура. При этом атомы углерода карбоксильной группы не включаются в родоначальную структуру. Таким образом, простейшая ароматическая кислота должна получить название «бензолкарбоновая кислота», однако за ней сохраняется тривиальное название бензойная кислота, которое используется как родоначальное при составлении названий замещённых ароматических кислот. Например:

бензолкарбоновая кислота, 2-этилбензойная кислота 4-гидрокси-3-этилбензойная или бензойная кислота кислота
Ацильные производные бензойной кислоты называются при помощи слова «бензоил» (название ацила) или «бензоат» (название ацилата); для амида название «бензолкарбоксамид» обычно сокращается до бензамида. Нитрил бензойной кислоты должен называться соответственно «бензолкарбонитрил»; название сокращается до бензонитрила:

бензоилхлорид метилбензоат бензамид бензонитрил
Названия производных замещённых бензойных кислот строятся на основе названий производных бензойных кислот. Например:

4-хлорбензоилхлорид 2-этилбензоат натрия
Для ряда кислот и их производных сохраняются тривиальные и широко используются полутривиальные названия. Например:

фталевая изофталевая терефталевая анисовая толуиловые
(о-, м-, п-)
10.9.2. Строение бензойной кислоты
К арбоксильная
группа в молекуле бензойной кислоты
оказывает по отношению к ароматическому
кольцу электроноакцепторные индуктивный
и мезомерный эффекты (аналогия со
строением бензальдегида — гл. 10.8.2).
Электронная плотность на кольце понижена,
особенно во-
и п-положениях.
В сопряжение вовлекается и атом кислорода
OH-группы,
в связи с чем вся молекула имеет плоское
строение.
арбоксильная
группа в молекуле бензойной кислоты
оказывает по отношению к ароматическому
кольцу электроноакцепторные индуктивный
и мезомерный эффекты (аналогия со
строением бензальдегида — гл. 10.8.2).
Электронная плотность на кольце понижена,
особенно во-
и п-положениях.
В сопряжение вовлекается и атом кислорода
OH-группы,
в связи с чем вся молекула имеет плоское
строение.
10.9.3. Физические и химические свойства
Ароматические карбоновые кислоты представляют собой белые кристаллические вещества, некоторые из них обладают приятным запахом.
Важнейшими свойствами самих карбоновых кислот (ароматических так же, как и алифатических) и в ряде случаев таких их производных, как амиды, являются их кислотно-основные свойства. При этом оснóвные свойства незначительны и практического значения не имеют.
Так же, как и для алифатических аналогов, для ароматических кислот и их производных характерны реакции в ацильной группе, приводящие к получению одних производных из других.
Ещё одним важным свойством этих соединений являются реакции по бензольному кольцу, что характерно для всех ароматических производных.
10.9.3.1. Кислотные свойства
Кислотные свойства алифатических карбоновых кислот рассматривались ранее (гл. 6.4.4.1). Для ароматических карбоновых кислот кислотность связана также с возможностью отрыва катиона водорода от карбоксильной группы. При этом аренмонокарбоновые кислоты относятся к слабым OH-кислотам. Бензойная кислота лишь ненамного сильнее уксусной (рКа для бензойной равна 4.17 против 4.76 для уксусной). Лучше всего это можно объяснить возможностью более полной делокализации отрицательного заряда аниона кислотного остатка с участием -электронной системы бензольного кольца.

Поэтому так же, как и в случаях с аренсульфокислотами (гл. 10.3.3.4) и фенолами (гл. 10.5.3.1), электроноакцепторные заместители будут увеличивать кислотные свойства, а электронодонорные, наоборот, — уменьшать.

Однако для некоторых заместителей, находящихся в орто-положении бензольного кольца по отношению к карбоксильной группе, влияние на кислотные свойства аренкарбоновых кислот не ограничивается индуктивным и мезомерным эффектами (и пространственным эффектом тоже). Это так называемый орто-эффект, проявляющийся во взаимодействии карбоксильной и находящейся к ней в о-положении р-донорной группы за счёт внутримолекулярных водородных связей. Примером проявления орто-эффекта является взаимодействие функциональных групп в молекуле салициловой кислоты, увеличивающее её кислотность по сравнению с бензойной (рКа = 3.00) за счёт увеличения полярности О–Н-связи в карбоксильной группе и стабилизации образующегося аниона:

салициловая кислота
Это характерно также для антраниловой (о-аминобензойной) кислоты, для фталевой (о-бензолдикарбоновой кислоты) и аналогичных по структуре о-замещённых бензойных кислот.
В целом арендикарбоновые и аренполикарбоновые кислоты являются более сильными, чем монокарбоновые (сказывается акцепторное влияние второй карбоксильной группы).
Значимыми кислотными свойствами обладают также амиды и имиды некоторых кислот. Например, фталимид является типичной (хотя и слабой) NH-кислотой (рКа = 8.3):

Он растворяется в водных щелочах (солеобразование с последующим гидролизом). Поэтому для получения стабильных солей их синтезируют в безводной среде.
Соли фталимида (например, фталимид калия) нашли применение в получении чистых первичных аминов (синтез Габриэля*):

Первая стадия здесь — взаимодействие галогеналкана с фталимидом калия, являющимся нуклеофилом, — типичная реакция SN в ряду галогеналканов. За ней следует гидролиз образовавшегося N-алкилфталимида, который обычно проводят в солянокислой среде.
10.9.3.2. Реакции в ацильной группе
Ранее на примере алифатических аналогов (гл. 6.4.4.2) рассматривались реакции нуклеофильного замещения в карбоксильной группе карбоновых кислот и в ацильных группах производных этих кислот. При этом из одних ацильных производных образуются другие ацильные производные.

Возможен и кислотный катализ.


Скорость реакции зависит от пространственных факторов, величины заряда на карбонильном атоме углерода и природы уходящей группы (её основности). Таким образом, реакционная способность ароматических карбоновых кислот и их производных уменьшается в том же ряду, что и их алифатических аналогов:

Для аренкарбоновых кислот характерны также реакции декарбоксилирования, начинающиеся с нуклеофильной атаки по карбонильному атому углерода (гл. 6.4.4.4).
10.9.3.3. Электрофильное замещение
Как следует из строения бензойной кислоты, карбоксильная группа оказывает электроноакцепторное влияние на бензольное кольцо, в связи с чем уменьшает электронную плотность на кольце и направляет вступающий электрофил преимущественно в мета-положение. Это можно показать граничными формулами распределения электронной плотности в исходной молекуле бензойной кислоты:

Из SE-реакций для аренкарбоновых кислот (и их ацильных производных) характерны реакции нитрования, сульфирования и галогенирования. Например:

10.9.4. способы получения
Для получения ароматических карбоновых кислот можно использовать способы, применяющиеся для получения их алифатических аналогов (гл. 6.4.5).
Окисление спиртов, альдегидов, кетонов.
Гидролиз ,,-тригалогенаренов.
Металлорганический синтез (карбоксилирование реактивов Гриньяра).
Гидролиз (гидратация) нитрилов.
Однако ароматические карбоновые кислоты и их производные можно получать и другими способами.
Окисление аренов кислородом в присутствии катализаторов (соли кобальта и марганца) или обычными неорганическими окислителями (перманганаты, дихроматы). Эти реакции были рассмотрены в главе 9.5.1.4.
Ацилирование аренов с помощью фосгена — прямой способ получения галогенангидридов:

Это обычная реакция электрофильного замещения в ароматическое кольцо; такие реакции рассматривались в свойствах бензола и аренов.
10.9.5. Важнейшие представители
Бензойная кислота — бесцветное кристаллическое вещество с температурой плавления 395 К. Легко возгоняется. Обладает бактерицидными свойствами. В промышленности бензойную кислоту получают окислением толуола.
Используется для получения красителей, душистых и лекарственных веществ.
п-Аминобензойная кислота (витамин H1) участвует во многих жизненно важных процессах в качестве промежуточного вещества. В связи с этим является жизненно важным фактором для многих микроорганизмов, а также необходимым элементом для биосинтеза некоторых витаминов. Эфиры п-аминобензойной кислоты нашли применение в медицине как лекарственные вещества с местноанестезирующим действием. Примерами таких веществ могут служить новокаин и анестезин. Этиловый эфир п-аминобензойной кислоты (анестезин) применяется как местноанестезирующее средство более 70 лет. Получают его из п-нитротолуола по следующей схеме:

анестезин
Терефталевая кислота — бесцветное кристаллическое вещество с температурой плавления 698 К, но при температуре 573 К возгоняется.
В промышленности терефталевую кислоту получают окислением п-ксилола кислородом воздуха.
Используется в производстве синтетического волокна лавсана (полиэтилентерефталата) и кевлара (поли-п-фенилентерефталата). Такие полимеры обладают прекрасной термической устойчивостью (что определяется наличием ароматических циклов) и очень хорошими механическими свойствами.
Ф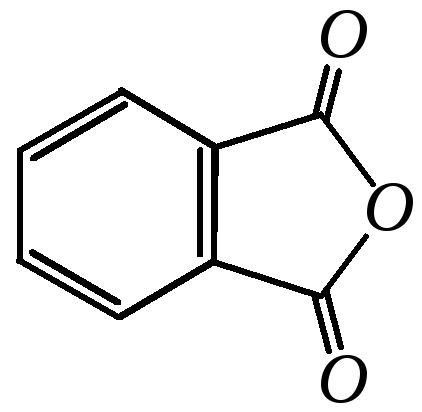 талевый
ангидрид—
бесцветное кристаллическое вещество
с температурой плавления 404 К.
талевый
ангидрид—
бесцветное кристаллическое вещество
с температурой плавления 404 К.
В промышленности фталевый ангидрид получают окислением нафталина или о-ксилола.
Применяется для получения полиэфиров, пластификаторов и красителей; используется в органическом синтезе для получения биологически активных соединений.
Салициловая кислота (гл. 10.5.3, 10.9.3.1) — бесцветное кристаллическое вещество с температурой плавления 432 К. Легко возгоняется. В промышленности получают карбоксилированием фенола.
Салициловая кислота и её производные используют в медицине в качестве лекарственных препаратов.
