
- •Глава 1. Основы теоретических представлений в органической химии
- •1.1. Учение а.М. Бутлерова
- •1.2. Теория гибридизации атомных орбиталей
- •1.3. Ковалентная связь
- •1.3.3. Водородные связи
- •1.4. Теория электронных смещений
- •1.5. Классификация и номенклатура органических соединений
- •1.5.1. Заместительная номенклатура
- •1.5.2. Радикало-функциональная номенклатура
- •1.5.4. Рациональная Номенклатура
- •1.6. Представление о Кислотно-оснÓвных свойствах органических соединений
- •1.7. Основы стереохимии
- •1.7.1. Оптическая изомерия
- •1.7.2. Геометрическая изомерия
- •1.7.3. Конформационная изомерия
- •1.8. Классификация органических реакций. Понятие о механизме реакций. Растворители и катализаторы
- •1.9. Методы идентификации органических соединений. Основные физические константы
- •1.10. Методы разделения и очистки органических веществ
- •1.10.1. Разделение твёрдых смесей и очистка твёрдых веществ
- •1.10.2. Разделение жидких смесей и очистка жидкостей
- •1.11. Представление о биологическом действии и метаболизме органических соединений
- •Глава 2. Алканы
- •2.1. Номенклатура. Изомерия
- •2.2. Строение
- •2.3. Физические свойства
- •2.4. Химические свойства
- •2.4.1. Реакции радикального замещения
- •2.4.2. Реакции дегидрирования и разложения
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •2.6. Применение и физиологическая роль
- •Глава 3. Функциональные производные алканов
- •3.1. ОбщноСть Химических свойств
- •3.1.1. Реакции нуклеофильного замещения
- •3.1.2. Реакции отщепления (элиминирования)
- •3.2. Галогеналканы
- •3.2.1. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •3.2.3. Способы получения
- •3.2.4. Полигалогеналканы
- •3.2.5. Физиологическая роль и Важнейшие представители
- •3.3. Насыщенные спирты
- •3.3.1. Классификация, номенклатура, изомерия
- •3.3.2. Строение и физические свойства
- •3.3.3. Химические свойства
- •3.3.4. Способы получения
- •3.3.5. Многоатомные спирты
- •3.3.6. Физиологическое действие
- •3.3.7. Важнейшие представители
- •3.4. Простые насыщенные эфиры
- •3.4.1. Номенклатура и изомерия
- •3.4.2. Физические и химические свойства
- •3.4.3. Способы получения
- •3.4.4. Циклические простые эфиры
- •3.4.5. Физиологическая роль и Важнейшие представители
- •3.5. Эфиры минеральных кислот
- •3.5.1. Эфиры серной кислоты
- •3.5.2. Эфиры фосфорной кислоты
- •3.6. Тиоспирты и тиоэфиры
- •3.7. Насыщенные амины
- •3.7.1. Классификация, номенклатура, изомерия
- •3.7.2. Физические свойства
- •3.7.3. Строение и химические свойства
- •3.7.4. Способы получения
- •3.7.5. Физиологическая роль и Важнейшие представители
- •3.8. Нитроалканы
- •3.8.1. Строение
- •3.8.2. Свойства
- •3.8.3. Способы получения
- •3.8.4. Физиологическое действие и Важнейшие представители
- •3.9. Кремний-, фосфор- и мышьякорганические соединения
- •3.9.1. Кремнийорганические соединения
- •3.9.2. Фосфорорганические соединения
- •3.9.3. Мышьякорганические соединения
- •Глава 4. Непредельные углеводороды
- •4.1. ОБщность строения и химических свойств
- •4.1.1. Реакции электрофильного присоединения
- •4.1.2. Реакции радикального присоединения
- •4.1.3. Реакции радикального замещения
- •4.1.4. Другие реакции
- •4.2. Этиленовые углеводороды
- •4.2.1. Номенклатура, изомерия
- •4.2.2. Физические свойства
- •4.2.3. Химические свойства
- •4.2.4. Способы получения
- •4.2.5. Физиологическое действие и Важнейшие представители
- •4.3. Диеновые (и полиеновые) углеводороды
- •4.3.1. Классификация, номенклатура
- •4.3.5. Способы получения
- •4.3.6. Важнейшие представители
- •4.4. Ацетиленовые углеводороды
- •4.4.1. Номенклатура, изомерия
- •4.4.2. Особенности строения и свойств
- •4.4.3. Способы получения
- •4.4.4. Физиологическое действие и Важнейшие представители
- •Глава 5. Функциональные производные непредельнЫх углеводороДов
- •5.1. ОБщность строения и химических свойств
- •5.1.1. Классификация
- •5.1.2. Субстраты винильного типа
- •5.1.3. Субстраты аллильного типа
- •5.2. Галогеналкены
- •5.2.1. Винилгалогениды
- •5.2.2. Аллилгалогениды
- •5.2.3. Способы получения
- •5.2.4. Важнейшие представители
- •5.3. Непредельные спирты и эфиры
- •5.3.1. Виниловый спирт и его эфиры
- •5.3.2. Аллиловый и пропаргиловый спирты
- •5.3.3. Способы получения
- •5.3.4. Важнейшие представители
- •Глава 6. Алифатические альдегиды, кетоны и карбоновые кислоты
- •6.1. Насыщенные альдегиды и кетоны
- •6.1.1. Изомерия, номенклатура
- •6.1.2. Строение карбонильной группы
- •6.1.3. Физические свойства
- •6.1.4. Химические свойства
- •6.1.5. Способы получения
- •6.1.6. Физиологическая роль
- •6.1.7. Важнейшие представители
- •6.2. Непредельные альдегиды и кетоны
- •6.2.1. Кетен
- •6.2.2. Непредельные карбонильные соединения
- •Примерами соединений с сопряжёнными -связями являются
- •6.2.3. Важнейшие представители
- •6.3. Дикарбонильные соединения
- •6.3.3. Важнейшие представители
- •6.4. Насыщенные монокарбоновые кислоты и их производные
- •6.4.1. Номенклатура
- •6.4.2. Строение функциональной группы
- •6.4.3. Физические свойства
- •6.4.4. Химические свойства
- •6.4.5. Способы получения
- •6.4.6. Пероксикарбоновые кислоты и ацилпероксиды
- •6.4.7. Физиологическая роль и Важнейшие представители
- •6.5. Непредельные монокарбоновые кислоты
- •6.5.1. Номенклатура, изомерия
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •6.5.4. Способы получения
- •6.5.5. Физиологическая роль и Важнейшие представители
- •6.5.6. Омыляемые липиды
- •6.6. Дикарбоновые кислоты и их производные
- •6.6.1. Особенности химического поведения
- •6.6.2. Малоновый эфир и синтезы на его основе
- •2 H5c2ooc-ch2-cooc2h5
- •2 H5c2ooc-ch2-cooc2h5
- •6.6.3. Способы получения
- •2 Rooc-(ch2)n-сoo¯ 2 rooc-(ch2)n-сoo rooc-(ch2)2n-coor hooc-(ch2)2n-cooh
- •6.6.4. Важнейшие представители
- •6.7. Гидроксикислоты
- •6.7.1. Классификация, номенклатура, изомерия
- •6.7.2. Химические свойства
- •6.7.3. Способы получения
- •6.7.4. Физиологическая роль и Важнейшие представители
- •6.8. Оксокислоты
- •6.8.1. Особенности химического поведения
- •6.8.2. Ацетоуксусный эфир и синтезы на его основе
- •6.8.3. Способы получения
- •6.8.4. Важнейшие представители
- •6.9. Аминокарбоновые кислоты. Пептиды
- •6.9.1. Классификация, номенклатура, изомерия аминокислот
- •6.9.2. Строение, физические и Химические свойства
- •6.9.3. Способы получения аминокислот
- •6.9.4. Важнейшие представители аминокислот
- •6.9.5. Пептиды
- •Глава 7. Углеводы
- •7.1. Моносахариды
- •7.1.1. Изомерия, номенклатура
- •7.1.2. Химические свойства
- •7.1.3. Важнейшие представители моносахаридов и их производных
- •7.2. Олигосахариды
- •7.2.1. Классификация и номенклатура дисахаридов
- •7.2.2. Химические свойства дисахаридов
- •7.2.3. Важнейшие представители дисахаридов
- •7.3. Полисахариды
- •7.3.1. Целлюлоза
- •7.3.2. Амилоза и амилопектин
- •7.3.3. Гликоген
- •7.3.4. Декстраны
- •7.3.5. Хитин
- •7.3.6. Пектовая кислота
- •7.3.7. Гетерополисахариды
- •Глава 8. Алициклические углеводороды и их производные
- •8.1. Номенклатура моно- и бициклических соединений
- •8.2. Пространственное строение и изомерия циклоалканов
- •8.2.1. Циклопропан
- •8.2.2. Циклобутан
- •8.2.3. Циклопентан
- •8.2.4. Циклогексан
- •8.3. Химические свойства
- •8.3.1. Реакции циклопропана, циклопропена и их производных
- •8.3.2. Реакции циклобутана и его производных
- •8.3.3. Реакции средних циклов
- •8.3.4. Реакции изомеризации цикла
- •8.4. Способы получения циклоалканов
- •8.5. Терпены и терпеноиды. Каротиноиды
- •8.5.1. Ациклические терпены и терпеноиды
- •8.5.2. Моноциклические терпены и терпеноиды
- •8.5.3. Бициклические терпены и терпеноиды
- •8.5.4. Каротиноиды
- •8.6. Физиологическая роль и важнейшие представители
- •8.7. Стероиды
- •Глава 9. Бензол. Ароматичность. Углеводороды ряда бензола
- •9.1. Строение бензола
- •Тепловой эффект реакции гидрирования бензола составляет
- •9.2. Номенклатура и изомерия аренов
- •9.3. Строение аренов
- •9.3.1. Строение толуола
- •9.3.2. Строение винилбензола
- •9.4. Физические свойства
- •9.5. Химические Свойства
- •9.5.1. Химические свойства бензола
- •9.5.2. Химические свойства аренов
- •9.6. Способы получения
- •9.7. Физиологическое действие и важнейшие представители аренов
- •9.8. Небензоидные ароматические системы
- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.10. Физиологическая роль функциональных производных бензола
- •Глава 11. Полициклические ароматические углеводороды и их производные
- •11.1. Классификация углеводородов с конденсированными циклами
- •11.2. Нафталин
- •11.2.1. Строение, изомерия, номенклатура
- •11.2.2. Свойства
- •11.2.3. Способы получения
- •11.2.4. Важнейшие представители
- •11.3. Антрацен
- •11.3.1. Строение, изомерия, номенклатура
- •11.3.2. Свойства
- •Продукт исчерпывающего гидрирования (пергидроантрацен) можно получить, проводя реакцию в жёстких условиях с применением металлических катализаторов.
- •11.3.3. Способы получения
- •11.3.4. Важнейшие представители
- •11.4. Фенантрен
- •11.4.1. Строение, изомерия, номенклатура
- •11.4.2. Свойства
- •11.4.3. Способы получения
- •11.5. Физиологическое действие полициклических углеводородов
- •Глава 12. Гетероциклические соединения
- •12.1. Классификация и номенклатура
- •12.2. Пятичленные гетероциклические
- •12.2.1. Номенклатура пиррола, фурана и тиофена и их производных
- •12.2.2. Строение пиррола, фурана и тиофена
- •12.2.3. Физические и химические свойства пиррола, фурана и тиофена
- •12.2.4. Особенности индола
- •12.2.5. Способы получения пиррола, фурана, тиофена, индола
- •12.2.6. Важнейшие представители и медико-биологическое значение
- •12.3. Пятичленные гетероциклические
- •12.3.1. Номенклатура имидазола и пиразола
- •12.3.2. Строение имидазола и пиразола
- •12.3.3. Физические и химические свойства имидазола и пиразола
- •12.3.4. Способы получения
- •12.3.5. Важнейшие представители и медико-биологическое значение
- •12.4. Шестичленные гетероциклические
- •12.4.1. Номенклатура пиридина и его производных
- •12.4.2. Строение пиридина
- •12.4.3. Химические свойства пиридина
- •Но если оба -положения заняты, то замещается водород в-положении. При нагревании с избытком амида натрия можно получить 2,6-диаминопиридин.
- •12.4.4. Особенности химического поведения пиколинов и функциональных производных пиридина
- •12.4.5. Хинолин и изохинолин
- •12.4.7. Способы получения
- •Реакция аналогична получению бензола, протекает при высоких температурах, но представляет только теоретический интерес.
- •12.4.8. Важнейшие представители и медико-биологическое значение
- •12.5. Шестичленные гетероциклические
- •12.5.1. Строение и свойства диазинов
- •12.5.2. Пурин
- •12.5.3. Способы получения
- •12.5.4. Важнейшие представители и медико-биологическое значение
- •12.5.5. Нуклеозиды, нуклеотиды и нуклеиновые кислоты
- •12.6. Алкалоиды
6.4.4. Химические свойства
Общим в химических свойствах карбоновых кислот и их ацильных производных являются реакции в ацильной группе, так как электронное строение функциональной группы кислот и их ацильных производных близкó и различается только величиной электронных эффектов.
Принципиальные различия в строении карбоновых кислот и их ацильных производных связаны с наличием подвижных атомов водорода у электроотрицательного атома (как в случае карбоновых кислот и их амидов) и проявлением ими кислотных свойств.
6.4.4.1. Кислотно-оснόвные свойства
Кислотные свойства карбоновых кислот связаны с наличием сильнополярной связи O–Н. Кроме того, из рассмотрения граничных структур молекулы карбоновой кислоты следует, что возможна миграция протона от одного атома кислорода к другому. А так как природа этих атомов идентична, то состояние реальной молекулы будет описываться некоторой промежуточной формулой, в которой катион водорода в равной мере принадлежит каждому атому кислорода:

При отщеплении от молекулы катиона водорода образуется карбоксилат-анион, стабилизированный p--сопряжением:

С пособствовать
делокализации отрицательного заряда
в этом анионе будут электроноакцепторные
заместители. Поэтому в гомологическом
ряду предельных монокарбоновых кислот
кислотные свойства будут уменьшаться
(из-за возрастания донорного эффекта
радикала R), но
введение в углеводородный радикал
электроноакцепторных заместителей
приведёт к дальнейшей поляризации связиO–Н, более легкому
отрыву протона, стабилизации аниона
кислотного остатка и, как следствие, —
к возрастанию кислотных свойств.
пособствовать
делокализации отрицательного заряда
в этом анионе будут электроноакцепторные
заместители. Поэтому в гомологическом
ряду предельных монокарбоновых кислот
кислотные свойства будут уменьшаться
(из-за возрастания донорного эффекта
радикала R), но
введение в углеводородный радикал
электроноакцепторных заместителей
приведёт к дальнейшей поляризации связиO–Н, более легкому
отрыву протона, стабилизации аниона
кислотного остатка и, как следствие, —
к возрастанию кислотных свойств.
Примером проявления кислотных свойств является образование солей при растворении карбоновых кислот в водных растворах щелочей (известно, что спирты со щелочами не взаимодействуют):
R-COOH + NaOH R-COO¯ Na+ + H2O
Однако по сравнению с минеральными кислотами карбоновые кислоты являются слабыми электролитами и их соли в водных растворах частично гидролизованы.
Оснóвные свойства карбоновых кислот проявляются у них по отношению к сильным кислотам. В смеси карбоновой кислоты с концентрированной серной кислотой или при растворении газообразного хлороводорода в карбоновой кислоте происходит её протонирование. Существование образующегося при этом катиона можно описать при помощи граничных структур:

Кислотно-основные свойства, кроме самих карбоновых кислот, присущи также амидам карбоновых кислот. В этих соединениях аминогруппа эффективно сопряжена с карбонильной:

При этом азот принимает sp2-гибридное состояние и вместе со своим окружением располагается в одной плоскости с карбонильной группой. В такой конформации и происходит эффективное р--сопряжение р-орбитали атома азота с -связью С=О.
В связи с р--сопряжением атом азота в амидах теряет оснóвные свойства, но при этом для амидов становятся более характерны кислотные свойства:

6.4.4.2. Реакции нуклеофильного замещения
Карбоновые кислоты и их ацильные производные аналогично альдегидам и кетонам могут подвергаться нуклеофильной атаке по карбонильному атому углерода. Однако эта реакция для них может быть затруднена из-за +М-эффекта заместителя Х, возникающего в результате р--сопряжения (см. выше). Поэтому реакционная способность этих соединений по отношению к нуклеофилам будет сильно зависеть от природы заместителя Х.
В отличие от альдегидов и кетонов карбоновые кислоты и их ацильные производные реагируют с нуклеофилами с образованием продуктов замещения, а не присоединения. Это связано с бóльшей устойчивостью продукта замещения по сравнению с промежуточной частицей и с устойчивостью аниона уходящей группы Х¯:

Нуклеофилами здесь обычно являются аммиак, амины, спирты, вода, их анионы, а также могут быть анионы карбоновых кислот, галогениды фосфора и серы. В целом для карбоновых кислот и их производных замещение протекает легче, чем нуклеофильное замещение у насыщенного атома углерода (в галогеналканах, спиртах, эфирах, аминах). Это связано, по крайней мере, с двумя причинами: 1) большей доступностью sp2-гибридизованного атома углерода в карбоксильной (или ацильной) группе по сравнению с тетраэдрическим в насыщенных соединениях; 2) более легким разрывом -связи в первом случае на лимитирующей стадии атаки реагентом по сравнению с разрывом-связи С–Х при SN2-механизме у sp3-гибридизованного атома углерода.
На скорость реакций ацилирования в большинстве случаев оказывают влияние кислотные катализаторы (протонные кислоты и кислоты Льюиса). При этом механизм катализа будет зависеть от типа кислоты:

или

Но производные карбоновых кислот могут сильно различаться по своей реакционной способности. На это влияют два фактора: величина донорного мезомерного эффекта заместителя X и устойчивость аниона уходящей группы Х¯.
В меньшей степени мезомерный эффект
проявляется для галогенов. Фтор наиболее
электроотрицателен, и донорный эффект
его незначителен.
Электроотрицательность от хлора к йоду
уменьшается хотя и значительно, но в
том же ряду сильно увеличиваются размеры
орбиталей внешнего уровня (на котором
находится неподелённая пара электронов),
поэтому взаимодействие такой орбитали
с C=О-связью
будет всё менее эффективным в этом ряду
галогенов. Напротив, наибольшим донорным
эффектом обладает аминогруппа, так как
азот менее электроотрицателен, чем фтор
и кислород, а внешние р-орбитали
имеют такую же геометрию, что и орбитали
-связи
C=О.
(Ещё больше +М-эффект
в анионах солей
меньшей степени мезомерный эффект
проявляется для галогенов. Фтор наиболее
электроотрицателен, и донорный эффект
его незначителен.
Электроотрицательность от хлора к йоду
уменьшается хотя и значительно, но в
том же ряду сильно увеличиваются размеры
орбиталей внешнего уровня (на котором
находится неподелённая пара электронов),
поэтому взаимодействие такой орбитали
с C=О-связью
будет всё менее эффективным в этом ряду
галогенов. Напротив, наибольшим донорным
эффектом обладает аминогруппа, так как
азот менее электроотрицателен, чем фтор
и кислород, а внешние р-орбитали
имеют такую же геометрию, что и орбитали
-связи
C=О.
(Ещё больше +М-эффект
в анионах солей
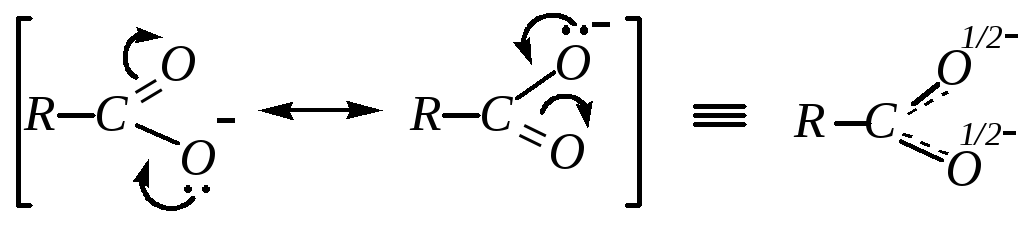 ,
,
так как на частице делокализуется целочисленный отрицательный заряд. Это практически исключает взаимодействие с нуклеофилами таких частиц, и поэтому нуклеофильное замещение в анионах солей карбоновых кислот обычно не рассматривается.)
Устойчивость аниона уходящей группы для галогенов является наиболее высокой (галогенид-ионы — это анионы сильных кислот), а в противоположность им амид-ион малостабилен, так как является анионом слабой кислоты — аммиака.
Таким образом, все ацильные производные и сами кислоты можно расположить в следующий ряд уменьшения реакционной способности в реакциях нуклеофильного замещения: галогенангидриды, ангидриды, кислоты, сложные эфиры, амиды.
В этих реакциях замещения в преобладающем числе случаев одни ацильные производные превращаются в другие. Сравнивая их реакционную способность, можно предположить, что галогенангидриды будут легко превращаться как в сами кислоты, так и в другие их производные. И наоборот, амиды с большим трудом вступают в эти реакции: в жёстких условиях и в присутствии кислотного или основного катализатора.
Так, галогенангидриды могут превращаться в кислоты, ангидриды, сложные эфиры, амиды, а при действии кадмийорганических соединений — в кетоны:

Реакции идут легко, энергично, с большим тепловыделением. Применения катализатора не требуется. Последнее из приведённых превращений может использоваться в качестве одного из способов получения кетонов.
Механизм реакции, как и в случаях взаимодействия с нуклеофилами других ацильных производных, SN2. Например:

Однако для галогенангидридов (только!) возможен и SN1-механизм. На первой стадии образуется ацилий-катион, который дальше взаимодействует с нуклеофильной частицей:


Такой механизм наблюдается обычно в сильнокислой среде (концентрированная серная кислота, а также кислоты Льюиса), которая способствует диссоциации связи С–Х в молекулах галогенангидридов.
Ангидриды кислот — соединения тоже высокореакционноспособные и легко превращаются в кислоты и другие ацильные производные, кроме галогенангидридов, и по сравнению с галогенангидридами реагируют медленнее:

Реакция протекает по аналогичному механизму. Нуклеофильной атаке подвергается один из карбонильных атомов углерода — тот, который более доступен и на котором бóльший эффективный положительный заряд.
Сами карбоновые кислоты в большинство SN-реакций вступают в присутствии катализатора и/или при сильном нагревании. Так, для получения из кислот ангидридов обычно используется оксид фосфора (V) или оксид алюминия при нагревании, а галогенангидриды из кислот можно получить только при использовании таких мощных галогенирующих средств, как галогениды фосфора и серы (например, PCl5, SOCl2). Механизм реакции с тионилхлоридом возможно такой :


Общую схему превращения кислот в их производные можно представить следующим образом:

Механизм реакции образования из кислот сложных эфиров (т.е. этерификации), протекающей в кислой среде, можно представить следующим образом:


Такие ацильные производные, как сложные эфиры, ненамного отличаются по реакционной способности от карбоновых кислот, если реакцию проводят в присутствии кислотного катализатора. Кислотный гидролиз сложных эфиров является реакцией обратной этерификации, и все стадии его механизма осуществляются в обратном порядке:


Однако для третичных алкиловых эфиров (R= трет-алкил) механизм кислотного гидролиза может быть несколько иным:


В этом случае наблюдается разрыв связи O–Csp3, а механизм реакции можно классифицировать какSN1 у насыщенного атома углерода.
При оснóвном же катализе сложные эфиры даже более реакционноспособны, так как кислоты в щелочной среде превращаются в малоактивные карбоксилат-ионы, и реакция становится необратимой. К тому же нуклеофильной частицей здесь является более активный гидроксид-ион:


Общую схему превращений сложных эфиров по ацильной группе можно представить так:

Взаимодействие с молекулой другого спирта ROH и образование нового сложного эфира (это реакция переэтерификации) протекает по механизму, аналогичному гидролизу сложных эфиров. А взаимодействие с реактивами Гриньяра сначала даёт кетоны (как показано в схеме), а затем избыток реактива Гриньяра превращает кетоны в третичные спирты (гл. 6.1.4.1, п. 6). Образование кетонов — это тоже реакция нуклеофильного замещения, которое в этом случае протекает через образование четырёхцентровых переходного состояний:


Амиды карбоновых кислот, как уже отмечалось, труднее всего вступают в нуклеофильное замещение по ацильной группе, и единственной реакцией, имеющей практическое значение, здесь является гидролиз в кислой или щелочной среде с образованием карбоновой кислоты (или карбоксилат-иона). Например, для N,N-дизамещённых амидов:

Соли карбоновых кислот в реакции замещения по карбонильному атому углерода не вступают (см. выше строение карбоксилат-аниона), но в кислой среде они превращаются в карбоновые кислоты, и реакция замещения протекает как с карбоновыми кислотами:

6.4.4.3. Реакции с участием -водородных атомов
Одна из таких реакций — это бромирование (или иногда хлорирование) карбоновых кислот в присутствии красного фосфора (реакция Гелля–Фольгарда–Зелинского*), протекающее по схеме:
R–СН2–COОH
![]() R–СНBr–COОH
R–СНBr–COОH
Роль фосфора сводится к образованию на первой стадии трибромида фосфора, который, вступая в реакцию с молекулой кислоты, превращает её в галогенангидрид (см. выше):
P + Br2 PBr3

Образовавшийся бромоангидрид в енольной форме подвергается дальнейшему бромированию, а при взаимодействии со второй молекулой карбоновой кислоты происходит замещение в ацильной группе:


В результате образуется молекула -галогенозамещённой карбоновой кислоты и молекула галогенангидрида, которая дальше вступает в реакцию бромирования в енольной форме.
Использование избытка брома может привести к получению дибромозамещённых кислот:
R–СНBr–COОH
![]() R–СBr2–COОH
R–СBr2–COОH
Хлорирование так же, как и бромирование, протекает по электрофильному механизму, но возможно хлорирование и по радикальному механизму. В этом случае реакция будет проходить не только по -углеродному атому, например:

Помимо галогенирования для рассматриваемых соединений возможны и другие реакции с участием -водородных атомов. Эти реакции, вызванные проявлениемCН-кислотности данного структурного фрагмента, в бóльшей степени характерны для сложных эфиров, чем для каких-либо других ацильных производных кислот (так как кислоты и амиды обладают соответственноОН- и NН-кислотностью, а ангидриды и галогенангидриды высоко активны по отношению к нуклеофилам, роль которых могут играть участвующие в реакции основания). К таким реакциям относитсяконденсация Кляйзена*, в которую вступают две молекулы сложного эфира:
2
R-СН2-СООС2Н5
![]() R-СН2-СО-СНR-COОС2Н5
+
С2Н5ОН
R-СН2-СО-СНR-COОС2Н5
+
С2Н5ОН
Механизм реакции включает в себя отрыв протона от -углеродного атома под действием алкоголятов с образованием новой нуклеофильной частицы, которая атакует вторую молекулу сложного эфира:

Далее реакция развивается так же, как и при любом другом нуклеофильном замещении в ацильной группе. Заканчивается реакция отрывом алкоголят-аниона и образованием оксоэфира:

К реакциям с участием -водородных атомов можно отнести также образование кетенов при действии сильных органических оснований на галогенангидриды кислот. При этом протекает реакция отщепления и замыкается-связь (гл. 6.2.1).
6.4.4.4. Декарбоксилирование кислот и их солей
Декарбоксилирование может наблюдаться при сплавлении солей карбоновых кислот со щелочами (при 500—600 К). Эта реакция используется для получения низших алканов. Здесь в условиях сильного нагревания происходит нуклеофильное замещение алкильного радикала:

Пиролиз бариевых или кальциевых солей карбоновых кислот также приводит к декарбоксилированию и служит одним из лабораторных способов получения кетонов:

Декарбоксилирование может наблюдаться и при электролизе натриевых и калиевых солей карбоновых кислот (реакция Кольбе):
|
(на аноде) |
|
![]()
При этом образуются алканы с чётным числом атомов углерода в молекуле, и поэтому электролиз является одним из лабораторных способов получения предельных углеводородов (гл. 2.5).
По радикальному механизму также происходит декарбоксилирование серебряных солей карбоновых кислот при обработке их хлором или бромом (реакция Хунсдиккера–Бородина*):

![]()
6.4.4.5. Перегруппировка амидов по Гофману
Эта реакция является одним из способов получения чистых первичных аминов: амид при действии на него брома (или хлора) в щелочной среде превращается в амин с уменьшением углеродной цепи на один атом. Механизм можно представить следующим образом:


(Отщепление бромид-иона и карбанионное перемещение происходят синхронно.)
Образовавшийся в результате перегруппировки алкилизоцианат затем гидролизуется:


6.4.4.6. Дегидратация амидов
Это ещё одно свойство амидов, связанное с большой подвижностью атомов водорода при азоте. В результате под действием фосфорного ангидрида происходит отщепление молекулы воды и образование другого производного кислоты — нитрила:

6.4.4.7. Нуклеофильное присоединение к нитрилам
Нитрилы карбоновых кислот вследствие строения их функциональной группы (гл. 6.4.2) должны вступать в реакции нуклеофильного присоединения (AdN) аналогично альдегидам. Среди наиболее распространённых примеров — реакции присоединения воды, спиртов, хлороводорода с образованием соответственно амидов кислот, иминоэфиров и хлориминов:

Присоединение воды возможно как в кислой, так и в щелочной среде. Механизм реакции:



Спирты присоединяются в кислой среде в отсутствие воды. Механизм реакции:

