
- •Глава 1. Основы теоретических представлений в органической химии
- •1.1. Учение а.М. Бутлерова
- •1.2. Теория гибридизации атомных орбиталей
- •1.3. Ковалентная связь
- •1.3.3. Водородные связи
- •1.4. Теория электронных смещений
- •1.5. Классификация и номенклатура органических соединений
- •1.5.1. Заместительная номенклатура
- •1.5.2. Радикало-функциональная номенклатура
- •1.5.4. Рациональная Номенклатура
- •1.6. Представление о Кислотно-оснÓвных свойствах органических соединений
- •1.7. Основы стереохимии
- •1.7.1. Оптическая изомерия
- •1.7.2. Геометрическая изомерия
- •1.7.3. Конформационная изомерия
- •1.8. Классификация органических реакций. Понятие о механизме реакций. Растворители и катализаторы
- •1.9. Методы идентификации органических соединений. Основные физические константы
- •1.10. Методы разделения и очистки органических веществ
- •1.10.1. Разделение твёрдых смесей и очистка твёрдых веществ
- •1.10.2. Разделение жидких смесей и очистка жидкостей
- •1.11. Представление о биологическом действии и метаболизме органических соединений
- •Глава 2. Алканы
- •2.1. Номенклатура. Изомерия
- •2.2. Строение
- •2.3. Физические свойства
- •2.4. Химические свойства
- •2.4.1. Реакции радикального замещения
- •2.4.2. Реакции дегидрирования и разложения
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •2.6. Применение и физиологическая роль
- •Глава 3. Функциональные производные алканов
- •3.1. ОбщноСть Химических свойств
- •3.1.1. Реакции нуклеофильного замещения
- •3.1.2. Реакции отщепления (элиминирования)
- •3.2. Галогеналканы
- •3.2.1. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •3.2.3. Способы получения
- •3.2.4. Полигалогеналканы
- •3.2.5. Физиологическая роль и Важнейшие представители
- •3.3. Насыщенные спирты
- •3.3.1. Классификация, номенклатура, изомерия
- •3.3.2. Строение и физические свойства
- •3.3.3. Химические свойства
- •3.3.4. Способы получения
- •3.3.5. Многоатомные спирты
- •3.3.6. Физиологическое действие
- •3.3.7. Важнейшие представители
- •3.4. Простые насыщенные эфиры
- •3.4.1. Номенклатура и изомерия
- •3.4.2. Физические и химические свойства
- •3.4.3. Способы получения
- •3.4.4. Циклические простые эфиры
- •3.4.5. Физиологическая роль и Важнейшие представители
- •3.5. Эфиры минеральных кислот
- •3.5.1. Эфиры серной кислоты
- •3.5.2. Эфиры фосфорной кислоты
- •3.6. Тиоспирты и тиоэфиры
- •3.7. Насыщенные амины
- •3.7.1. Классификация, номенклатура, изомерия
- •3.7.2. Физические свойства
- •3.7.3. Строение и химические свойства
- •3.7.4. Способы получения
- •3.7.5. Физиологическая роль и Важнейшие представители
- •3.8. Нитроалканы
- •3.8.1. Строение
- •3.8.2. Свойства
- •3.8.3. Способы получения
- •3.8.4. Физиологическое действие и Важнейшие представители
- •3.9. Кремний-, фосфор- и мышьякорганические соединения
- •3.9.1. Кремнийорганические соединения
- •3.9.2. Фосфорорганические соединения
- •3.9.3. Мышьякорганические соединения
- •Глава 4. Непредельные углеводороды
- •4.1. ОБщность строения и химических свойств
- •4.1.1. Реакции электрофильного присоединения
- •4.1.2. Реакции радикального присоединения
- •4.1.3. Реакции радикального замещения
- •4.1.4. Другие реакции
- •4.2. Этиленовые углеводороды
- •4.2.1. Номенклатура, изомерия
- •4.2.2. Физические свойства
- •4.2.3. Химические свойства
- •4.2.4. Способы получения
- •4.2.5. Физиологическое действие и Важнейшие представители
- •4.3. Диеновые (и полиеновые) углеводороды
- •4.3.1. Классификация, номенклатура
- •4.3.5. Способы получения
- •4.3.6. Важнейшие представители
- •4.4. Ацетиленовые углеводороды
- •4.4.1. Номенклатура, изомерия
- •4.4.2. Особенности строения и свойств
- •4.4.3. Способы получения
- •4.4.4. Физиологическое действие и Важнейшие представители
- •Глава 5. Функциональные производные непредельнЫх углеводороДов
- •5.1. ОБщность строения и химических свойств
- •5.1.1. Классификация
- •5.1.2. Субстраты винильного типа
- •5.1.3. Субстраты аллильного типа
- •5.2. Галогеналкены
- •5.2.1. Винилгалогениды
- •5.2.2. Аллилгалогениды
- •5.2.3. Способы получения
- •5.2.4. Важнейшие представители
- •5.3. Непредельные спирты и эфиры
- •5.3.1. Виниловый спирт и его эфиры
- •5.3.2. Аллиловый и пропаргиловый спирты
- •5.3.3. Способы получения
- •5.3.4. Важнейшие представители
- •Глава 6. Алифатические альдегиды, кетоны и карбоновые кислоты
- •6.1. Насыщенные альдегиды и кетоны
- •6.1.1. Изомерия, номенклатура
- •6.1.2. Строение карбонильной группы
- •6.1.3. Физические свойства
- •6.1.4. Химические свойства
- •6.1.5. Способы получения
- •6.1.6. Физиологическая роль
- •6.1.7. Важнейшие представители
- •6.2. Непредельные альдегиды и кетоны
- •6.2.1. Кетен
- •6.2.2. Непредельные карбонильные соединения
- •Примерами соединений с сопряжёнными -связями являются
- •6.2.3. Важнейшие представители
- •6.3. Дикарбонильные соединения
- •6.3.3. Важнейшие представители
- •6.4. Насыщенные монокарбоновые кислоты и их производные
- •6.4.1. Номенклатура
- •6.4.2. Строение функциональной группы
- •6.4.3. Физические свойства
- •6.4.4. Химические свойства
- •6.4.5. Способы получения
- •6.4.6. Пероксикарбоновые кислоты и ацилпероксиды
- •6.4.7. Физиологическая роль и Важнейшие представители
- •6.5. Непредельные монокарбоновые кислоты
- •6.5.1. Номенклатура, изомерия
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •6.5.4. Способы получения
- •6.5.5. Физиологическая роль и Важнейшие представители
- •6.5.6. Омыляемые липиды
- •6.6. Дикарбоновые кислоты и их производные
- •6.6.1. Особенности химического поведения
- •6.6.2. Малоновый эфир и синтезы на его основе
- •2 H5c2ooc-ch2-cooc2h5
- •2 H5c2ooc-ch2-cooc2h5
- •6.6.3. Способы получения
- •2 Rooc-(ch2)n-сoo¯ 2 rooc-(ch2)n-сoo rooc-(ch2)2n-coor hooc-(ch2)2n-cooh
- •6.6.4. Важнейшие представители
- •6.7. Гидроксикислоты
- •6.7.1. Классификация, номенклатура, изомерия
- •6.7.2. Химические свойства
- •6.7.3. Способы получения
- •6.7.4. Физиологическая роль и Важнейшие представители
- •6.8. Оксокислоты
- •6.8.1. Особенности химического поведения
- •6.8.2. Ацетоуксусный эфир и синтезы на его основе
- •6.8.3. Способы получения
- •6.8.4. Важнейшие представители
- •6.9. Аминокарбоновые кислоты. Пептиды
- •6.9.1. Классификация, номенклатура, изомерия аминокислот
- •6.9.2. Строение, физические и Химические свойства
- •6.9.3. Способы получения аминокислот
- •6.9.4. Важнейшие представители аминокислот
- •6.9.5. Пептиды
- •Глава 7. Углеводы
- •7.1. Моносахариды
- •7.1.1. Изомерия, номенклатура
- •7.1.2. Химические свойства
- •7.1.3. Важнейшие представители моносахаридов и их производных
- •7.2. Олигосахариды
- •7.2.1. Классификация и номенклатура дисахаридов
- •7.2.2. Химические свойства дисахаридов
- •7.2.3. Важнейшие представители дисахаридов
- •7.3. Полисахариды
- •7.3.1. Целлюлоза
- •7.3.2. Амилоза и амилопектин
- •7.3.3. Гликоген
- •7.3.4. Декстраны
- •7.3.5. Хитин
- •7.3.6. Пектовая кислота
- •7.3.7. Гетерополисахариды
- •Глава 8. Алициклические углеводороды и их производные
- •8.1. Номенклатура моно- и бициклических соединений
- •8.2. Пространственное строение и изомерия циклоалканов
- •8.2.1. Циклопропан
- •8.2.2. Циклобутан
- •8.2.3. Циклопентан
- •8.2.4. Циклогексан
- •8.3. Химические свойства
- •8.3.1. Реакции циклопропана, циклопропена и их производных
- •8.3.2. Реакции циклобутана и его производных
- •8.3.3. Реакции средних циклов
- •8.3.4. Реакции изомеризации цикла
- •8.4. Способы получения циклоалканов
- •8.5. Терпены и терпеноиды. Каротиноиды
- •8.5.1. Ациклические терпены и терпеноиды
- •8.5.2. Моноциклические терпены и терпеноиды
- •8.5.3. Бициклические терпены и терпеноиды
- •8.5.4. Каротиноиды
- •8.6. Физиологическая роль и важнейшие представители
- •8.7. Стероиды
- •Глава 9. Бензол. Ароматичность. Углеводороды ряда бензола
- •9.1. Строение бензола
- •Тепловой эффект реакции гидрирования бензола составляет
- •9.2. Номенклатура и изомерия аренов
- •9.3. Строение аренов
- •9.3.1. Строение толуола
- •9.3.2. Строение винилбензола
- •9.4. Физические свойства
- •9.5. Химические Свойства
- •9.5.1. Химические свойства бензола
- •9.5.2. Химические свойства аренов
- •9.6. Способы получения
- •9.7. Физиологическое действие и важнейшие представители аренов
- •9.8. Небензоидные ароматические системы
- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.10. Физиологическая роль функциональных производных бензола
- •Глава 11. Полициклические ароматические углеводороды и их производные
- •11.1. Классификация углеводородов с конденсированными циклами
- •11.2. Нафталин
- •11.2.1. Строение, изомерия, номенклатура
- •11.2.2. Свойства
- •11.2.3. Способы получения
- •11.2.4. Важнейшие представители
- •11.3. Антрацен
- •11.3.1. Строение, изомерия, номенклатура
- •11.3.2. Свойства
- •Продукт исчерпывающего гидрирования (пергидроантрацен) можно получить, проводя реакцию в жёстких условиях с применением металлических катализаторов.
- •11.3.3. Способы получения
- •11.3.4. Важнейшие представители
- •11.4. Фенантрен
- •11.4.1. Строение, изомерия, номенклатура
- •11.4.2. Свойства
- •11.4.3. Способы получения
- •11.5. Физиологическое действие полициклических углеводородов
- •Глава 12. Гетероциклические соединения
- •12.1. Классификация и номенклатура
- •12.2. Пятичленные гетероциклические
- •12.2.1. Номенклатура пиррола, фурана и тиофена и их производных
- •12.2.2. Строение пиррола, фурана и тиофена
- •12.2.3. Физические и химические свойства пиррола, фурана и тиофена
- •12.2.4. Особенности индола
- •12.2.5. Способы получения пиррола, фурана, тиофена, индола
- •12.2.6. Важнейшие представители и медико-биологическое значение
- •12.3. Пятичленные гетероциклические
- •12.3.1. Номенклатура имидазола и пиразола
- •12.3.2. Строение имидазола и пиразола
- •12.3.3. Физические и химические свойства имидазола и пиразола
- •12.3.4. Способы получения
- •12.3.5. Важнейшие представители и медико-биологическое значение
- •12.4. Шестичленные гетероциклические
- •12.4.1. Номенклатура пиридина и его производных
- •12.4.2. Строение пиридина
- •12.4.3. Химические свойства пиридина
- •Но если оба -положения заняты, то замещается водород в-положении. При нагревании с избытком амида натрия можно получить 2,6-диаминопиридин.
- •12.4.4. Особенности химического поведения пиколинов и функциональных производных пиридина
- •12.4.5. Хинолин и изохинолин
- •12.4.7. Способы получения
- •Реакция аналогична получению бензола, протекает при высоких температурах, но представляет только теоретический интерес.
- •12.4.8. Важнейшие представители и медико-биологическое значение
- •12.5. Шестичленные гетероциклические
- •12.5.1. Строение и свойства диазинов
- •12.5.2. Пурин
- •12.5.3. Способы получения
- •12.5.4. Важнейшие представители и медико-биологическое значение
- •12.5.5. Нуклеозиды, нуклеотиды и нуклеиновые кислоты
- •12.6. Алкалоиды
12.4. Шестичленные гетероциклические
соединения с одним гетероатомом
Шестичленные гетероциклические соединения также могут содержать атомы азота, кислорода и серы. Но наиболее важны в практическом отношении азотосодержащие гетероциклы — пиридин, его производные и конденсированные соединения на их основе. Широко распространены также гетероциклические соединения на основе пиранов — циклов, содержащих атом кислорода.

пиридин -пиран-пиран

хинолин изохинолин акридин
12.4.1. Номенклатура пиридина и его производных
Систематическое название пиридина — азин (гл. 12.1). Однако как для самого гетероцикла, так и для его производных почти всегда используется тривиальное название «пиридин».
Атомы цикла могут быть обозначены цифровыми локантами или же греческими буквами. Соответственно, возможны три радикала пиридина:

-пиридил-пиридил-пиридил
(пиридил-2) (пиридил-3) (пиридил-4)
Метилпроизводные пиридина имеют тривиальное название «пиколины», диметилпроизводные — «лутидины», например:

-пиколин-пиколин 2,6-лутидин
(2-метилпиридин) (3-метилпиридин) (2,6-диметилпиридин)
-, - и -пиридинкарбоновые кислоты имеют каждая своё тривиальное название:

пиколиновая кислота никотиновая кислота изоникотиновая кислота
(пиридин-2-карбоновая (пиридин-3-карбоновая (пиридин-4-карбоновая
кислота) кислота) кислота)
12.4.2. Строение пиридина
Молекула пиридина, как и молекула бензола, представляет собой плоский шестиугольник, содержащий сопряжённую -электронную систему, удовлетворяющую всем критериям ароматичности, в том числе и правилу Хюккеля (6 -электронов). Однако пиридиновый цикл содержит атом азота вместо одного из атомов углерода бензольного кольца. Ввиду большей электроотрицательности азота по сравнению с углеродом валентные углы и длины связей в молекуле пиридина несколько искажены по сравнению с бензолом. Энергия делокализации ароматической системы пиридинового кольца составляет 117 кДж/моль (против 151 кДж/моль для бензола).
Атом азота находится в состоянии sp2-гибридизации; его 3 валентных электрона участвуют в образовании двух -связей и -электронной сопряжённой системы ароматического кольца. А его неподелённая электронная пара находится на sp2-гибридной орбитали, ось которой лежит в плоскости гетероцикла, и потому эти электроны не могут участвовать в сопряжении с -электронной системой кольца.

Атом азота в целом является электроноакцептором, понижая электронную плотность на атомах углерода кольца. Он проявляет –I-эффект и, участвуя в сопряжении, –М-эффект. В связи с этим распределение -электронной плотности в ароматическом кольце можно показать с помощью граничных структур:
 ,
,
из которых следует, что наибольшие эффективные положительные заряды, вызванные акцепторным влиянием атома азота, создаются в - и -положениях, причём акцепторное влияние азота на -атомы сильнее по причине индуктивного эффекта.
12.4.3. Химические свойства пиридина
Химические свойства пиридина, как следует из его строения, должны быть достаточно многообразны. Это и реакции непосредственно по атому азота (основные свойства, реакции алкилирования, окисления), и реакции с участием ароматического кольца (электрофильное и нуклеофильное замещение, гидрирование).
12.4.3.1. Основность
Пиридин является типичным основанием с рКb = 8.8. Его основность ниже основности аммиака и алифатических аминов, так как неподелённая электронная пара пиридинового азота, за счёт которой происходит взаимодействие с протоном, находится на sp2-гибридной орбитали. Электронная же пара аминного атома азота находится на sp3-гибридной орбитали, поэтому более удалена от ядра и легче взаимодействует с протоном (рКb аммиака равна 4.8, метиламина — 2.3).
С другой стороны, основность пиридина выше основности анилина и ароматических аминов (рКb анилина = 9.4). В молекуле анилина, как и других ароматических аминов, неподелённая электронная пара азота участвует в сопряжении с ароматическим кольцом и делокализована, а в молекуле пиридина пара электронов принадлежит только атому азота.
Основные свойства пиридина проявляются как при взаимодействии с кислотами, так и при взаимодействии с водой:

хлорид пиридиния

гидроксид пиридиния
12.4.3.2. Реакции алкилирования по атому азота
Неподелённая электронная пара азота энергетически более доступна для атаки электрофильными агентами, чем сопряжённая система ароматического кольца. Однако только с алкилирующими агентами атом азота образует устойчивые продукты взаимодействия. Реакции между пиридином и галогеналканами протекают легко:

йодид N-алкилпиридиния
По механизму эти реакции — типичные примеры нуклеофильного замещения, в которых пиридин является нуклеофилом.
Но при нагревании продукт алкилирования по азоту претерпевает перегруппировку, протекающую по радикальному механизму, с выбросом галогеноводорода. Результатом этого является образование - и -алкилпиридинов:

12.4.3.3. Реакции электрофильного замещения
В молекуле пиридина имеются два реакционных центра для электрофильной атаки, и, как было сказано выше, легче она должна осуществляться по атому азота. Действительно, большинство электрофилов на первой стадии атакует атом азота, а затем происходит перегруппировка с образованием более прочных связей электрофильных частиц с атомами углерода кольца. При этом электрофильное замещение всегда протекает по -углеродному атому в отсутствие других ориентирующих групп, так как - и -атомы дезактивированы электроноакцепторным влиянием атома азота (см. выше). В целом электрофильное замещение в цикле пиридина протекает в жёстких условиях (при температурах около 500—570 К). Одним из примеров является реакция хлорирования, которая без катализатора протекает при 470 К, а в присутствии хлорида алюминия — при 370 К. Образование связи C–Cl здесь происходит при действии избытка хлорирующего агента:

-хлорпиридин
Проведение хлорирования при более высокой температуре (500 К) приводит к смене механизма, в результате чего вместо SE-реакции протекает радикальное замещение (SR) и образуются продукты -замещения:

-хлорпиридин 2,6-дихлорпиридин
Для проведения электрофильного бромирования требуется использование раствора брома в олеуме при 400 К:

-бромпиридин
Проведение бромирования без растворителя при более высокой температуре (770 К) также приводит к смене механизма реакции, в результате протекает радикальное замещение:

-бромпиридин
Реакции нитрования и сульфирования протекают в сильнокислой среде, поэтому первой стадией этих процессов является протонирование с образованием катиона пиридиния, что в свою очередь ещё в большей степени замедляет электрофильное замещение.
При нитровании повышение температуры выше 570 К (640 К) приводит к смене механизма с SE на SR. При этом вместо -нитропиридина образуется преимущественно -производное:

Сульфирование пиридина при 630 К даёт -пиридинсульфокислоту, существующую преимущественно в виде внутренней соли:


Некоторые другие типичные реакции электрофильного замещения, например, реакции алкилирования и ацилирования по Фриделю–Крафтсу, вовсе не характерны для пиридина, но такие реакции невозможны и для производных бензола с сильными электроноакцепторными группами (например, для нитробензола).
12.4.3.4. Реакции нуклеофильного замещения
Наличие атома азота в ароматическом кольце пиридина существенно понижает -электронную плотность, и становится возможной нуклеофильная атака по атому углерода в -положении (и в меньшей степени в -положении). Тем не менее пиридин и его гомологи реагируют только с сильными нуклеофильными агентами.
Щёлочи реагируют с пиридином только при температуре около 670 К с образованием -гидроксипиридина, который таутомеризуется в -пиридон. Механизм реакции — SN2аром.:

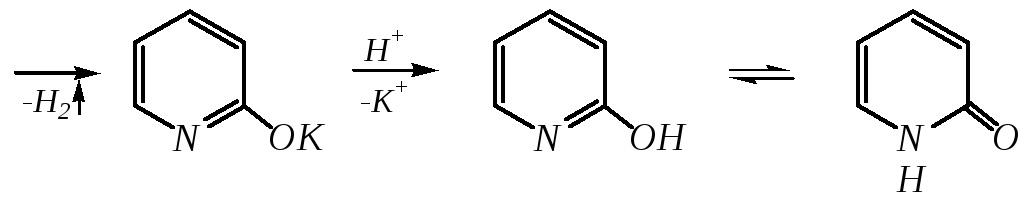
-гидроксипиридин-пиридон
Алкилирование и арилирование проводятся литийорганическими соединениями R-Li или Ar-Li при температуре 370 К. Эти реакции также селективно приводят к образованию -замещённых пиридинов. Например, взаимодействие с бутиллитием осуществляется по следующей схеме:


-бутилпиридин
Для отщепления гидрид-иона на стадии превращения -комплекса в продукты реакции может быть использовано окисление кислородом воздуха; тогда вместо гидрида лития образуется LiOH.
Аминирование пиридина и родственных гетероциклических соединений (реакция А.Е. Чичибабина*) осуществляется амидом натрия в апротонных растворителях при 370 К (или в жидком аммиаке при 240 К). Замещение осуществляется селективно в -положение.

