
- •Аналитическая химия
- •Часть 1
- •Isbn 985-466-015-х
- •Раздел 1
- •Глава 1
- •Разложение пробы
- •1.3. Виды анализа
- •Экстракционная фотометрия
- •Глава 2
- •2.1. Аналитические реакции
- •2.2. Систематический и дробный анализ
- •Комплексообразование
- •2.3. Общая характеристика, классификация и способы обнаружения катионов
- •2.4. Общая характеристика, классификация и способы обнаружения анионов
- •Глава 3
- •3.1. Общая характеристика химического равновесия. Константа химического равновесия
- •3.2. Активность и коэффициент активности
- •3.3. Отклонения от идеальности в растворах сильных электролитов
- •3.4. Виды констант химического равновесия, используемые в аналитической химии
- •3.5. Общие принципы расчёта состава равновесных систем
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.2. Количественное описание силы кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •4.5. Расчёт рН водных растворов различных прото- литов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Общая константа образования
- •5.4. Влияние различных факторов на комплексообразование в растворах
- •5.5. Применение органических реагентов в аналитической химии
- •Лиганды с одним типом донорных атомов о,о-лиганды
- •Шестичленные циклы
- •Органические реагенты
- •6.1. Произведение растворимости малорастворимого электролита
- •Глава 6
- •6.2. Растворимость
- •6.3. Влияние различных факторов на растворимость
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •7.1. Общая характеристика окислительно-восстановительных реакций
- •7.2. Количественная оценка окислительно-восстановительной способности веществ
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций
- •Глава 8
- •8.1. Отбор пробы
- •Анализируемым образец
- •I эмпирический
- •Генеральная проба
- •Лабораторная проба
- •8.2. Разложение пробы
- •9.1. Общая характеристика и классификация
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •Реэкстракт
- •Реэкстракция
- •Сложные эфиры фосфорной кислоты, фосфоновых, фосфиновых кислот, фосфиноксиды, сульфоксиды, диантипирилметан
- •Третичные амины, четвертичные аммониевые соли, соли тетрафениларсония и тетрафенилфосфония.
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •3 Значащие цифры
- •1 Значащая цифра
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.6. Пример статистической обработки результатов измерений. Исключение промахов
- •10.7. Основные характеристики методики анализа
- •Раздел 2
- •Глава 11
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12 общая характеристика титриметрических методов анализа
- •12.1. Основные понятия титриметрии
- •Исчезновение окраски фенолфталеина
- •Появление розовой окраски раствора
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием
- •Vисх_mрисх_m(hCl) _n(hCl) - m(hCl) _c(hCl) - V - m(hCl) _p _ra(hCl) -p_ ra(hCl) -p _p-ra(hCl)
- •Глава 13 кислотно-основное титрование
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •13.3. Кривые титрования
- •13.4. Факторы, влияющие на величину скачка титрования
- •0,1МNaOh (1), 0,001мhCl 0,001мNaOh (2) и или основания (рис. 13.4).
- •0,1МhCl 0,1мNaOh (3)Прямое титрование таких
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14 кислотно-основное титрование в неводных средах
- •14.3. Применение в фармацевтическом анализе
- •Глава 15 комплексометрическое титрование
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •Ind HgInd фиолетовый Ind жёлтыйHg[Fe(cn)sNo]
- •15.3. Комплексонометрическое титрование
- •Глава 16
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
- •18.1. Иодометрическое титрование
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •I" крахмал избыток NaNo2 i4
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
- •Раздел 3
- •Глава 19
- •19.1. Природа и свойства электромагнитного излучения
- •19.2. Классификация спектроскопических методов анализа
- •Глава 20
- •20.2. Отклонения от основного закона светопоглощения
- •20.3. Атомно-абсорбционная спектроскопия
- •20.4. Молекулярная абсорбционная спектроскопия в уф- и видимой области
- •Сурьмяно-цезиевый фотоэлемент кислородно-цезиевый фотоэлемент
- •20.4.3. Практическое применение и основные приёмы фотометрического анализа
- •Измерение светопоглощения хлороформного экстракта
- •Метод отношения пропусканий
- •Метод предельной точности
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ик-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •Глава 21 эмиссионные спектроскопические методы анализа
- •21.1. Атомно-эмиссионная спектроскопия
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •Пламенная фотометрия
- •3000-7000 °C невысокая воспроизводимостьтолько щелочные, щелочноземельные металлы и т.П.
- •Фотоэлементы, фотоумножители, фотодиоды
- •21.1.3. Практическое применение
- •20.2. Люминесцентная спектроскопия
- •20.2.1 Классификация видов люминесценции
- •21.2.2 Механизм молекулярной фотолюминесценции. Флуоресценция и фосфоресценция
- •21.2.3 Основные характеристики и закономерности люминесценции
- •21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
- •21.2.5. Измерение аналитического сигнала
- •21.2.6. Практическое применение и основные приёмы люминесцентного анализа
- •Рибофлавин офлоксацин
- •Глава 22 общая характеристика и теоретические основы хроматографических методов анализа
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •Агрегатное состояние подвижной фазы
- •22.3. Хроматографические параметры
- •22.4. Теории хроматографического разделения
- •Глава 23
- •Сорбент помещают внутрь колонки
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •Глава 24
- •Жидкостная хроматография
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •Ввод пробы
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •Сильнокислотные
- •24.4.2. Эксклюзионная хроматография
- •Глава 25 общая характеристика электрохимических методов анализа. Кондукгометрия
- •25.1. Основные понятия, связанные с электрохимическими методами анализа
- •25.2. Классификация электрохимических методов анализа
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •Глава 26 потенциометрический и кулонометрический методы анализа
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.3. Индикаторные электроды
- •Первичные ионоселективные электроды
- •Электроды с подвижными носителями
- •Имеют жидкую мембрану -
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •26.2.3. Кулонометрическое титрование
- •Глава 27 вольтамперометрический метод анализа
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •Максимум второго рода
- •Максимум первого рода
- •27.3. Некоторые современные разновидности вольт- амперометрии
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
Глава 4
ПРОТОЛИТИЧЕСКИЕ РАВНОВЕСИЯ
4.1. Важнейшие теории кислот и оснований
Первая научная теория кислотности была предложена в 1780-х годах А. Лавуазье. Согласно данной теории все кислоты должны были обязательно содержать атом кислорода, что и было отражено в названии этого элемента.
OXYGENIUM
«gennao» - рождаю
«oxys» - кислый
HCl
^
H+
+Cl-
NaOH ^Na+ + OH-
электролиты, при диссоциации которых в водном растворе в качестве катионов образуются только катионы водорода электролиты, при диссоциации которых в водном растворе в качестве анионов образуются только гидроксид-ионы
нейтрализация
(образование соли и воды)
нейтрализация ►
NaOH + HCl^ NaCl+ H2O NaOH+ CH3COOHг CH3COONa+ H2O
I гидролиз
слабый электролит
В 1923 году почти одновременно появились ещё 2 теории кислот и оснований. Автором первой были датский химик И.Н. Брёнстед и английский химик Т.М. Лоури, а второй - американский физикохимик RH. Льюис. Согласно теории Брёнстеда - Лоури, названной протоли- тической теорией кислот и оснований:
не существует в растворе в свободном виде, а связывается с молекулами растворителя
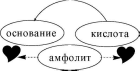
Кислоты, основания и амфолиты могут быть как электронейтральными, так и иметь заряд.
HCl,
CH3COOH
кислоты
NH4 ,[Al(H2O)6]J
2-
CO
NH3
HCO3
амфолиты
2
4
Кислотно-основное взаимодействие заключается в обратимом переносе протона от кислоты к основанию. Кислоты и основания существуют как сопряжённые пары. В процессе взаимодействия друг с другом кислота и основание не исчезают, например, образуя соль, а превращаются в новое основание и новую кислоту.

сопряжённая
кислота
основание
Л
+i''
Cl
HCl
) + i NH3)
кислота
сопряжённое основание
(на)/' ci-)(nh4
V
сопряжённые кислотно-основные пары
NH3
■
^
>
J
Согласно теории Льюиса, названнойэлектронной теорией кислот и оснований
акцептор
электронной пары
донор
электронной пары![]()

основание![]()
нейтрализация (образование ковалентной связи по донорно-акцепторному механизму)
AlCl3+ Cl-г [AlCl4]-
Основания Брёнстеда и основания Льюиса представляют собой одни и те же соединения, понятие «кислота» согласно протолитической и электронной теориям отличается.
В аналитической химии преимущественно используется прото- литическая теория. Это связано с тем, что теория Льюиса имеет слишком общий характер и её трудно применить для количественных расчётов.
