
- •Медична хімія
- •Медична хімія Навчальний посібник
- •Кислотно-основна рівновага та комплексоутворення в біологічних рідинах заняття № 1
- •1. Тема: Вступ до практикуму. Техніка безпеки роботи в лабораторії.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Біогенні р-елементи: біологічна роль, застосування в медицині.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •9. Література.
- •1. Тема. Біогенні d-елементи : біологічна роль, застосування в медицині.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •9. Література.
- •1. Тема. Комплексоутворення в біологічних системах.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •9. Література.
- •Заняття № 5
- •1. Тема: Величини, що характеризують кількісний склад розчинів.
- •4. Основні базові знання, вміння і навички, необхідні
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття (самостійна позааудиторна робота студентів)
- •Задачі для самостійного розв’язування (самостійна позааудиторна робота студентів)
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 6
- •1. Тема: Приготування розчинів.
- •4. Основні базові знання, вміння і навички, необхідні
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 7
- •1. Тема: Основи титриметричного аналізу.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті
- •Заняття № 8.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •1. Тема. Кислотно-основна рівновага в організмі.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопіготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті
- •9. Література.
- •Заняття № 10.
- •1. Тема. Буферні системи, класифікація та механізм дії.
- •4. Основні базові знання, вміння і навички, необхідн для засвоєння теми.
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 11
- •1. Тема. Визначення буферної ємності. Роль буферів у біосистемах.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття (самостійна позааудиторна робота студентів).
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 12
- •1. Тема: Колігативні властивості розчинів.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •7. Завдання для самостійного опрацювання
- •Правильні відповіді
- •Задачі для самостійного розв’язування
- •Заняття № 13 Підсумковий контроль засвоєння модулю 1
- •Перелік питань до підсумкового контролю модулю 1. Хімія біогенних елементів. Комплексоутворення в біологічних рідинах.
- •Кислотно-основні рівноваги в біологічних рідинах.
- •Модуль 2. Рівноваги в біологічних системах на межі поділу фаз.
- •1. Тема. Теплові ефекти хімічних реакцій в розчинах.
- •4. Основні базові знання, вміння і навички, необхідні
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •1.Тема. Кінетика біохімічних реакцій.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Кінетика біохімічних реакцій.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 4.
- •1. Тема. Хімічна рівновага. Добуток розчинності.
- •4. Основні базові знання, вміння, навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Визначення окисно-відновного потенціалу.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Сорбція біологічно-активних речовин на межі поділу фаз.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 7
- •1.Тема. Іонний обмін. Хроматографія.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Одержання, очистка та властивості колоїдних розчинів.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Коагуляція колоїдних розчинів.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 10
- •1. Тема. Колоїдний захист.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 11
- •1. Тема. Властивості розчинів біополімерів. Ізоелектрична точка білка.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 12 Підсумковий контроль засвоєння модулю 2
- •Термодинамічні та кінетичні закономірності перебігу процесів та електрокінетичні явища в біологічних системах.
- •Фізико-хімія поверхневих явищ. Ліофобні та ліофільні дисперсні системи.
- •Методичні вказівки для позааудиторної самостійної роботи студентів з тем, що винесені на самостійне опрацювання.
- •1. Тема. Добуток розчинності. Умови утворення та розчинення осадів.
- •4. Opiєhtobha картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Tемa. Розчини. Розрахунки в титриметричному аналізі.
- •3. Орієнтовна картка для самостійного опрацювання
- •4. Задачі для самостійного розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •5. Література.
- •1. Тема. Окисно-відновне титрування (оксидиметрія).
- •4. Орієнтовна картка для самостійного опрацювання
- •5. Питання для самостійного опрацювання
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Оксидиметрія. Метод йодометрії.
- •4. Opієhtовha картka для самостійного опрацювання
- •5. Питання для самостійного опрацювання
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література
- •1. Тема. Період напівперетворення. Фотохімічні реакції. Фотосинтез.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Особливості кінетики ферментативних процесів.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Гальванічні кола.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Аерозолі, суспензії, емульсії. Порошки, пасти, креми.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Напівколоїдні мила, детергенти.
- •4. Оріентовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Драглювання розчинів вмс. Механізм драглювання. Тиксотропія. Синерезис. Біологічна роль драглювання. Висолювання біополімерів із розчинів. Коацервація та її роль у біологічних системах.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Аномальна вязкість розчинів вмс. Вязкість крові.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді.
- •6. Питання для контролю знань.
- •7. Література.
- •Заняття № 1. Вступ до практикуму. Техніка безпеки роботи в лабораторії.
- •Заняття № 7. Іонний обмін. Хроматографія………………………………………………... 87
- •Заняття № 11. Властивості розчинів біополімерів. Ізоелектрична точка білка…………. 104. Заняття № 12. Підсумковий контроль засвоєння модулю 2
4. Основні базові знання, вміння і навички, необхідні
ДЛЯ ЗАСВОЄННЯ ТЕМИ.
І) Основні величини, що характеризують склад розчинів.
2) Формули для обчислення концентрації розчину.
3) Зважування на технохімічних та аналітичних терезах.
(Матеріал шкільної програми та попереднього заняття з хімії)
5. Граф логічної структури


 Теорія розчинів
Приготування розчинів
Теорія розчинів
Приготування розчинів

Сольватна Термодинаміка По разрахованій З фіксаналів
 теорія розчинів
наважці
теорія розчинів
наважці
розчинів
Розчинність розчинів масових розчинів об’ємних
 концентрацій концентрацій
концентрацій концентрацій
газів рідин твердих речовин
6. Орієнтовна картка для самопідготовки до заняття
(для самостійної позааудиторної роботи студентів)
|
Зміст і послідовність дій |
Вказівки до навчальних дій |
|
1.Теорія розчинів. |
1.1 Сольватна теорія розчинів. 1.2 Термодинаміка процесу розчинення. |
|
2. Розчинність газів, рідин та твердих речовин. |
2.1. Залежність розчинності газів від тиску (закон Генрі-Дальтона), їх природи, температури. 2.2. Вплив електролітів на розчинність газів (закон Сеченова), кесонна хвороба. 2.3. Розчинність рідин та твердих речовин. Закон розподілу Нернста та його значення для пояснення проникності біологічних мембран. |
|
3. Приготування розчинів заданого складу. |
3.1. Приготування розчинів із фіксаналів. 3.2. Приготування розчинів по розрахованій наважці. |
7. Питання для самостійного опрацювання
(самостійна позааудиторна робота студентів)
1) Чому при розчиненні нітрату амонію у воді розчин має нижчу температуру, ніж повітря, а при розчиненні сірчаної кислоти – набагато більшу?
2) Чим відрізняється склад водного розчину цукру від водного розчину хлориду натрію?
3) Чому водолаз з великих глибин повинен підніматися поступово, повільно, а не швидко?
4) Уведення в організм людини 3×10-9 кг адреналіну (Мr = 183,2) викликає збільшення частоти пульсу. Розрахувати діючу в цьому випадку концентрацію адреналіну в організмі, припустивши, що людина масою 70 кг має 5 л крові.
5) Для визначення калію в слині методом полуменевоі фотометрії потрібно приготувати 0,25 л розчину, що містить 0,04 ммоль/л катіону калію та 0,64 ммоль/л катіону натрію.
Як приготувати такий розчин з розчину (І) хлориду калію (С1(К+) = 1ммоль/л) та розчину (2) хлориду натрію (С2(Nа+) = 2 ммоль/л) ?
6) Який об’єм розчину з масовою часткою сірчаної кислоти 9,3% (густина 1,06 кг/л) необхідно взяти для приготування 0,05 л розчину з молярною концентрацією еквівалента сірчаної кислоти 0,35 моль/л?
Правильні відповіді
1) Згідно з теорією розчинів, при розчиненні мають місце два процеси: руйнування, розклад первинної структури (кристалічної, аморфної, надмолекулярної) та побудова сольватів - утворень продуктів розпаду з молекулами розчинника (для води такі утворення називаються гідратами). Перший процес є ендотермічним, тобто проходить з поглинанням енергії, а другий - екзотермічний (проходить з виділенням енергії). Розчинення нітрату амонію супроводжується зниженням температури. Це означає, що руйнування кристалічної структури потребує більше енергії, ніж виділяється при утворенні гідратів. А при розчиненні сірчаної кислоти, навпаки, виділяється набагато більше енергії при утворенні гідратів, ніж у першому процесі.
2) Згідно з теорією, обидва розчини складаються з молекул і асоціатів води та гідратів молекул цукру (розчин цукру) і гідратів катіонів натрію, хлорид-іонів (розчин хлориду натрію). Розчин цукру не містить гідратованих іонів, а в розчині солі немає гідратованих молекул.
3) Якщо водолаз працює на значній глибині, то розчинність азоту повітря, яким він дихає, у нього в крові зростає. Це пов'язано з тим. що із збільшен-ням глибини підвищується і тиск. А, як відомо, розчинність газів із підвищенням тиску зростає. Коли водолаза піднімати на поверхню без необхідної поступовості, то азот починає виділятися з такою швидкістю, що може викликати розрив судин або їх закупорювання. У літературі наведені випадки загибелі водолазів від кесонної хвороби.
4) Вміст адреналіну в крові людини визначається в ммоль/л.
![]() n
– кількість
речовини
n
– кількість
речовини
адреналіну, ммоль. m – маса адреналіну, кг;
М – молярна маса адреналіну, кг/кмоль;
106 – перехідний коефіцієнт від кмоль до ммоль
![]()
На
одиницю маси людини концентрація
адреналіну складає:
![]()
W (адреналіну) = 4,3×10-9%
У позасистемних одиницях концентрація адреналіну має такі значення:
0,43×10 -10 кг/кг × 10-1×10-6 = 4,3×10-6 мг% або 4,3×10-3 мкг%.
5) Визначаємо кількість речовини катіонів калію та натрію у 0,25 л розчину:
n(K+) = C(K+)×V = 0,04×0,25 = 0,01 ммоль
n(Na+) = C(Na+)×V = 0,64×0,25 = 0,16 ммоль
Визначаємо об’єми розчинів (1) та (2):
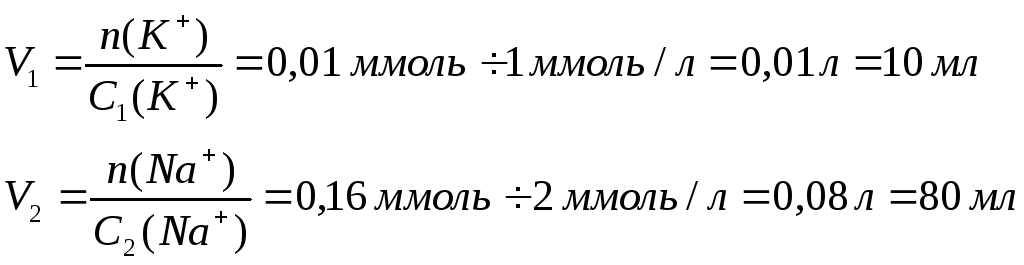
Для приготування 0,25 л потрібного розчину необхідно відібрати піпеткою 10 мл розчину (1) та 80 мл розчину (2), перенести ці об’єми у мірну колбу місткістю 0,25 л, довести рівень розчину дистильованою водою до риски. Готовий розчин перемішати.
6) Визначаємо кількість речовини еквівалента кислоти, що містить розчин, який треба приготувати:
n(1/2H2SO4) = C(1/2H2SO4)×V = 0,35 × 0,05 = 0,0175 моль
Визначаємо масу кислоти:
m(H2SO4) = n(1/2H2SO4) × M(1/2H2SO4) = 0,0175× 49 = 0,8575 г
Визначаємо масу розчину кислоти, який необхідно взяти для приготування заданого розчину:
![]()
Розраховуємо об’єм цього розчину:
![]()
Отже: для приготування 0,05 л розчину з молярною концентрацією еквівалента сірчаної кислоти 0,35 моль/л треба взяти 8,7 мл (піпеткою) розчину сірчаної кислоти з масовою часткою 9,3%, перенести в мірну колбу місткістю 50 мл та довести об’єм розчину у колбі дистильованою водою до риски.
