
- •Медична хімія
- •Медична хімія Навчальний посібник
- •Кислотно-основна рівновага та комплексоутворення в біологічних рідинах заняття № 1
- •1. Тема: Вступ до практикуму. Техніка безпеки роботи в лабораторії.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Біогенні р-елементи: біологічна роль, застосування в медицині.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •9. Література.
- •1. Тема. Біогенні d-елементи : біологічна роль, застосування в медицині.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •9. Література.
- •1. Тема. Комплексоутворення в біологічних системах.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •9. Література.
- •Заняття № 5
- •1. Тема: Величини, що характеризують кількісний склад розчинів.
- •4. Основні базові знання, вміння і навички, необхідні
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття (самостійна позааудиторна робота студентів)
- •Задачі для самостійного розв’язування (самостійна позааудиторна робота студентів)
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 6
- •1. Тема: Приготування розчинів.
- •4. Основні базові знання, вміння і навички, необхідні
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 7
- •1. Тема: Основи титриметричного аналізу.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті
- •Заняття № 8.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •1. Тема. Кислотно-основна рівновага в організмі.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопіготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті
- •9. Література.
- •Заняття № 10.
- •1. Тема. Буферні системи, класифікація та механізм дії.
- •4. Основні базові знання, вміння і навички, необхідн для засвоєння теми.
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 11
- •1. Тема. Визначення буферної ємності. Роль буферів у біосистемах.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття (самостійна позааудиторна робота студентів).
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 12
- •1. Тема: Колігативні властивості розчинів.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •7. Завдання для самостійного опрацювання
- •Правильні відповіді
- •Задачі для самостійного розв’язування
- •Заняття № 13 Підсумковий контроль засвоєння модулю 1
- •Перелік питань до підсумкового контролю модулю 1. Хімія біогенних елементів. Комплексоутворення в біологічних рідинах.
- •Кислотно-основні рівноваги в біологічних рідинах.
- •Модуль 2. Рівноваги в біологічних системах на межі поділу фаз.
- •1. Тема. Теплові ефекти хімічних реакцій в розчинах.
- •4. Основні базові знання, вміння і навички, необхідні
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •1.Тема. Кінетика біохімічних реакцій.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Кінетика біохімічних реакцій.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 4.
- •1. Тема. Хімічна рівновага. Добуток розчинності.
- •4. Основні базові знання, вміння, навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Визначення окисно-відновного потенціалу.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Сорбція біологічно-активних речовин на межі поділу фаз.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 7
- •1.Тема. Іонний обмін. Хроматографія.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Одержання, очистка та властивості колоїдних розчинів.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Коагуляція колоїдних розчинів.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 10
- •1. Тема. Колоїдний захист.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 11
- •1. Тема. Властивості розчинів біополімерів. Ізоелектрична точка білка.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 12 Підсумковий контроль засвоєння модулю 2
- •Термодинамічні та кінетичні закономірності перебігу процесів та електрокінетичні явища в біологічних системах.
- •Фізико-хімія поверхневих явищ. Ліофобні та ліофільні дисперсні системи.
- •Методичні вказівки для позааудиторної самостійної роботи студентів з тем, що винесені на самостійне опрацювання.
- •1. Тема. Добуток розчинності. Умови утворення та розчинення осадів.
- •4. Opiєhtobha картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Tемa. Розчини. Розрахунки в титриметричному аналізі.
- •3. Орієнтовна картка для самостійного опрацювання
- •4. Задачі для самостійного розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •5. Література.
- •1. Тема. Окисно-відновне титрування (оксидиметрія).
- •4. Орієнтовна картка для самостійного опрацювання
- •5. Питання для самостійного опрацювання
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Оксидиметрія. Метод йодометрії.
- •4. Opієhtовha картka для самостійного опрацювання
- •5. Питання для самостійного опрацювання
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література
- •1. Тема. Період напівперетворення. Фотохімічні реакції. Фотосинтез.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Особливості кінетики ферментативних процесів.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Гальванічні кола.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Аерозолі, суспензії, емульсії. Порошки, пасти, креми.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Напівколоїдні мила, детергенти.
- •4. Оріентовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Драглювання розчинів вмс. Механізм драглювання. Тиксотропія. Синерезис. Біологічна роль драглювання. Висолювання біополімерів із розчинів. Коацервація та її роль у біологічних системах.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Аномальна вязкість розчинів вмс. Вязкість крові.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді.
- •6. Питання для контролю знань.
- •7. Література.
- •Заняття № 1. Вступ до практикуму. Техніка безпеки роботи в лабораторії.
- •Заняття № 7. Іонний обмін. Хроматографія………………………………………………... 87
- •Заняття № 11. Властивості розчинів біополімерів. Ізоелектрична точка білка…………. 104. Заняття № 12. Підсумковий контроль засвоєння модулю 2
Задачі для самостійного розв’язування
(самостійна позааудиторна робота студентів)
Задача № 1
Розчин, що містить у 500 мл води 18 г розчиненої речовини, має осмотичний тиск при 0°С 0,0456 MПа. Розрахувати молярну масу розчиненої речовини.
Задача № 2.
Визначити температуру замерзання розчину, що має 1 моль сечовини на кожний кілограм води.
Задача № 3.
Температура замерзання розчину, що містить 1,7 г хлориду цинку
в 0,25 л води, дорівнює -0,23°С.
Визначити ізотонічний коефіцієнт такого розчину.
Задача № 4.
Осмотичний тиск плазми крові людини при 37°С складав 0,77 МПа. Яку масу сахарози треба взяти для приготування 0,5 л розчину, ізотонічного крові?
8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ.
8.1.Визначення осмотичного тиску.
Зібрати прилад для спостерігання явища осмосу - найпростіший осмометр (мал.1). Він складається із посудини з дистильованою водою (1) і зануреної у неї склянки (2). Дном склянки (2) є напівпроникна мембрана - целофанова плівка (3). У верхній отвір склянки (2) вставляється пробка з капіляром (4). Склянку (2) з капіляром (4) заповнити розчином сахарози з концентрацією 1,5 моль/л, забарвленим для кращого спостерігання у червоний колір. Заповнену склянку (2) занурити у посудину (1) таким чином, щоб рівні розчину в капілярі і води в посудині були однаковими.
В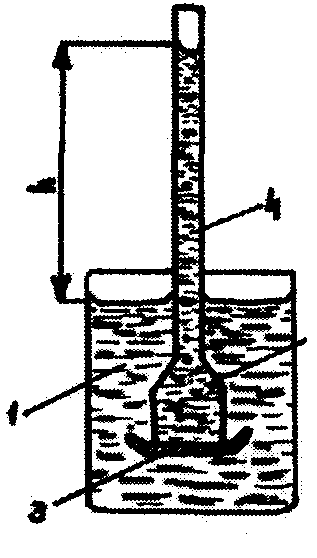 наслідок
осмосу рівень розчину у капілярі почне
підніматися і зупиниться при встановленні
динамічної рівноваги (коли швидкість
переходу води з посудини (1) у склянку
(2) і навпаки стануть рівними). Стовп
рідини у капілярі створить додатковий
гідростатичний тиск. Після цього виміряти
висоту стовпа рідини у капілярі (h
) відносно рівня дистильованої води у
посудині.
наслідок
осмосу рівень розчину у капілярі почне
підніматися і зупиниться при встановленні
динамічної рівноваги (коли швидкість
переходу води з посудини (1) у склянку
(2) і навпаки стануть рівними). Стовп
рідини у капілярі створить додатковий
гідростатичний тиск. Після цього виміряти
висоту стовпа рідини у капілярі (h
) відносно рівня дистильованої води у
посудині.
Розрахувати величину осмотичного тиску, враховуючи, що вона дорівнює гідростатичному тиску стовпа рідини:
Pосм. = Pгідр. Pгідр= ρ × g × h, де:
ρ - густина розчину сахарози, кг/м3;
g - прискорення вільного падіння, м/с2;
h- висота стовпа рідини в капілярі, м.
Дані досліду занести в таблицю:
|
Концентрація розчину, С, моль/м3 |
ρ, кг/м3 |
g, м/c2 |
h, м |
Pосм , Па |
|
1,5 × 103 |
1,14 × 103 |
9,8 |
|
|
8.2.Спостерігання явищ гемолізу та плазмолізу еритроцитів.
У три пробірки внести послідовно по 2,0 мл розчину з масовою часткою хлориду натрію 0,9 та 10 % і 2 мл дистильованої води. У кожну пробірку додати по 2 краплі крові, перемішати скляною паличкою. Помістити на предметне скло по краплі розчину з кожної пробірки, накрити покривним склом. Під мікроскопом спостерігати зміну або збереження форми еритроцитів.
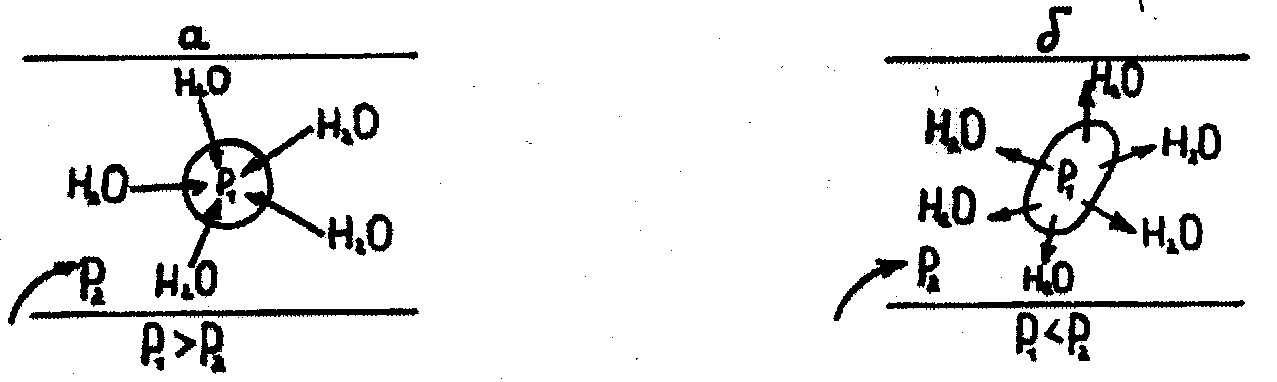
Визначити, яка схема відповідає гемолізу, а яка - плазмолізу еритроцитів та замалювати їх. Визначити, який розчин був гіпо-, гіпep- та ізотонічним крові.
8.3.Оформлення протоколу лабораторної роботи.
Замалювати у зошиті будову осмометра. Розрахувати величину осмотичного тиску та заповнити таблицю.
Замалювати схеми гемолізу та плазмолізу еритроцитів. Зробити висновок, який розчин був гіпо-, гіпep- та ізотонічним крові.
9. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с.
111-126.
2. Медицинская химия: учеб./ В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3.Садовничая Л.П., Хухрянский В.Г. Биофизическая химия. Киев.
Вища школа, 1986, с. 49-59.
4. Ленский А.С. Введение в бионеорганическую и биофизическую
химию. М., Высшая школа. 1989, с. 112-125.
