
- •Медична хімія
- •Медична хімія Навчальний посібник
- •Кислотно-основна рівновага та комплексоутворення в біологічних рідинах заняття № 1
- •1. Тема: Вступ до практикуму. Техніка безпеки роботи в лабораторії.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Біогенні р-елементи: біологічна роль, застосування в медицині.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •9. Література.
- •1. Тема. Біогенні d-елементи : біологічна роль, застосування в медицині.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •9. Література.
- •1. Тема. Комплексоутворення в біологічних системах.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •9. Література.
- •Заняття № 5
- •1. Тема: Величини, що характеризують кількісний склад розчинів.
- •4. Основні базові знання, вміння і навички, необхідні
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття (самостійна позааудиторна робота студентів)
- •Задачі для самостійного розв’язування (самостійна позааудиторна робота студентів)
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 6
- •1. Тема: Приготування розчинів.
- •4. Основні базові знання, вміння і навички, необхідні
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 7
- •1. Тема: Основи титриметричного аналізу.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті
- •Заняття № 8.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •1. Тема. Кислотно-основна рівновага в організмі.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопіготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті
- •9. Література.
- •Заняття № 10.
- •1. Тема. Буферні системи, класифікація та механізм дії.
- •4. Основні базові знання, вміння і навички, необхідн для засвоєння теми.
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 11
- •1. Тема. Визначення буферної ємності. Роль буферів у біосистемах.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття (самостійна позааудиторна робота студентів).
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 12
- •1. Тема: Колігативні властивості розчинів.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •7. Завдання для самостійного опрацювання
- •Правильні відповіді
- •Задачі для самостійного розв’язування
- •Заняття № 13 Підсумковий контроль засвоєння модулю 1
- •Перелік питань до підсумкового контролю модулю 1. Хімія біогенних елементів. Комплексоутворення в біологічних рідинах.
- •Кислотно-основні рівноваги в біологічних рідинах.
- •Модуль 2. Рівноваги в біологічних системах на межі поділу фаз.
- •1. Тема. Теплові ефекти хімічних реакцій в розчинах.
- •4. Основні базові знання, вміння і навички, необхідні
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •1.Тема. Кінетика біохімічних реакцій.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Кінетика біохімічних реакцій.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 4.
- •1. Тема. Хімічна рівновага. Добуток розчинності.
- •4. Основні базові знання, вміння, навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Визначення окисно-відновного потенціалу.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Сорбція біологічно-активних речовин на межі поділу фаз.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 7
- •1.Тема. Іонний обмін. Хроматографія.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Одержання, очистка та властивості колоїдних розчинів.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Коагуляція колоїдних розчинів.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 10
- •1. Тема. Колоїдний захист.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 11
- •1. Тема. Властивості розчинів біополімерів. Ізоелектрична точка білка.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 12 Підсумковий контроль засвоєння модулю 2
- •Термодинамічні та кінетичні закономірності перебігу процесів та електрокінетичні явища в біологічних системах.
- •Фізико-хімія поверхневих явищ. Ліофобні та ліофільні дисперсні системи.
- •Методичні вказівки для позааудиторної самостійної роботи студентів з тем, що винесені на самостійне опрацювання.
- •1. Тема. Добуток розчинності. Умови утворення та розчинення осадів.
- •4. Opiєhtobha картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Tемa. Розчини. Розрахунки в титриметричному аналізі.
- •3. Орієнтовна картка для самостійного опрацювання
- •4. Задачі для самостійного розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •5. Література.
- •1. Тема. Окисно-відновне титрування (оксидиметрія).
- •4. Орієнтовна картка для самостійного опрацювання
- •5. Питання для самостійного опрацювання
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Оксидиметрія. Метод йодометрії.
- •4. Opієhtовha картka для самостійного опрацювання
- •5. Питання для самостійного опрацювання
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література
- •1. Тема. Період напівперетворення. Фотохімічні реакції. Фотосинтез.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Особливості кінетики ферментативних процесів.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Гальванічні кола.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Аерозолі, суспензії, емульсії. Порошки, пасти, креми.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Напівколоїдні мила, детергенти.
- •4. Оріентовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Драглювання розчинів вмс. Механізм драглювання. Тиксотропія. Синерезис. Біологічна роль драглювання. Висолювання біополімерів із розчинів. Коацервація та її роль у біологічних системах.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Аномальна вязкість розчинів вмс. Вязкість крові.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді.
- •6. Питання для контролю знань.
- •7. Література.
- •Заняття № 1. Вступ до практикуму. Техніка безпеки роботи в лабораторії.
- •Заняття № 7. Іонний обмін. Хроматографія………………………………………………... 87
- •Заняття № 11. Властивості розчинів біополімерів. Ізоелектрична точка білка…………. 104. Заняття № 12. Підсумковий контроль засвоєння модулю 2
Правильні відповіді
1) Правильна відповідь б).
Буферні системи за складом бувають двох основних типів:
- слабка кислота - сіль слабкої кислоти та лугу;
- слабка основа - сіль слабкої основи та сильної кислоти.
2) Правильна відповідь а).
Рівняння Гендерсона-Гассельбаха для цієї системи буде мати такий вигляд:
![]()
3) Правильна відповідь в).
Приготований розчин належить до буферних розчинів основного типу. Для розрахунку значення його рН використовуємо рівняння;
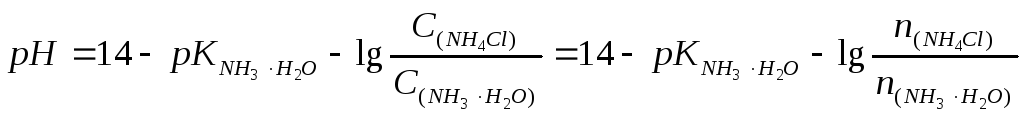

рН буферного розчину дорівнює 9,33.
4) Правильна відповідь г).
При додаванні сильної кислоти до гідрогенкарбонатного буферного розчину має місце її взаємодія з гідрокарбонатом натрію:
Н+ + НСО3- = H2O + CO2
При цьому сильна кислота заміщується еквівалентною кількістю слабкої вугільної кислоти, і її вплив на значення рН буде майже непомітним.
5) Правильні відповіді а) і б).
рН
буферної системи залежить від природи
слабкого електроліту (рК) і співвідношення
компонентів (![]() ).
).
8. Вказівки до роботи студентів на занятті.
8.1. Визначення впливу розведення на рН буферних розчинів.
У першу пробірку налити 6 мл буферного розчину, в другу - 2 мл цього ж розчину та 4 мл дистильованої води. У кожну пробірку додати по 2 краплі індикатора метилового червоного. Зміст пробірок перемішати і порівняти забарвлення.
8.2. Визначення впливу кислоти та лугу на рН буферного розчину.
У три пробірки налити по 4 мл буферного розчину з відомим значенням рН. Потім додати в одну пробірку 2 краплі розчину НСІ
(С = 0,1 моль/л), у другу - 2 краплі розчину NaOH (С = 0,1 моль/л), у третю - 2 краплі дистильованої води і в кожну - по 2 краплі індикатора метилового червоного. Розчини перемішати і порівняти забарвлення.
8.3. Оформлення протоколу лабораторної роботи.
За результатами спостережень зробити висновок про вплив кислот, лугів та розведення на рН буферних розчинів.
9. Література.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с. 161-169.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3.Садовничая Л.П., Хухрянский В.Г, Цыганенко А.Я. Биофизическая химия. Киев, Вища школа, 1986, с,77-82.
4. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. Высшая школа. с. 90-96.
Заняття № 11
1. Тема. Визначення буферної ємності. Роль буферів у біосистемах.
2.ОБҐРУНТУВАННЯ ТЕМИ. Рідини живого організму – кров, сеча, внутрішньо-клітинна рідина, лімфа та інші, містять буферні системи для підтримування постійного значення рН. При багатьох захворюваннях спостерігається зміщення рН або у кислу область (ацидоз), або в лужну (алкалоз). Відомо, що тривале зміщення рН крові на 0,3-0,4 одиниці рН може призвести до смерті хворого. Тому буферна ємність є дуже важливою характеристикою буферної системи або сукупності систем, бо характеризує здатність до нейтралізації речовин, що можуть змінити величину рН. Для точного визначення буферної ємності застосовується потенціометричний метод, який дає змогу чітко зафіксувати зміну рН.
3. МЕТА. Сформувати уявлення про основні буферні системи організму людини, кислотно-лужну рівновагу в організмі та її порушення, буферну ємність буферних систем. Оволодіти методикою потенціометричного визначення буферної ємності.
Студент повинен знати:
- основні буферні системи організму людини, їх склад, особливості
та значення;
- що таке буферна ємність буферних систем, її залежність від різних факторів;
- значення кислотно-лужної рівноваги в організмі людини та
наслідки її зміщення, ацидоз і алкалоз;
- основні закономірності потенціометричного титрування та потенціометричного визначення буферної ємності;
вміти:
- підбирати електроди та складати гальванічне коло для визначення буферної ємності;
- проводити розрахунки за формулами буферної ємності по кислоті та по лугу;
оволодіти навичками:
- потенціометричного визначення буферної ємності сироватки крові за допомогою скляного та хлорсрібного електродів.
