
- •Медична хімія
- •Медична хімія Навчальний посібник
- •Кислотно-основна рівновага та комплексоутворення в біологічних рідинах заняття № 1
- •1. Тема: Вступ до практикуму. Техніка безпеки роботи в лабораторії.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Біогенні р-елементи: біологічна роль, застосування в медицині.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •9. Література.
- •1. Тема. Біогенні d-елементи : біологічна роль, застосування в медицині.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •9. Література.
- •1. Тема. Комплексоутворення в біологічних системах.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •9. Література.
- •Заняття № 5
- •1. Тема: Величини, що характеризують кількісний склад розчинів.
- •4. Основні базові знання, вміння і навички, необхідні
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття (самостійна позааудиторна робота студентів)
- •Задачі для самостійного розв’язування (самостійна позааудиторна робота студентів)
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 6
- •1. Тема: Приготування розчинів.
- •4. Основні базові знання, вміння і навички, необхідні
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 7
- •1. Тема: Основи титриметричного аналізу.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті
- •Заняття № 8.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •1. Тема. Кислотно-основна рівновага в організмі.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопіготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті
- •9. Література.
- •Заняття № 10.
- •1. Тема. Буферні системи, класифікація та механізм дії.
- •4. Основні базові знання, вміння і навички, необхідн для засвоєння теми.
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 11
- •1. Тема. Визначення буферної ємності. Роль буферів у біосистемах.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття (самостійна позааудиторна робота студентів).
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 12
- •1. Тема: Колігативні властивості розчинів.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •7. Завдання для самостійного опрацювання
- •Правильні відповіді
- •Задачі для самостійного розв’язування
- •Заняття № 13 Підсумковий контроль засвоєння модулю 1
- •Перелік питань до підсумкового контролю модулю 1. Хімія біогенних елементів. Комплексоутворення в біологічних рідинах.
- •Кислотно-основні рівноваги в біологічних рідинах.
- •Модуль 2. Рівноваги в біологічних системах на межі поділу фаз.
- •1. Тема. Теплові ефекти хімічних реакцій в розчинах.
- •4. Основні базові знання, вміння і навички, необхідні
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •1.Тема. Кінетика біохімічних реакцій.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Кінетика біохімічних реакцій.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 4.
- •1. Тема. Хімічна рівновага. Добуток розчинності.
- •4. Основні базові знання, вміння, навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Визначення окисно-відновного потенціалу.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Сорбція біологічно-активних речовин на межі поділу фаз.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 7
- •1.Тема. Іонний обмін. Хроматографія.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Одержання, очистка та властивості колоїдних розчинів.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Коагуляція колоїдних розчинів.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 10
- •1. Тема. Колоїдний захист.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 11
- •1. Тема. Властивості розчинів біополімерів. Ізоелектрична точка білка.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 12 Підсумковий контроль засвоєння модулю 2
- •Термодинамічні та кінетичні закономірності перебігу процесів та електрокінетичні явища в біологічних системах.
- •Фізико-хімія поверхневих явищ. Ліофобні та ліофільні дисперсні системи.
- •Методичні вказівки для позааудиторної самостійної роботи студентів з тем, що винесені на самостійне опрацювання.
- •1. Тема. Добуток розчинності. Умови утворення та розчинення осадів.
- •4. Opiєhtobha картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Tемa. Розчини. Розрахунки в титриметричному аналізі.
- •3. Орієнтовна картка для самостійного опрацювання
- •4. Задачі для самостійного розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •5. Література.
- •1. Тема. Окисно-відновне титрування (оксидиметрія).
- •4. Орієнтовна картка для самостійного опрацювання
- •5. Питання для самостійного опрацювання
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Оксидиметрія. Метод йодометрії.
- •4. Opієhtовha картka для самостійного опрацювання
- •5. Питання для самостійного опрацювання
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література
- •1. Тема. Період напівперетворення. Фотохімічні реакції. Фотосинтез.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Особливості кінетики ферментативних процесів.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Гальванічні кола.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Аерозолі, суспензії, емульсії. Порошки, пасти, креми.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Напівколоїдні мила, детергенти.
- •4. Оріентовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Драглювання розчинів вмс. Механізм драглювання. Тиксотропія. Синерезис. Біологічна роль драглювання. Висолювання біополімерів із розчинів. Коацервація та її роль у біологічних системах.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Аномальна вязкість розчинів вмс. Вязкість крові.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді.
- •6. Питання для контролю знань.
- •7. Література.
- •Заняття № 1. Вступ до практикуму. Техніка безпеки роботи в лабораторії.
- •Заняття № 7. Іонний обмін. Хроматографія………………………………………………... 87
- •Заняття № 11. Властивості розчинів біополімерів. Ізоелектрична точка білка…………. 104. Заняття № 12. Підсумковий контроль засвоєння модулю 2
Правильні відповіді.
1) Правильна відповідь в).
Адсорбція на межі поділу фаз рідина - тверде тіло залежить від природи адсорбента та адсорбата (рідина), температури і практично не залежить від тиску, оскільки рідини майже на стискуються.
2) Правильна відповідь а).
Вугілля є неполярним гідрофобним адсорбентом. Згідно з правилом урівнювання полярностей Ребіндера, поверхнево-активна речовина краще буде адсорбуватися на вугіллі з полярного розчинника, займаючи тим самим проміжне за полярністю місце між розчинником і адсорбентом. Найбільш полярним розчинником з тих, що наведені у відповідях, є вода.
3) Правильна відповідь в).
Правило Дюкло-Траубе виконується тільки при адсорбції поверхнево-активних речовин на гідрофобних адсорбентах з водних розчинів або розчинів на базі полярних розчинників, і при збільшенні вуглеводневого радикала (гідрофобної частини дифільної молекули) адсорбція молекул ПАР збільшується. При адсорбції ПАР з неполярних розчинників на гідрофільних адсорбентах спостерігаються результати, обернені правилу Дюкло-Траубе: збільшення гідрофобного ланцюга дифільної молекули призводить до зменшення адсорбції.
4) Правильна відповідь а).
Адсорбція йонів тим більша, чим більший вони мають заряд і менший ступінь гідратації. Чим ближчі за природою йони та адсорбент, тим краще йде адсорбція йонів. Маса адсорбента не впливає на адсорбцію йонів, яка кількісно залежить від площі поверхні адсорбента. Роль тиску при адсорбції на межі поділу фаз “рідина-тверде тіло” обговорювалася раніше.
5) Правильні відповіді а), б).
За правилами Панета-Фаянса кристалічну гратку AgI можуть добудовувати йони Ag+ та І, отже, тільки вони будуть адсорбуватися на поверхні кристали-ків AgI у залежності від того, який йон знаходиться у надлишку.
6) Правильні відповіді б), г).
Катіоніт у Н+-формі здатний обмінювати свої рухомі йони Н+ на катіони, що знаходяться у розчині. Отже, пропускаючи розчин з катіонами кальцію або натрію крізь шар такого катіоніту, можна повністю звільнити розчин від цих катіонів, замінивши їх на катіони гідрогену.
8. Вказівки до роботи студентів на занятті.
8.1.Приготування початкових розчинів оцтової кислоти.
У чотири пронумеровані колби внести по 50,0 см3 дистильованої води. У першу колбу додати 50,0 см3 вихідного розчину оцтової кислоти з концен-трацією приблизно 0,8 моль/дм3. Вміст першої колби перемішати, перенести 50,0 см3 цього розчину у другу колбу. Вміст другої колби також перемішати і перенести 50,0 см3 цього розчину у третю колбу. Із третьої колби таким же чином переносять 50,0 см3 у четверту, з якої після перемішування 50,0 см3 виливають геть. Таким чином, концентрація оцтової кислоти у першій колбі буде вдвічі меншою, ніж концентрація вихідного розчину, а концентрація кожного наступного з початкових розчинів буде вдвічі меншою, ніж попереднього.
8.2. Проведення адсорбції оцтової кислоти на вугіллі.
До кожного з чотирьох початкових розчинів додати по 1 г активованого вугілля. Витримати колби 20 хвилин при регулярному перемішуванні сумішей. Протягом цього часу відбувається адсорбція оцтової кислоти на вугіллі, і встановлюється адсорбційна рівновага.
8.3. Визначення точної концентрації оцтової кислоти у початкових
розчинах.
Спочатку визначити точну концентрацію вихідного розчину оцтової кислоти. Для цього 5,0 см3 вихідного розчину відтитрувати робочим розчином NaOH по фенолфталеїну і розрахувати концентрацію оцтової кислоти у вихідному розчині за формулою:
Свих(CH3COOH)
=
![]() ,
моль/дм3,
де:
,
моль/дм3,
де:
C(NaOH) –концентрація робочого розчину NaOH, моль/дм3;
V(NaOH) –середній обєм титранта, см3;
V (CH3COOH) – обєм вихідного розчину оцтової кислоти, що був
узятий на титрування, см3.
Потім розрахувати концентрацію оцтової кислоти у кожному з чотирьох початкових розчинів – С0і.
Значення занести у таблицю.
8.4. Визначення рівноважних концентрацій оцтової кислоти після
адсорбції.
Приготувати чотири чисті сухі колби з лійками і сухими фільтрами.
Після закінчення адсорбції профільтрувати всі чотири розчини, відкидаючи перші порції фільтратів.
У колбу для титрування послідовно відбирати по 10,0 см3 кожного з фільтратів і титрувати робочим розчином NaOH по фенолфталеїну. Розрахувати концентрацію оцтової кислоти у кожному фільтраті – Сі.
Результати занести у таблицю.
|
№ п/п |
Початкова концентрація оцтової к-тиC0i,моль/дм3 |
Рівноважна концентрація оцтової к-ти Сі, моль/дм3 |
Кількість адсорбова-ної оцтової к-ти Хі, моль |
Величи- на ад- сорбції
|
lgCі |
lg |
Константи у рівнянні Фрейндліха | |
|
К |
1/n | |||||||
|
1 2 3 4 |
|
|
|
|
|
|
|
|
8.5. Проведення розрахунків.
Визначити кількість адсорбованої оцтової кислоти за формулою:
Xi
= (C0i
– Ci)·![]() ,
моль
,
моль
де: С0і , Сі – відповідно початкова та рівноважна концентрації оцтової кислоти, моль/дм3;
V – обєм розчину оцтової кислоти, взятий для адсорбції, см3 .
Розрахувати величину адсорбції оцтової кислоти на 1 кг адсорбента за формулою:
![]() =
=
![]() ·
1000 , моль/кг
·
1000 , моль/кг
де: m(вуг.) – маса активованого вугілля, взятого для адсорбції, г;
m(вуг.) = 1 г.
Визначають
значення : lg
Ci
та
lg
![]() .
.
Результати всіх розрахунків заносять у таблицю.
8.6. Побудова графіків та визначення констант у рівнянні Фрейндліха для адсорбції оцтової кислоти.
На базі експериментальних та розрахункових даних побудувати графіки ізотерми адсорбції Фрейндліха у звичайній (А ,рис.3.1) та лінеаризованій (В ,рис.3.2) формах:
А
:
![]() =K
· Ci1/n
B :
lg
=K
· Ci1/n
B :
lg![]() = lgK +
= lgK +![]() lgCi
lgCi
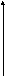
![]()



 lg
lg![]()








 M
M


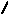
 o
Ci
O о
lg Ci
o
Ci
O о
lg Ci
Рис. 3.1.Рис.3.2.
Для знаходження величини К у рівнянні Фрейндліха визначити величину відрізка ОМ (рис. 3.2.) з урахуванням масштабу по осі ординат.
Потім визначити антилогарифм величини відрізка, бо lgK=ОМ.
Константу 1/n знаходять, визначаючи значення tg (рис. 3.2.) з урахуванням масштабів по осях, бо 1/n = tg .
Значення констант К і 1/n занести у таблицю і записати рівняння Фрейндліха для адсорбції оцтової кислоти на вугіллі.
8.7.Оформлення протоколу лабораторної роботи.
У зошиті записати необхідні розрахунки, побудувати графіки, заповнити таблицю, зробити висновок.
