
- •Медична хімія
- •Медична хімія Навчальний посібник
- •Кислотно-основна рівновага та комплексоутворення в біологічних рідинах заняття № 1
- •1. Тема: Вступ до практикуму. Техніка безпеки роботи в лабораторії.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Біогенні р-елементи: біологічна роль, застосування в медицині.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •9. Література.
- •1. Тема. Біогенні d-елементи : біологічна роль, застосування в медицині.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для підготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •9. Література.
- •1. Тема. Комплексоутворення в біологічних системах.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •9. Література.
- •Заняття № 5
- •1. Тема: Величини, що характеризують кількісний склад розчинів.
- •4. Основні базові знання, вміння і навички, необхідні
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття (самостійна позааудиторна робота студентів)
- •Задачі для самостійного розв’язування (самостійна позааудиторна робота студентів)
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 6
- •1. Тема: Приготування розчинів.
- •4. Основні базові знання, вміння і навички, необхідні
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 7
- •1. Тема: Основи титриметричного аналізу.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті
- •Заняття № 8.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •1. Тема. Кислотно-основна рівновага в організмі.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопіготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті
- •9. Література.
- •Заняття № 10.
- •1. Тема. Буферні системи, класифікація та механізм дії.
- •4. Основні базові знання, вміння і навички, необхідн для засвоєння теми.
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 11
- •1. Тема. Визначення буферної ємності. Роль буферів у біосистемах.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття (самостійна позааудиторна робота студентів).
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 12
- •1. Тема: Колігативні властивості розчинів.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури
- •7. Завдання для самостійного опрацювання
- •Правильні відповіді
- •Задачі для самостійного розв’язування
- •Заняття № 13 Підсумковий контроль засвоєння модулю 1
- •Перелік питань до підсумкового контролю модулю 1. Хімія біогенних елементів. Комплексоутворення в біологічних рідинах.
- •Кислотно-основні рівноваги в біологічних рідинах.
- •Модуль 2. Рівноваги в біологічних системах на межі поділу фаз.
- •1. Тема. Теплові ефекти хімічних реакцій в розчинах.
- •4. Основні базові знання, вміння і навички, необхідні
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •1.Тема. Кінетика біохімічних реакцій.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Кінетика біохімічних реакцій.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 4.
- •1. Тема. Хімічна рівновага. Добуток розчинності.
- •4. Основні базові знання, вміння, навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Визначення окисно-відновного потенціалу.
- •4. Основні базові знання, вміння і навички, необхідні для засвоєння теми.
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Сорбція біологічно-активних речовин на межі поділу фаз.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 7
- •1.Тема. Іонний обмін. Хроматографія.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Одержання, очистка та властивості колоїдних розчинів.
- •4. Основні базові знання, вміння та навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •1. Тема. Коагуляція колоїдних розчинів.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 10
- •1. Тема. Колоїдний захист.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 11
- •1. Тема. Властивості розчинів біополімерів. Ізоелектрична точка білка.
- •4. Основні базові знання, вміння і навички,
- •5. Граф логічної структури.
- •6. Орієнтовна картка для самопідготовки до заняття
- •7. Питання для самостійного опрацювання
- •Правильні відповіді.
- •8. Вказівки до роботи студентів на занятті.
- •9. Література.
- •Заняття № 12 Підсумковий контроль засвоєння модулю 2
- •Термодинамічні та кінетичні закономірності перебігу процесів та електрокінетичні явища в біологічних системах.
- •Фізико-хімія поверхневих явищ. Ліофобні та ліофільні дисперсні системи.
- •Методичні вказівки для позааудиторної самостійної роботи студентів з тем, що винесені на самостійне опрацювання.
- •1. Тема. Добуток розчинності. Умови утворення та розчинення осадів.
- •4. Opiєhtobha картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Tемa. Розчини. Розрахунки в титриметричному аналізі.
- •3. Орієнтовна картка для самостійного опрацювання
- •4. Задачі для самостійного розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •5. Література.
- •1. Тема. Окисно-відновне титрування (оксидиметрія).
- •4. Орієнтовна картка для самостійного опрацювання
- •5. Питання для самостійного опрацювання
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Оксидиметрія. Метод йодометрії.
- •4. Opієhtовha картka для самостійного опрацювання
- •5. Питання для самостійного опрацювання
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література
- •1. Тема. Період напівперетворення. Фотохімічні реакції. Фотосинтез.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Особливості кінетики ферментативних процесів.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Гальванічні кола.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Аерозолі, суспензії, емульсії. Порошки, пасти, креми.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Напівколоїдні мила, детергенти.
- •4. Оріентовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Драглювання розчинів вмс. Механізм драглювання. Тиксотропія. Синерезис. Біологічна роль драглювання. Висолювання біополімерів із розчинів. Коацервація та її роль у біологічних системах.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді.
- •6. Питання для контролю знань.
- •7. Література.
- •1. Тема. Аномальна вязкість розчинів вмс. Вязкість крові.
- •4. Орієнтовна картка для самостійного опрацювання.
- •5. Питання для самостійного опрацювання.
- •Правильні відповіді.
- •6. Питання для контролю знань.
- •7. Література.
- •Заняття № 1. Вступ до практикуму. Техніка безпеки роботи в лабораторії.
- •Заняття № 7. Іонний обмін. Хроматографія………………………………………………... 87
- •Заняття № 11. Властивості розчинів біополімерів. Ізоелектрична точка білка…………. 104. Заняття № 12. Підсумковий контроль засвоєння модулю 2
6. Орієнтовна картка для самопідготовки до заняття
(самостійна позааудиторна робота студентів).
|
Зміст і послідовність дій |
Вказівки до навчальних дій |
|
1. Окисно-відновні системи |
1.1. Реакції в окисно-відновних системах та їх значення. 1.2. Окисно-відновні системи в живих організмах та біологічне окиснення. |
|
2. Поняття про окисно-відновні потенціали (редокс-потенціали) |
2.1. Механізм виникнення окисно-відновних потенціалів. 2.2. Рівняння Нернста-Петерса та фактори, що впливають на величину редокс-потенціалу. 2.3. Стандартний (нормальний) редокс-потенціал. 2.4. Практичне визначення редокс-потенціалу за допомогою платинового електрода. |
|
3.Визначення напрямку самодовільного перебігу окисно-відновних реакцій (редокс реакцій) |
3.1. Порівняння сили окисників і відновників взагалі та за стандартних умов. 3.2. Умови самодовільного перебігу окисно-відновних реакцій |
|
4. Реакції окиснення-відновлення в живих організмах |
4.1. Особливості біологічного окиснення. 4.2.Поняття про стандартний “біохімічний” редокс-потенціал. 4.3. Напрямок реакцій біологічного окиснення |
7. Питання для самостійного опрацювання
(самостійна позааудиторна робота студентів).
1) Вибрати із наведених рівнянь реакцій рівняння окисно-відновних реакцій:
1. Аl2(SO4)3 + 6NаОН = 2Аl(ОН)з + 3 Na2SO4
2. 2Аl + 2NаОН + 6 Н2О = 2 Nа[Аl(ОН)4] + 3 H2
3. АgNОз + NaI = NаNОз + АgІ
4. Cl2 + 2 NаІ = 2 NaCl + I2
а) 1,2 б) 2,3 в) 3,4 г) 2,4
2) Вибрати правильну характеристику окисно-відновного електрода:
а) це метал, що занурений у розчин елетроліту і обмінюється з ним іонами та електронами;
б) це інертний метал, що занурений у розчин електроліту і обмінюється з ним електронами;
в) це інертний метал, що занурений в окисно-відновну систему і є лише провідником електронів;
г) це інертний метал, що занурений в окисно-відновну систему і обмінюється з нею іонами та електронами.
3) Вибрати окисно-відновну систему, потенціал якої залежить від рН:
а) Fe3+ + е- = Fe2+ в) MnO4- + 8Н+ + 5е- = Mn2+ + 4H2O
б) MnO4- + е- = MnO42- г) S4O62- + 2е- = 2 S2O32-
4) Вибрати дріб, що стоятиме під логарифмом у рівнянні Нернcта-ІІетерса для редокс-системи: СrO42–+ 2 Н2О + 3е– = СrО2– + 4 ОН–
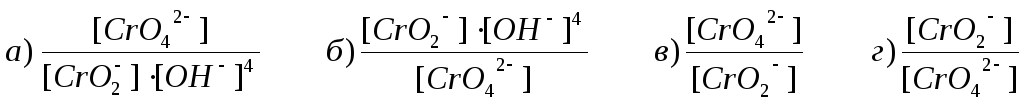
5) Вказати, окислена форма якої окисно-відновної системи буде найбільш сильним окисником за стандартних умов:
а) НВrО + H+ + 2e– = Вr– + H2O φ° = 1,34
б) СrО42-– + 4 Н2О + Зе– = Сr(ОН)3 + 5 ОН– φ° = - 0,13
в) 2 I03– + 12 Н+ + 10e– = I2 + 6 H2O φo = 0,19
г) H2O2 + 2 Н+ + 2е- = 2 H2O φo = 1,78
6) Пояснити, в якому напрямку за стандартних умов буде самодовільно йти реакція:
2 NaCI + Fе2(SO4)з = 2 FeSO4 + Cl2 + Na2SO4, якщо
φоСl2/2Cl- = 1,36 B, a φoFe3+/ Fe2+ = 0,771 B
а) зліва направо; в) реакція взагалі не буде йти;
б) справа наліво; г) реакція буде йти в обох напрямках.
7) Вибрати кращий окисник для перетворення Fе2+-іона за стандартних умов у Fе3+- іон, якщо стандартний потенціал φFe3+/ Fe2+ = 0,771 В, а стандартні потенціали окисників вказані в дужках:
а)KMnО4 (φ° = 1,51 В); в) НNO2 (φ0 = 1,00 В);
б) КМnО4 в нейтральному середовищі (φ° = 0,58 В); г) CuSO4 (φ0 = 0,153 В).
8) Вказати, як зміниться ЕРС гальванічного кола Рв/Рв2+ //Аg+ /Аg,
якщо у розчин солі свинцю додати сірководень (у невеликій кількості);
а) зменшиться; в) не зміниться;
б) збільшиться; г) коло буде зіпсоване.
9) Вказати, який процес буде відбуватися на електроді з більшим потенціалом в окисно-відновному гальванічному колі:
а) залежить від природи електрода; в) окиснення;
б) відновлення; г) окиснення або відновлення.
