
- •Часть 1. Физические основы механики
- •Введение
- •Глава I. Кинематика
- •§1. Перемещение точки. Векторы и скаляры
- •§2. Некоторые сведения о векторах
- •§3. Скорость
- •§4. Вычисление пройденного пути
- •§5. Равномерное движение
- •§6. Проекции вектора скорости на координатные оси
- •§7. Ускорение
- •§8. Прямолинейное равнопеременное движение
- •§9. Ускорение при криволинейном движении
- •§10. Кинематика вращательного движения
- •§11. Связь между векторами v и ω
- •Глава II. Динамика материальной точки
- •§12. Классическая механика. Границы ее применимости
- •§13. Первый закон Ньютона. Инерциальные системы отсчета
- •§14. Второй закон Ньютона
- •§15. Единицы измерения и размерности физических величин
- •§16. Третий закон Ньютона
- •§17. Принцип относительности Галилея
- •§18. Сила тяжести и вес
- •§19. Силы трения
- •§20. Силы, действующие при криволинейном движении
- •§21. Практическое применение законов Ньютона
- •§22. Импульс
- •§23. Закон сохранения импульса
- •Глава III. Работа и энергия
- •§24. Работа
- •§25. Мощность
- •§26. Потенциальное поле сил. Силы консервативные и неконсервативные
- •§27. Энергия. Закон сохранения энергии
- •§28. Связь между потенциальной энергией и силой
- •§29. Условия равновесия механической системы
- •§30. Центральный удар шаров
- •Глава IV. Неинерциальные системы отсчета
- •§31. Силы инерции
- •§32. Центробежная сила инерции
- •§33. Сила Кориолиса
- •Глава V. Механика твердого тела
- •§34. Движение твердого тела
- •§35. Движение центра инерции твердого тела
- •§36. Вращение твердого тела. Момент силы
- •§37. Момент импульса материальной точки» Закон сохранения момента импульса
- •§38 Основное уравнение динамики вращательного движения
- •§39. Момент инерции
- •§40. Кинетическая энергия твердого тела.
- •§41. Применение законов динамики твердого тела
- •§42. Свободные оси. Главные оси инерции
- •§43 Момент импульса твердого тела
- •§44. Гироскопы
- •§45. Деформации твердого тела
- •Глава VI. Всемирное тяготение
- •§46. Закон всемирного тяготения
- •§47. Зависимость ускорения силы тяжести от широты местности
- •§48. Масса инертная и масса гравитационная
- •§49. Законы Кеплера
- •§50. Космические скорости
- •Глава VII. Статика жидкостей и газов
- •§51. Давление
- •§52. Распределение давления в покоящихся жидкости и газе
- •§53. Выталкивающая сила
- •Глава VIII. Гидродинамика
- •§54. Линии и трубки тока. Неразрывность струи
- •§55. Уравнение Бернулли
- •§56. Измерение давления в текущей жидкости
- •§57. Применение к движению жидкости закона сохранения импульса
- •§58. Силы внутреннего трения
- •§59. Ламинарное и турбулентное течение
- •§60. Движение тел в жидкостях и газах
- •Часть 2. Колебания и волны
- •Глава IX. Колебательное движение
- •§61. Общие сведения о колебаниях
- •§62. Гармонические колебания
- •§63. Энергия гармонического колебания
- •§64. Гармоническим осциллятор Систему, описываемую уравнением
- •§65. Малые колебания системы вблизи положения равновесия
- •§66. Математический маятник
- •§67. Физический маятник
- •§68. Графическое изображение гармонических колебаний. Векторная диаграмма
- •§69. Сложение колебаний одинакового направления
- •§70. Биения
- •§71. Сложение взаимно перпендикулярных колебаний
- •§72. Фигуры Лиссажу
- •§73. Затухающие колебания
- •§74. Автоколебания
- •§75. Вынужденные колебания
- •§76. Параметрический резонанс
- •Глава X. Волны
- •§77. Распространение волн в упругой среде
- •§78. Уравнения плоской и сферической волн
- •§79. Уравнение плоской волны, распространяющейся в произвольном направлении
- •§80. Волновое уравнение
- •§81 Скорость распространения упругих волн
- •§82. Энергия упругой волны
- •§83. Интерференция и дифракция воли
- •§84. Стоячие волны
- •§85. Колебания струны
- •§86. Эффект Допплера
- •§87. Звуковые волны
- •§88. Скорость звуковых волн в газах
- •§89. Шкала уровней силы звука
- •§90. Ультразвук
- •Часть 3. Молекулярная физика и термодинамика
- •Глава ХI. Предварительные сведения
- •§91. Молекулярно-кинетическая теория (статистика) и термодинамика
- •§92. Масса и размеры молекул
- •§93. Состояние системы. Процесс
- •§94. Внутренняя энергия системы
- •§95. Первое начало термодинамики
- •§96. Работа, совершаемая телом при изменениях его объема
- •§97. Температура
- •§98. Уравнение состояния идеального газа
- •Глава XII. Элементарная кинетическая теория газов
- •§99. Уравнение кинетической теории газов для давлений
- •§100. Строгий учет распределения скоростей молекул по направлениям
- •§101. Равнораспределение энергии по степеням свободы
- •§102. Внутренняя энергия и теплоемкость идеального газа
- •§103. Уравнение адиабаты идеального газа
- •§104. Политропические процессы
- •§105. Работа, совершаемая идеальным газом при различных процессах
- •§106. Распределение молекул газа по скоростям
- •§107. Экспериментальная проверка закона распределения Максвелла
- •§108. Барометрическая формула
- •§109. Распределение Больцмана
- •§110. Определение Перреном числа Авогадро
- •§111. Средняя длина свободного пробега
- •§112. Явления переноса. Вязкость газов
- •§113. Теплопроводность газов
- •§114. Диффузия & газах
- •§115. Ультраразреженные газы
- •§116. Эффузия
- •Глава ХIII. Реальные газы
- •§117. Отклонение газов от идеальности
- •§118. Уравнение Ван-дер-Ваальса
- •§119. Экспериментальные изотермы
- •§120. Пересыщенный пар и перегретая жидкость
- •§121. Внутренняя энергия реального газа
- •§122. Эффект Джоуля-Томсона
- •§123. Ожижение газов
- •Глава XIV. Основы термодинамики
- •§124. Введение
- •§125. Коэффициент полезного действия тепловой машины
- •§126. Второе начало термодинамики
- •§127. Цикл Карно
- •§128. Коэффициент полезного действия обратимых и необратимых машин
- •§129. К.п.д. цикла Карно для идеального газа
- •§130. Термодинамическая шкала температур
- •§131. Приведенное количество тепла. Неравенство Клаузиуса
- •§132. Энтропия
- •§133. Свойства энтропии
- •§134. Теорема Нернста
- •§135. Энтропия и вероятность
- •§136. Энтропия идеального газа
- •Глава XV. Кристаллическое состояние
- •§137. Отличительные черты кристаллического состояния
- •§138. Классификация кристаллов
- •§139. Физические типы кристаллических решеток
- •§140. Тепловое движение в кристаллах
- •§141. Теплоемкость кристаллов
- •Глава XVI. Жидкое состояние
- •§142. Строение жидкостей
- •§143. Поверхностное натяжение
- •§144. Давление под изогнутой поверхностью жидкости
- •§145. Явления на границе жидкости и твердого тела
- •§146. Капиллярные явления
- •Глава XVII. Фазовые равновесия и превращения
- •§147. Введение
- •§148. Испарение и конденсация
- •§149. Плавление и кристаллизация
- •§150. Уравнение Клапейрона—Клаузиуса
- •§151. Тройная точка. Диаграмма состояния
- •Предметный указатель

− μgh
p = Ce RT
Подставив сюда h=0 получаем
p0 = C
где ро—давление на высоте h=0.
Таким образом, при сделанном нами допущении о постоянстве температуры зависимость давления от высоты выражается формулой
p = p0e− |
μgh |
(108.4) |
RT |
Эта формула называется барометрической. Из нее следует, что давление убывает с высотой тем быстрее, чем тяжелее газ (чем больше μ) и чем ниже температура.
Рис. 245
На рис. 245 изображены две кривые вида (108.4), которые можно трактовать либо как соответствующие разным μ (при одинаковой T), либо как отвечающие разным T (при одинаковой μ).
§109. Распределение Больцмана
Заменив в (108.4) давление р через kT [см, (99.12)], получим закон изменения с высотой числа молекул в единице объема:
− μgh
n = n0e RT
Здесь nо—числе молекул в единице объема на высоте, равной нулю, n — то же число на высоте h.
Полученное выражение можно преобразовать, заменив отношение μ/R равным ему отношением m/r где m — масса одной молекулы, r—постоянная Больцмана:
n = n0e− |
μgh |
(109.1) |
RT |
Из (109.1) следует, что с понижением температуры число частиц на высотах, отличных от нуля, убывает, обращаясь в нуль при Т=0 (рис. 246). При абсолютном нуле все молекулы расположились бы на земной поверхности. При высоких температурах, напротив, n слабо убывает с высотой, так что молекулы оказываются распределен наши по высоте почти равномерно.
Этот факт имеет простое физическое объяснение. Каждое конкретное распределение молекул по высоте устанавливается в результате
272
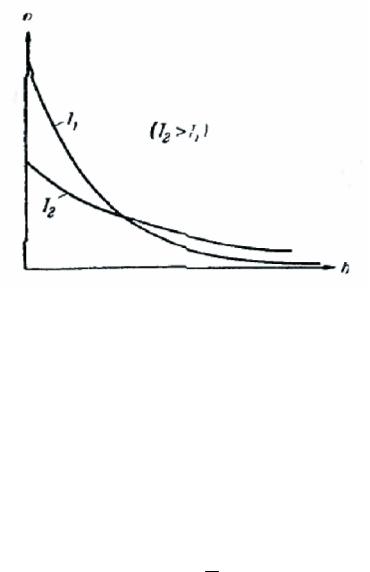
Рис 246
действия двух тенденций: 1) притяжение молекул к земле (характеризуемое силой mg) стремится расположить их на поверхности земли; 2) тепловое движение (характеризуемое величиной kТ) стремится разбросать молекулы равномерно по всем высотам. Чем, больше m и меньше Т, тем сильнее преобладает первая тенденция и молекулы сгущаются у поверхности земли. В пределе при Т=0 тепловое движение совсем прекращается и под влияния притяжения молекулы располагаются на земной поверхности. При высоких температурах превалирует тепловое движение и плотность молекул медленно убывает с высотой.
На разной высоте молекула обладает различным запасом потенциальной энергии: |
|
ε p = mgh |
(109.2) |
Следовательно, распределение (109.1) молекул по высоте является вместе с тем и распределением их по значениям потенциальной энергии. С учетом (109.2) формулу (109.1) можно записать следующим образом:
ε p |
|
n = n0e− rT |
(109.3) |
где n0 — число молекул в единице объема в том месте, где потенциальная энергия молекулы равна нулю, n - число молекул в единице объема, соответствующее тем точкам пространства,
где потенциальная энергия молекулы равна ε p .
Из (109.3) следует, что молекулы располагаются с большей плотностью там, где меньше их потенциальная энергия, и, наоборт, с меньшей плотностью в местах, где их потенциальная энергия больше.
В соответствии с (109.3) отношение n1 и n2 в точках, где потенциальная энергия молекулы имеет значения ε p1 и ε p2 , равно
n1 |
= e |
− |
ε p1 − e p2 |
|
|
|
kT |
. |
(109.4) |
||||
|
||||||
n |
|
|||||
|
|
|
||||
2 |
|
|
|
|
|
Больцман доказал, что распределение (109.3), как и вытекающая из него формула (109.4), справедливо не только в случае потенциального поля сил земного тяготения но и в любом потенциальном поле сил для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения. В соответствии с этим распределение (109-3) называют распределением Больцмана.
В то время как закон Максвелла дает распределение частиц по значениям кинетической энергии, закон Больцмана дает распределение частиц по значениям потенциальной энергии.
273
Для обоих распределений характерно наличие экспоненциального множителя, в показателе которого стоит отношение кинетической или соответственно потенциальной энергии одной молекулы к величине, определяющей среднюю энергию теплового движения молекулы.
Распределении (106.14) и (109.3) можно объединить в один закон Максвелла — Больцмана, согласно которому содержащееся в единице объема количество молекул, скорость которых
лежит между υ и υ + dυ , равно
|
|
|
|
|
|
3 |
|
|
e p + |
mυ 2 |
|
|
|
E |
|
|
|
|
|
|
|
m |
2 |
− |
2 |
|
|
− |
|
|
(109.5) |
||||
|
= n |
|
|
2 |
dυ ≈ e |
2 |
|
||||||||||
|
|
|
|
|
|
|
|||||||||||
dn |
4π |
|
|
|
|
e |
kT υ |
|
|
kTυ |
|
dυ, |
|
||||
|
|
|
|
|
|
|
|||||||||||
e p,υ |
0 |
|
2πkT |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
где nо— число молекул в единице объема в той точке, в которой ε p = 0, а E — полная энергия
молекулы, равная сумме ее кинетической и потенциальной энергий.
В соответствии с условием (106.5) интегрирование (109.5) по и в пределах от 0 до со
− e p
приводит к выражению n = n0e kT , совпадающему с распределением (109.3).
В распределении (109.5) потенциальная энергия ε p и кинетическая энергия mv2/2, а
следовательно и полная энергия E, могут принимать непрерывный ряд значений. Если полная энергия частицы может принимать лишь дискретный ряд значении: E1, E2, .., как это имеет место, например, для внутренней энергии атома, то распределение Больцмана имеет вид:
− |
Ei |
|
|
(109.6) |
||
|
|
|||||
N i= Ae kT . |
||||||
|
||||||
где Ni — число частиц, находящихся в состоянии с энергией Еi, А — коэффициент |
|
|||||
пропорциональности, который должен удовлетворять условию |
|
|||||
∑ Ni = A∑e− |
Ei |
|
||||
kT |
= N |
|
||||
(N—полное число частиц в рассматриваемой системе). |
|
|||||
Подставив найденное из последнего соотношения значение А в формулу (109.6), получим окончательное выражение распределения Больцмана для случая дискретных значений энергий:
|
|
|
Ne− |
Ei |
||||
N |
|
= |
kT |
|
|
. |
||
i |
|
|||||||
|
||||||||
|
|
∑e− |
Ei |
|||||
|
|
|
kT |
|
|
|||
§110. Определение Перреном числа Авогадро
Распределение (109.4) было положено Перреном (1909 гг) в основу опытов по определению числа Авогадро. Взвешенные в жидкости очень мелкие твердые частицы находятся в состоянии непрестанного беспорядочного движения, называемого броуновским движенцем (см. §91).
Причина его заключается в том, что при достаточно малых размерах частиц импульсы, сообщаемые частице ударяющимися о нее с разных сторон молекулами, оказываются некомпенсированным и. О частицу заметных размеров ударяется одновременно большое число молекул, так что суммарный результат ударов молекул достаточно хорошо усредняется. При малых размерах частицы начинают проявляться отклонения скоростей отдельных молекул и числа ударяющихся молекул от средних значений. Если скорость или число молекул, ударяющихся о частицу с одной стороны, окажется иной, чем для молекул, ударяющихся с другой стороны, то результирующий импульс, сообщаемый частице, будет отличен от нуля и
274

частица начнет двигаться в соответствующем направлении. В следующий момент результирующий импульс имеет иное направление. Следовательно, частица будет все время перемещаться беспорядочным образом.
Броуновское движение указывает на то, что достаточно малые частицы вовлекаются в совершаемое молекулами тепловое движение. Принимая участие в тепловом движении, такие частицы должны вести себя подобно гигантским молекулам, и на них должны распространяться закономерности кинетической теории, в частности закон (109.4).
Основную трудность в опытах Перена составляло приготовления одинаковых частиц и определение их массы. Применив многократно метод центрифугирования, Перрену удалось приготовить весьма однородную эмульсию из практически одинаковых шариков гуммигута1 с радиусами порядка нескольких десятых долей микрона. Эмульсия помешалась в плоскую стеклянную кювету глубиной 0,1 мм и рассматривалась с помощью микроскопа (рис. 247).
Рис. 247.
Микроскоп имел столь малую глубину поля зрения, что в него были видны только частицы, находящиеся в горизонтальном слое толщиной примерно 1 мк. Перемещая микроскоп в вертикальном направлении, можно было исследовать распределение броуновских частиц по высоте.
Обозначим высоту слоя, видимого в микроскоп, над дном кюветы буквой h. Число частиц, попадающих в поле зрения микроскопа, определяется формулой
N = n(h)S h
где n0—число броуновских частиц в единице объема на высоте h, S — площадь, a ∆h — глубина поля зрений микроскопа.
Применив к броуновским частицам формулу (109.3), можно написать:
n(h) = n e− |
p′h |
|
kT |
, |
|
0 |
|
|
где по — число частиц в единице объема при h=0, p’ — вес броуновской частицы в эмульсии, т. е. вес, взятый с учетом поправки на закон Архимеда.
Написав выражение числа частиц ∆N для двух разных высот h1 и h2 получаем:
− p′h1
N1 = n0e kT S h,
− p′h2
N2 = n0e kT S h.
Наконец, логарифмируя отношение ∆N1/∆N2, приходим к следующему выражению:
1 Гуммигут — сгущенный млечный сок, получаемый из надрезов в коре некоторых видов деревьев, растущих в Ост-Индии и на Цейлоне
275
