
- •Часть 1. Физические основы механики
- •Введение
- •Глава I. Кинематика
- •§1. Перемещение точки. Векторы и скаляры
- •§2. Некоторые сведения о векторах
- •§3. Скорость
- •§4. Вычисление пройденного пути
- •§5. Равномерное движение
- •§6. Проекции вектора скорости на координатные оси
- •§7. Ускорение
- •§8. Прямолинейное равнопеременное движение
- •§9. Ускорение при криволинейном движении
- •§10. Кинематика вращательного движения
- •§11. Связь между векторами v и ω
- •Глава II. Динамика материальной точки
- •§12. Классическая механика. Границы ее применимости
- •§13. Первый закон Ньютона. Инерциальные системы отсчета
- •§14. Второй закон Ньютона
- •§15. Единицы измерения и размерности физических величин
- •§16. Третий закон Ньютона
- •§17. Принцип относительности Галилея
- •§18. Сила тяжести и вес
- •§19. Силы трения
- •§20. Силы, действующие при криволинейном движении
- •§21. Практическое применение законов Ньютона
- •§22. Импульс
- •§23. Закон сохранения импульса
- •Глава III. Работа и энергия
- •§24. Работа
- •§25. Мощность
- •§26. Потенциальное поле сил. Силы консервативные и неконсервативные
- •§27. Энергия. Закон сохранения энергии
- •§28. Связь между потенциальной энергией и силой
- •§29. Условия равновесия механической системы
- •§30. Центральный удар шаров
- •Глава IV. Неинерциальные системы отсчета
- •§31. Силы инерции
- •§32. Центробежная сила инерции
- •§33. Сила Кориолиса
- •Глава V. Механика твердого тела
- •§34. Движение твердого тела
- •§35. Движение центра инерции твердого тела
- •§36. Вращение твердого тела. Момент силы
- •§37. Момент импульса материальной точки» Закон сохранения момента импульса
- •§38 Основное уравнение динамики вращательного движения
- •§39. Момент инерции
- •§40. Кинетическая энергия твердого тела.
- •§41. Применение законов динамики твердого тела
- •§42. Свободные оси. Главные оси инерции
- •§43 Момент импульса твердого тела
- •§44. Гироскопы
- •§45. Деформации твердого тела
- •Глава VI. Всемирное тяготение
- •§46. Закон всемирного тяготения
- •§47. Зависимость ускорения силы тяжести от широты местности
- •§48. Масса инертная и масса гравитационная
- •§49. Законы Кеплера
- •§50. Космические скорости
- •Глава VII. Статика жидкостей и газов
- •§51. Давление
- •§52. Распределение давления в покоящихся жидкости и газе
- •§53. Выталкивающая сила
- •Глава VIII. Гидродинамика
- •§54. Линии и трубки тока. Неразрывность струи
- •§55. Уравнение Бернулли
- •§56. Измерение давления в текущей жидкости
- •§57. Применение к движению жидкости закона сохранения импульса
- •§58. Силы внутреннего трения
- •§59. Ламинарное и турбулентное течение
- •§60. Движение тел в жидкостях и газах
- •Часть 2. Колебания и волны
- •Глава IX. Колебательное движение
- •§61. Общие сведения о колебаниях
- •§62. Гармонические колебания
- •§63. Энергия гармонического колебания
- •§64. Гармоническим осциллятор Систему, описываемую уравнением
- •§65. Малые колебания системы вблизи положения равновесия
- •§66. Математический маятник
- •§67. Физический маятник
- •§68. Графическое изображение гармонических колебаний. Векторная диаграмма
- •§69. Сложение колебаний одинакового направления
- •§70. Биения
- •§71. Сложение взаимно перпендикулярных колебаний
- •§72. Фигуры Лиссажу
- •§73. Затухающие колебания
- •§74. Автоколебания
- •§75. Вынужденные колебания
- •§76. Параметрический резонанс
- •Глава X. Волны
- •§77. Распространение волн в упругой среде
- •§78. Уравнения плоской и сферической волн
- •§79. Уравнение плоской волны, распространяющейся в произвольном направлении
- •§80. Волновое уравнение
- •§81 Скорость распространения упругих волн
- •§82. Энергия упругой волны
- •§83. Интерференция и дифракция воли
- •§84. Стоячие волны
- •§85. Колебания струны
- •§86. Эффект Допплера
- •§87. Звуковые волны
- •§88. Скорость звуковых волн в газах
- •§89. Шкала уровней силы звука
- •§90. Ультразвук
- •Часть 3. Молекулярная физика и термодинамика
- •Глава ХI. Предварительные сведения
- •§91. Молекулярно-кинетическая теория (статистика) и термодинамика
- •§92. Масса и размеры молекул
- •§93. Состояние системы. Процесс
- •§94. Внутренняя энергия системы
- •§95. Первое начало термодинамики
- •§96. Работа, совершаемая телом при изменениях его объема
- •§97. Температура
- •§98. Уравнение состояния идеального газа
- •Глава XII. Элементарная кинетическая теория газов
- •§99. Уравнение кинетической теории газов для давлений
- •§100. Строгий учет распределения скоростей молекул по направлениям
- •§101. Равнораспределение энергии по степеням свободы
- •§102. Внутренняя энергия и теплоемкость идеального газа
- •§103. Уравнение адиабаты идеального газа
- •§104. Политропические процессы
- •§105. Работа, совершаемая идеальным газом при различных процессах
- •§106. Распределение молекул газа по скоростям
- •§107. Экспериментальная проверка закона распределения Максвелла
- •§108. Барометрическая формула
- •§109. Распределение Больцмана
- •§110. Определение Перреном числа Авогадро
- •§111. Средняя длина свободного пробега
- •§112. Явления переноса. Вязкость газов
- •§113. Теплопроводность газов
- •§114. Диффузия & газах
- •§115. Ультраразреженные газы
- •§116. Эффузия
- •Глава ХIII. Реальные газы
- •§117. Отклонение газов от идеальности
- •§118. Уравнение Ван-дер-Ваальса
- •§119. Экспериментальные изотермы
- •§120. Пересыщенный пар и перегретая жидкость
- •§121. Внутренняя энергия реального газа
- •§122. Эффект Джоуля-Томсона
- •§123. Ожижение газов
- •Глава XIV. Основы термодинамики
- •§124. Введение
- •§125. Коэффициент полезного действия тепловой машины
- •§126. Второе начало термодинамики
- •§127. Цикл Карно
- •§128. Коэффициент полезного действия обратимых и необратимых машин
- •§129. К.п.д. цикла Карно для идеального газа
- •§130. Термодинамическая шкала температур
- •§131. Приведенное количество тепла. Неравенство Клаузиуса
- •§132. Энтропия
- •§133. Свойства энтропии
- •§134. Теорема Нернста
- •§135. Энтропия и вероятность
- •§136. Энтропия идеального газа
- •Глава XV. Кристаллическое состояние
- •§137. Отличительные черты кристаллического состояния
- •§138. Классификация кристаллов
- •§139. Физические типы кристаллических решеток
- •§140. Тепловое движение в кристаллах
- •§141. Теплоемкость кристаллов
- •Глава XVI. Жидкое состояние
- •§142. Строение жидкостей
- •§143. Поверхностное натяжение
- •§144. Давление под изогнутой поверхностью жидкости
- •§145. Явления на границе жидкости и твердого тела
- •§146. Капиллярные явления
- •Глава XVII. Фазовые равновесия и превращения
- •§147. Введение
- •§148. Испарение и конденсация
- •§149. Плавление и кристаллизация
- •§150. Уравнение Клапейрона—Клаузиуса
- •§151. Тройная точка. Диаграмма состояния
- •Предметный указатель
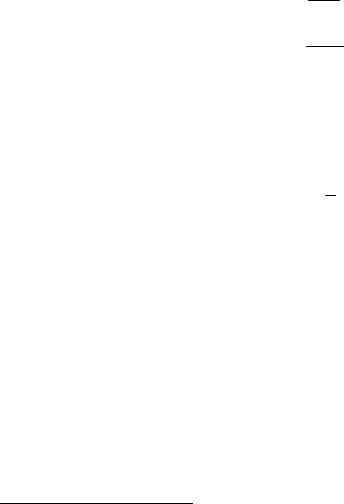
|
dp |
= − |
RT |
|
|
|
+ |
|
2a |
, |
|||
dV |
|
( |
)2 |
|
|
V 3 |
|||||||
|
км |
|
|
Vкм − b |
|
|
|
|
|
км |
|
||
|
d 2 p |
= |
|
2RT |
|
|
+ |
|
6a |
|
|||
|
|
|
|
|
. |
||||||||
|
dVкм2 |
(Vкм − b)3 |
Vкм4 |
||||||||||
В критической точке, т. е. при подстановке Т=Ткр, Vкм=Vкм.кр эти выражения должны обращаться нуль:
− |
RTкр |
|
+ |
2a |
= 0, |
||
(Vкм.кр − b)2 |
Vкм3 .кр |
||||||
|
2RTкр |
+ |
|
6a |
= 0. |
||
(Vкм.кр − b)3 |
Vкм4 .кр |
|
|||||
Совместно с (118.5), написанным для точки Ki
pкр = |
|
RTкр |
− |
a |
, |
|
V |
|
− b |
V 2 |
|||
|
км.кр |
|
|
км.кр |
|
|
они образуют три уравнения с неизвестными ркр, Vкм.кр и Ткр. Решение этой системы уравнений дает;
Vкм.кр = 3b, pкр = 27ab2 ,
Tкр = 8a . 27bR
Таким образом, зиая константы Ван-дер-Ваальса а и b, можно найти соответствующие критической точке Vкм.кр, ркр и Ткр, которые называются критическими величинами. ИI, наоборот, по известным критическим величинам могут быть найдены значения констант Ван- дер-Ваальса.
Из выражении для критических величин вытекает, что pкрVкм.кр = 83 RTкр,
в то время как согласно уравнению состояния идеального газа должно было бы выполняться равенство
pкрVкм.кр = RTкр.
§119. Экспериментальные изотермы
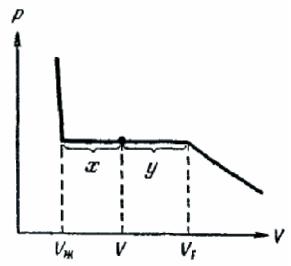
Для того чтобы получить изотерму опытным путем, нужно взять вещество в газообразном состоянии, поместить его в сосуд с перемещающимся поршнем (рис.269) и начать медленно сжимать, делая одновременные отсчеты давления и объема, а также следя за тем, чтобы температура вещества оставалась постоянной. Результаты подобных опытов для температуры ниже критической даны на рис. 270. Вначале с уменьшением объема давление газа1 f) растет, причем ход изотермы довольно хорошо описывается уравнением Ван-дер-Ваальса. Однако, начиная с некоторого значения объема Vr, экспериментальная изотерма перестает следовать уравнению (118.3). Начиная с этого значения объема, давление в сосуде перестает изменяться,
1 Вещество в газообразном состоянии при температуре ниже критической иногда называют паром.
300

само же вещество при этом перестает быть однородным: часть газа конденсируется в жидкость. Происходит, как говорят, расслоение вещества на две фазы: жидкую и газообразную. По мере дальнейшего уменьшения объема все большая часть вещества переходит в жидкую фазу, причем переход осуществляется при постоянном давлении, обозначенном на рисунке pн.п.
Рис. 269.
После того как процесс конденсации вещества в жидкость заканчивается (это происходит при достижении объема Vж), дальнейшее уменьшение объема начинает сопровождаться быстрым ростом давления. При этом ход изотермы снова примерно следует уравнению (118.3). Вещество в состояниях, соответствующих этому участку изотермы, снова будет однородным, но представляет собой не газ, а жидкость.
Таким образом, уравнение Ван-дер-Ваальса описывает не только газообразное состояние вещества, но охватывает также процесс перехода в жидкое состояние и процесс сжатия жидкости.
Сопоставление экспериментальной изотермы с изотермой Ван-дер-Ваальса дает, что эти изотермы довольно хорошо совпадают на участках отвечающих однофазным состояниям вещества, но ведут себя совершенно различным образом в области расслоения на две фазы. Вместо S-образного завитка на изотерме Ван-дер-Ваальса экспериментальная изотерма имеет в этой области прямолинейный горизонтальный участок, который располагается так, что охватываемые завитком площади F1 и F2 (рис. 270) одинаковы.
Рис. 270.
В состояниях, соответствующих горизонтальному участку изотермы, наблюдается равновесие между жидкой и газообразной фазами вещества. Газ (или пар), находящийся в равновесии со своей жидкостью, называется насыщенным паром. Давление рн.п, при котором
301
может существовать равновесие при данной температуре называется давлением (или упругостью) насыщенного пара.
Vr есть объем, занимаемый веществом в газообразном состоянии при давлении рн.п; Vж — объем вещества в жидком состоянии при том же давлении. Назовем удельным объемом V’ объем единицы массы вещества. Тогда, если масса вещества равна m, то удельные объемы насыщенного пара и жидкости при температуре Т и давлении рн.п будут равны
′ |
Vr |
′ |
Vж |
|
|
|
m . |
(119.1) |
|||
VП = m |
;Vж = |
||||
При любом промежуточном значении объема V (рис. 271) часть вещества с массой mж будет находиться в жидком, а часть с массой mп—в парообразном состоянии.
Рис. 271.
Следовательно, на долю жидкости будет приводиться объем Vж′ mж а на долю насыщенного пара — объем VП′ mП . В сумме оба эти объема должны быть равны объему V:
V = Vж′ mж + VП′ mП.
Подставляя сюда выражения (119.1) для удельных объемов и заменяя массу m суммой mж+mП, получаем:
V = Vж |
|
mж |
|
+Vr |
|
|
|
mП |
|
, |
||||||
m + m |
|
m |
ж |
+ m |
|
|||||||||||
|
|
|
ж |
|
|
П |
|
|
|
|
П |
|||||
откуда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
mж |
|
= |
Vr − V |
= |
y |
. |
|
|
|
||||||
|
|
|
|
|
|
|
||||||||||
|
|
m |
П |
V − V |
|
|
x |
|
|
|
||||||
|
|
|
|
|
|
ж |
|
|
|
|
|
|
|
|
||
Следовательно, отношение масс жидкости и насыщенного пара в двухфазном состоянии равно отношению
302
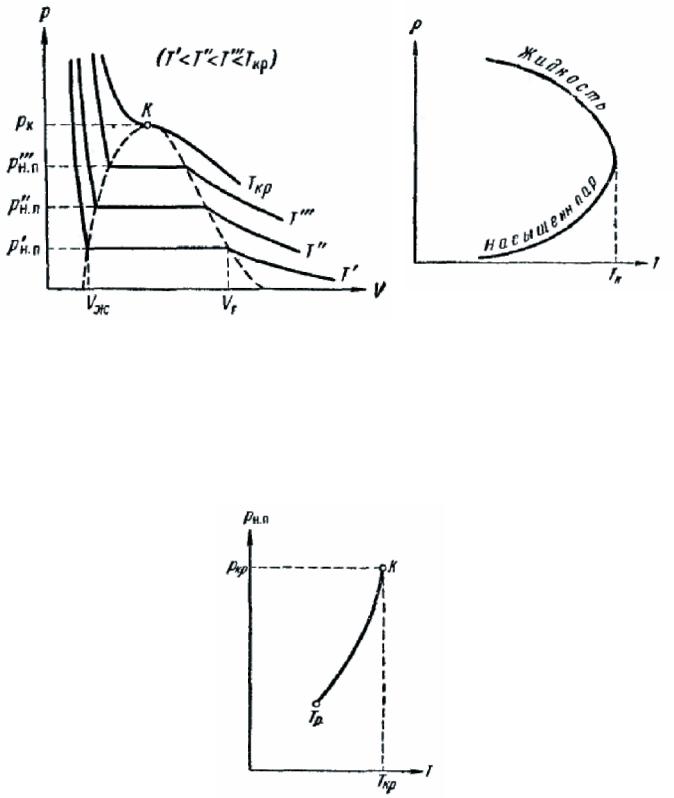
Рис. 272. |
Рис. 273. |
отрезков, на которые делит горизонтальный участок изотермы точка, изображающая состояние.
На рис. 272 приведены экспериментальные изотермы для нескольких значений температуры. Как видно из рисунка, с повышением температуры горизонтальный участок изотермы сокращается, стягиваясь в точку при критической температуре Ткр. В соответствии с этим уменьшается различие в удельных объемах, а следовательно, и плотностях жидкости и насыщенного пара. При критической температуре это различие полностью исчезает. Одно, временно исчезает всякое различие между жидкостью и паром. Температурный ход плотности жидкости и насыщенного пара показан на рис. 273.
Рис. 273
Из рис. 272 следует, что давление насыщенного пара растет с температурой, достигая в критической точке значения ркр. Зависимость pн.п от температуры дана на рис. 274. Кривая заканчивается в критической точке так как при температурах выше критической понятие насыщенною пара теряет смысл. Начинается кривая в так называемой тройной точке Тр, о которой речь пойдет в §151.
Если провести линию через крайние точки горизонтальных участков изотерм (рис. 272), получается колоколообразная кривая, ограничивающая область двух фазных состояний вещества. При температурах выше критической вещество при любом давлении оказывается
303
