
- •Часть 1. Физические основы механики
- •Введение
- •Глава I. Кинематика
- •§1. Перемещение точки. Векторы и скаляры
- •§2. Некоторые сведения о векторах
- •§3. Скорость
- •§4. Вычисление пройденного пути
- •§5. Равномерное движение
- •§6. Проекции вектора скорости на координатные оси
- •§7. Ускорение
- •§8. Прямолинейное равнопеременное движение
- •§9. Ускорение при криволинейном движении
- •§10. Кинематика вращательного движения
- •§11. Связь между векторами v и ω
- •Глава II. Динамика материальной точки
- •§12. Классическая механика. Границы ее применимости
- •§13. Первый закон Ньютона. Инерциальные системы отсчета
- •§14. Второй закон Ньютона
- •§15. Единицы измерения и размерности физических величин
- •§16. Третий закон Ньютона
- •§17. Принцип относительности Галилея
- •§18. Сила тяжести и вес
- •§19. Силы трения
- •§20. Силы, действующие при криволинейном движении
- •§21. Практическое применение законов Ньютона
- •§22. Импульс
- •§23. Закон сохранения импульса
- •Глава III. Работа и энергия
- •§24. Работа
- •§25. Мощность
- •§26. Потенциальное поле сил. Силы консервативные и неконсервативные
- •§27. Энергия. Закон сохранения энергии
- •§28. Связь между потенциальной энергией и силой
- •§29. Условия равновесия механической системы
- •§30. Центральный удар шаров
- •Глава IV. Неинерциальные системы отсчета
- •§31. Силы инерции
- •§32. Центробежная сила инерции
- •§33. Сила Кориолиса
- •Глава V. Механика твердого тела
- •§34. Движение твердого тела
- •§35. Движение центра инерции твердого тела
- •§36. Вращение твердого тела. Момент силы
- •§37. Момент импульса материальной точки» Закон сохранения момента импульса
- •§38 Основное уравнение динамики вращательного движения
- •§39. Момент инерции
- •§40. Кинетическая энергия твердого тела.
- •§41. Применение законов динамики твердого тела
- •§42. Свободные оси. Главные оси инерции
- •§43 Момент импульса твердого тела
- •§44. Гироскопы
- •§45. Деформации твердого тела
- •Глава VI. Всемирное тяготение
- •§46. Закон всемирного тяготения
- •§47. Зависимость ускорения силы тяжести от широты местности
- •§48. Масса инертная и масса гравитационная
- •§49. Законы Кеплера
- •§50. Космические скорости
- •Глава VII. Статика жидкостей и газов
- •§51. Давление
- •§52. Распределение давления в покоящихся жидкости и газе
- •§53. Выталкивающая сила
- •Глава VIII. Гидродинамика
- •§54. Линии и трубки тока. Неразрывность струи
- •§55. Уравнение Бернулли
- •§56. Измерение давления в текущей жидкости
- •§57. Применение к движению жидкости закона сохранения импульса
- •§58. Силы внутреннего трения
- •§59. Ламинарное и турбулентное течение
- •§60. Движение тел в жидкостях и газах
- •Часть 2. Колебания и волны
- •Глава IX. Колебательное движение
- •§61. Общие сведения о колебаниях
- •§62. Гармонические колебания
- •§63. Энергия гармонического колебания
- •§64. Гармоническим осциллятор Систему, описываемую уравнением
- •§65. Малые колебания системы вблизи положения равновесия
- •§66. Математический маятник
- •§67. Физический маятник
- •§68. Графическое изображение гармонических колебаний. Векторная диаграмма
- •§69. Сложение колебаний одинакового направления
- •§70. Биения
- •§71. Сложение взаимно перпендикулярных колебаний
- •§72. Фигуры Лиссажу
- •§73. Затухающие колебания
- •§74. Автоколебания
- •§75. Вынужденные колебания
- •§76. Параметрический резонанс
- •Глава X. Волны
- •§77. Распространение волн в упругой среде
- •§78. Уравнения плоской и сферической волн
- •§79. Уравнение плоской волны, распространяющейся в произвольном направлении
- •§80. Волновое уравнение
- •§81 Скорость распространения упругих волн
- •§82. Энергия упругой волны
- •§83. Интерференция и дифракция воли
- •§84. Стоячие волны
- •§85. Колебания струны
- •§86. Эффект Допплера
- •§87. Звуковые волны
- •§88. Скорость звуковых волн в газах
- •§89. Шкала уровней силы звука
- •§90. Ультразвук
- •Часть 3. Молекулярная физика и термодинамика
- •Глава ХI. Предварительные сведения
- •§91. Молекулярно-кинетическая теория (статистика) и термодинамика
- •§92. Масса и размеры молекул
- •§93. Состояние системы. Процесс
- •§94. Внутренняя энергия системы
- •§95. Первое начало термодинамики
- •§96. Работа, совершаемая телом при изменениях его объема
- •§97. Температура
- •§98. Уравнение состояния идеального газа
- •Глава XII. Элементарная кинетическая теория газов
- •§99. Уравнение кинетической теории газов для давлений
- •§100. Строгий учет распределения скоростей молекул по направлениям
- •§101. Равнораспределение энергии по степеням свободы
- •§102. Внутренняя энергия и теплоемкость идеального газа
- •§103. Уравнение адиабаты идеального газа
- •§104. Политропические процессы
- •§105. Работа, совершаемая идеальным газом при различных процессах
- •§106. Распределение молекул газа по скоростям
- •§107. Экспериментальная проверка закона распределения Максвелла
- •§108. Барометрическая формула
- •§109. Распределение Больцмана
- •§110. Определение Перреном числа Авогадро
- •§111. Средняя длина свободного пробега
- •§112. Явления переноса. Вязкость газов
- •§113. Теплопроводность газов
- •§114. Диффузия & газах
- •§115. Ультраразреженные газы
- •§116. Эффузия
- •Глава ХIII. Реальные газы
- •§117. Отклонение газов от идеальности
- •§118. Уравнение Ван-дер-Ваальса
- •§119. Экспериментальные изотермы
- •§120. Пересыщенный пар и перегретая жидкость
- •§121. Внутренняя энергия реального газа
- •§122. Эффект Джоуля-Томсона
- •§123. Ожижение газов
- •Глава XIV. Основы термодинамики
- •§124. Введение
- •§125. Коэффициент полезного действия тепловой машины
- •§126. Второе начало термодинамики
- •§127. Цикл Карно
- •§128. Коэффициент полезного действия обратимых и необратимых машин
- •§129. К.п.д. цикла Карно для идеального газа
- •§130. Термодинамическая шкала температур
- •§131. Приведенное количество тепла. Неравенство Клаузиуса
- •§132. Энтропия
- •§133. Свойства энтропии
- •§134. Теорема Нернста
- •§135. Энтропия и вероятность
- •§136. Энтропия идеального газа
- •Глава XV. Кристаллическое состояние
- •§137. Отличительные черты кристаллического состояния
- •§138. Классификация кристаллов
- •§139. Физические типы кристаллических решеток
- •§140. Тепловое движение в кристаллах
- •§141. Теплоемкость кристаллов
- •Глава XVI. Жидкое состояние
- •§142. Строение жидкостей
- •§143. Поверхностное натяжение
- •§144. Давление под изогнутой поверхностью жидкости
- •§145. Явления на границе жидкости и твердого тела
- •§146. Капиллярные явления
- •Глава XVII. Фазовые равновесия и превращения
- •§147. Введение
- •§148. Испарение и конденсация
- •§149. Плавление и кристаллизация
- •§150. Уравнение Клапейрона—Клаузиуса
- •§151. Тройная точка. Диаграмма состояния
- •Предметный указатель

h = 2α cosϑ . pgd
Если сложить вместе две отшлифованные смоченные пластинки, то между ними возникает заметная сила сцепления. Это явление имеет следующее объяснение. Поверхность жидкости в зазоре между пластинками сильно искривлена (рис. 326).
Рис. 326.
Следовательно, давление внутри жидкости будет меньше атмосферного на величину
|
1 |
|
1 |
|
|
|
+ |
|
|||
R |
R |
||||
p = α |
. |
||||
|
1 |
|
2 |
|
При полном смачивании R1=d/2, где d— величина зазора между пластинками. Радиус R2 сечения плоскостью, параллельной пластинкам, значительно больше, чем R1. Поэтому можно
положить p ≈ α 1 = 2α . Если
R1 d
величина смоченной жидкостью поверхности каждой пластинки равна S, то пластинки будут прижиматься друг к другу с силой, равной
f = |
pS = |
2αS |
. |
(146.4) |
d |
||||
|
|
|
|
Величина зазора между пластинками определяется размерами шероховатостей на их поверхностях. При зазоре порядка 1 мк и пластинках, смоченных водой, не получается порядка 1 ат, так что, если пластинки имеют размеры 10x10 см, то сила сцепления между ними может достигать 100 кГ.
В случае, когда между пластинками находится прослойка из несмачивающей их жидкости, возникает сила расталкивающая пластинки. Величина этой силы также определяется выражением (146.4).
Глава XVII. Фазовые равновесия и превращения
§147. Введение
В термодинамике фазой называется совокупность однородных, одинаковых по своим свойствам частей системы. Поясним понятие фазы на следующих примерах. В закрытом сосуде находится вода и над ней смог воздуха и паров воды. В этом случае мы имеем дым с системой, состоящей из двух фаз: одну фазу образует вода, вторую — смесь воздуха и паров воды. Если в воду добавить несколько кусочков льда, то все эти кусочки образуют третью фазу. Различные кристаллические модификации какого-либо вещества также представляют собой разные фазы. Так, например, алмаз и графит являются различными твердыми фазами углерода.
При определенных условиях разные фазы одного и того же вещества могут находиться в равновесии друг с другом, соприкасаясь между собой. Равновесие двух фаз может иметь место лишь в определенном интервале температур, причем каждому значению температуры соответствует вполне определенное давление р, при котором возможно равновесие. Таким образом, состояние равновесия двух фаз изобразятся на диаграмме (р, Т – линией).
p = f (T ). |
(147.1) |
358

Так, например, равновесие между жидкостью или насыщенным паром возможно, как мы видели в §146 лишь в температурном интервале, заключенном между температурой тронной точки и критической температурой. График функции (147.1) в этом случае представляет собой кривую упругости насыщенного пара.
Три фазы одного и того же вещества (твердая, жидкая и газообразная, или жидкая и две твердые) могут находиться в равновесии только при единственных значениях температуры и давления, которым на диаграмме (р, Т) соответствует точка, называемая тройной. Эта точка лежит на пересечении кривых равновесия фаз, взятых попарно.
В термодинамике доказывается в согласии с опытом, что равновесие более чем трех фаз одного и того же вещества невозможно.
Переход из одной фазы в другую обычно сопровождается поглощением или выделением некоторого количества тепла, которое называется скрытой теплотой перехода, или просто теплотой перехода. Существуют переходы из одной кристаллической модификации в другую, которые не связаны с поглощением или выделением тепла. Такие переходы называются фазовыми переходами второго рода в отличие от обычных переходов, называемых фазовыми переходами первого рода. Мы ограничимся рассмотрением только переходов первого рода.
§148. Испарение и конденсация
В жидких и твердых телах при любой температуре имеется некоторое количество молекул, энергия которых оказывается достаточной для того, чтобы преодолеть притяжение к другим молекулам, покинуть поверхность жидкости или твердого тела и перейти в газообразную фазу. Переход жидкости в газообразное состояние называется испарением, переход в газообразное состояние твердого тела носит название сублимации.
Все твердые тела без исключения в той или иной степени сублимируют. У одних веществ, таких, например, как углекислота, процесс сублимации протекает с заметной скоростью; у других веществ этот процесс при обычных температурах столь незначителен, что практически не обнаруживается.
При испарении и сублимации тело покидают наиболее быстрые молекулы, вследствие чего средняя энергия оставшихся молекул уменьшается и тело охлаждается.
Чтобы поддерживать температуру испаряющегося (или сублимирующегося) тела неизменной, к нему нужно непрерывно подводить тепло. Тепло q, которое необходимо сообщить единице массы вещества для того, чтобы превратить ее в пар, находящийся при той же температуре, какую имело вещество до испарения, называется удельной теплотой испарения (или сублимации).
При конденсации тепло, затраченное при испарении, отдается обратно: образующаяся при конденсации жидкость (или твердое тело) нагревается.
Произведем оценку теплоты испарения жидкости. При испарении некоторого количества жидкости переходящие в газообразную фазу молекулы должны совершить работу против сил, действующих в поверхности ном слое (см. § 143). Эти силы действуют на пути, равном
толщине слоя r. Обозначив среднюю величину силы на этом пути f , а число молекул в единице массы через n′ , работу против сил, действующих в поверхностном слое, можно представить в виде n′ f r . Процесс испарения сопровождается увеличением объема вещества,
вследствие чего сопряжен с необходимостью совершения работы против внешних сил. Если, испарение происходит при постоянном внешнем давлении р, работа против внешних сил равна
p Vn |
− Vж |
), где |
Vn |
Vж |
|
|
|
|
|
( ′ |
′ |
′ и |
′ — удельные объемы пара и жидкости. Обе указанные выше |
||||||
работы совершаются за счет теплоты испарения q. Таким образом, |
|
||||||||
|
|
|
|
q = n |
′ |
|
( ′ |
′ ) |
(148.1) |
|
|
|
|
|
|||||
|
|
|
|
|
f r + p Vn |
− Vж . |
|
||
Как следует из выражения (148.1), теплота испарения уменьшается с температурой. В самом деле, с повышением температуры плотность насыщенного пара растет, что приводит к
359

уменьшению сил, действующих на молекулу в поверхностном слое. Уменьшается также различие в удельных объемах насыщенного пара и жидкости. Следовательно, при повышении температуры оба слагаемых в (148.1) убывают. При критической температуре теплота испарения обращается в нуль.
Рассмотрим процесс установления равновесия между жидкостью и ее паром. Возьмем герметичный сосуд, частично заполненный жидкостью (рис. 327), и допустим, что первоначально из пространства над жидкостью вещество было полностью удалено. Вследствие процесса испарения пространство над жидкостью станет наполняться молекулам к. Молекулы, перешедшие в газообразную фазу, двигаясь хаотически, ударяются о поверхность жидкости, причем часть таких ударов будет сопровождаться переходом молекул в жидкую фазу. Количество молекул, переходящих в единицу времени в жидкую фазу» очевидно, пропорционально количеству ударяющихся о поверхность молекул, которое, как мы знаем [см.
(99.9)], в свою очередь пропорционально nυ т. е. растет с давлением р. Следовательно, наряду с испарением протекает обратный процесс перехода молекул из газообразной в жидкую фазу, причем интенсивность его растет по мере увеличения плотности молекул в пространстве над жидкостью. При достижении некоторого, вполне определенного (для данной температуры) давления количества молекул, покидающих жидкость и возвращающихся в нее, станут равны. Начиная с этого момента, плотность пара перестает изменяться. Между жидкостью и паром установится подвижное равновесие (рис 327), которое будет существовать до тех пор, пока не изменится объем или температура системы.
Рис 327.
Давление, соответствующее подвижному равновесию, есть давление насыщенных паров pн.п - Если увеличить объем сосуда, давление пара упадет и равновесие будет нарушено. В результате превратится в пар дополнительное количество жидкости, такое, чтобы давление снова стало равно pн.п Аналогично уменьшение объема приведет к превращению некоторого количества пара в жидкость.
Количество молекул, покидающих жидкость в единицу времени, сильно растет с температурой. Количество молекул, ударяющихся о поверхность жидкости, зависит от
температуры в меньшей степени (через υ как  T ). Поэтому при повышении температуры равновесие между фазами нарушается и в течение некоторого времени поток молекул в направлении жидкость→ пар будет превышать поток в направлении пар→ жидкость. Это продолжается до тех пор, пока возрастание давления не
T ). Поэтому при повышении температуры равновесие между фазами нарушается и в течение некоторого времени поток молекул в направлении жидкость→ пар будет превышать поток в направлении пар→ жидкость. Это продолжается до тех пор, пока возрастание давления не
Таким образом, давление, при котором устанавливается подвижное равновесие между жидкостью и паром, т. е. давление насыщенных паров, оказывается зависящим от температуры. Вид этой зависимости показан на рис 274.
Все сказанное о равновесии между жидкостью и газом справедливо и для системы твердое тело — газ. Каждой температуре соответствует определенное значение давления при котором устанавливается подвижное равновесие между твердым телом и газом. Для многих тел, таких, например, как твердые металлы, это давление при обычных температурах настолько мало, что не может быть обнаружено самыми чувствительными приборами.
360
§149. Плавление и кристаллизация
Переход кристаллического тела в жидкое состояние происходит при определенной для каждого вещества температуре и требует затраты некоторого количества тепла, называемого теплотой плавления.
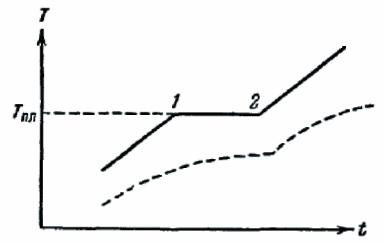
Если веществу, первоначально находившемуся в кристаллическом состоянии сообщать каждую секунду одно и то же количество тепла, то изменение температуры тела со временем будет таким, как показано на рис. 328.
Рис. 328.
Вначале температура тела все время растет. По достижении температуры плавления Tпл (точка 1 на рис. 328), несмотря на то, что к телу по-прежнему продолжает подводиться тепло, температура его перестает изменяться.
Одновременно начинается процесс плавления твердого тела, в ходе которого все новые и новые порции вещества превращаются в жидкость. После того как процесс плавления будет закончен и все вещество полностью перейдет в жидкое состояние (точка 2 на рис. 328), температура снова начнет повышаться.
Кривая нагревания аморфного тела выглядит иначе (см. пунктирную кривую на рис. 328). При равномерном подводе тепла температура аморфного тела непрерывно растет. Для аморфных тел нет определенной температуры перехода в жидкое состояние. Этот переход совершается непрерывно, а не скачком. Можно лишь указать интервал температур, в пределах которого происходит размягчение тела. Это объясняется тем, что жидкости и аморфные тела отличаются лишь степенью подвижности молекул, — аморфные тела, как уже отмечалось, представляют собой сильно переохлажденные жидкости.
Температура плавления зависит от давления. Таким образом, переход из кристаллического в жидкое состояние происходит при вполне определенных условиях, характеризуемых значениями давления и температуры. Совокупности этих значений соответствует кривая на диаграмме (p, T), которую принято называть кривой плавления. Кривая плавления идет очень круто. Для того, например, чтобы изменить на 1° температуру таяния льда, необходимо изменить давление на 132 ат.
Точки кривой плавления определяют условия, при которых кристаллическая и жидкая фазы могут находиться в равновесии друг с другом. Такое равновесие возможно при любом соотношении между массами жидкости и кристаллов, т, е. при значениях объема системы,
заключенных в пределах от |
mVT |
mVж |
VT |
Vж |
′ до |
′ где m — масса системы, а |
′ и |
′ - удельные |
объемы твердой и жидкой фаз. Поэтому каждой точке кривой плавления соответствует на диаграмме (р, V) отрезок горизонтальной прямой (рис. 329).
361
