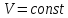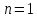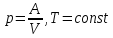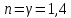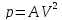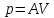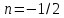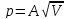- •О.И.Москвич общая физика Молекулярная физика
- •Предисловие
- •I. Основы молекулярной статистики
- •1.1. Предмет молекулярной физики
- •1.2. Масштабы физических величин в молекулярном мире
- •1.3. Теоретические и экспериментальные методы молекулярной физики
- •1.4. Эволюция молекулярных систем. Порядок и хаос
- •1.5. Принципы организации статистического и термодинамического методов изучения макросистем
- •Статистический метод
- •Термодинамический метод
- •2.1. Классификация моделей молекулярных систем
- •2.2. Идеальные статистические системы
- •Модели идеальных систем
- •2.3. Элементарные сведения из теории вероятностей
- •Случайные события
- •Определения вероятности событий
- •Статистическое или частотное определение вероятности.
- •Теоремы теории вероятностей
- •Условие нормировки вероятности
- •Случайная величина
- •Плотность вероятности
- •2.4. Основные понятия молекулярной статистики
- •Вероятность микроскопического состояния. Статистический ансамбль
- •Статистические постулаты
- •Комментарий к постулату равновероятности
- •Эргодическая гипотеза:
- •Постулат равновероятности доступных микроскопических состояний изолированной системы в состоянии термодинамического
- •Комментарий к эргодической гипотезе
- •Вероятность макроскопического состояния
- •3.1. Вывод закона распределения вероятностей Описание системы
- •Актуальные свойства модели системы
- •Постановка задачи
- •Вывод закона
- •Математические преобразования больших чисел. Введение общепринятых обозначений
- •Формула для вероятности макросостояния. Закон Бернулли, или биномиальное распределение.
- •3.2. Графическое представление биномиального распределения.
- •Основные характеристики биномиального распределении.
- •3.3. Предельные случаи биномиального распределения
- •4.1. Распределение энергии в статической системе
- •Вывод распределения Гиббса
- •4.2. Вывод распределения Максвелла
- •4.3. Плотность вероятности и характерные скорости распределения Максвелла
- •4.4. Распределение Максвелла по компонентам скорости
- •4.5. Экспериментальная проверка распределения Максвелла
- •5.1. Вывод формулы для давления идеального газа
- •5.2. Основное уравнение молекулярно-кинетической теории. Газовые законы
- •5.3. Уравнение эффузии
- •5.4. Измерение давления
- •5.5. Определение и измерение температуры
- •5.6. Построение эмпирической шкалы на основе газового термометра
- •Преимущества газовой шкалы температур
- •Построение газовой шкалы температур
- •Термодинамическая шкала температур
- •6.1. Распределение молекул по энергиям во внешнем потенциальном поле
- •6.2. Формула Больцмана для концентрации молекул в потенциальном поле
- •6.3. Зависимость концентрации молекул газа от координат в однородном гравитационном поле и поле центробежных сил
- •Графическое представление зависимости концентрации молекул от координат
- •6.4. Экспериментальное подтверждение распределения Больцмана: опыты Перрена
- •Получение макромолекул
- •Выделение частиц одинакового размера
- •Измерение диаметра макромолекулы
- •Подсчёт количества частиц на определённой высоте
- •6.5. Барометрическая формула
- •6.6. Закон распределения Максвелла – Больцмана
- •7.1. Формулировка теоремы и её доказательство Формулировка теоремы
- •Актуальные свойства модели статистической системы
- •Доказательство теоремы
- •7.2. Статистические степени свободы
- •7.3. Броуновское движение и его статистическое описание
- •Поступательное броуновское движение
- •Вращательное броуновское движение
- •7.4. Броуновский критерий точности физических измерений
- •7.5. Классическая теория теплоёмкости многоатомных газов. Область её применимости
- •7.6. Классическая теория теплоёмкости твёрдых тел.
- •7.7. Применение квантовых моделей в теории теплоёмкости твёрдых тел
- •Модель Эйнштейна
- •Модель Дебая
- •II. Основы термодинамики
- •8.1. Четыре постулата термодинамики
- •8.2. Нулевое (общее) начало термодинамики
- •Формулировка постулата
- •Свойство транзитивности термодинамического равновесия
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •8.3. Макроскопические процессы
- •8.4. Функция состояния
- •Математические свойства функции состояния
- •8.5. Внутренняя энергия системы. Работа и теплота Внутренняя энергия
- •Макроскопическая работа и теплота
- •8.6. Калорическое и термическое уравнения состояния
- •9.1. Первое начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •9.2. Теплоёмкость
- •Связь между теплоёмкостями и(общий случай)
- •Уравнение Роберта Майера
- •9.3. Политропические процессы в идеальном газе
- •Вывод уравнения политропического процесса в идеальном газе
- •9.4. Тепловые машины и их эффективность.
- •Принципиальная схема работы тепловой машины
- •Показатели эффективности тепловых машин
- •10.1. Цикл Карно
- •Расчёт кпд машины Карно
- •10.2. Теоремы Карно
- •Термодинамическая шкала температур
- •10.3. Метод циклов
- •Задача о нахождении зависимости внутренней энергии макроскопического тела от его объема
- •10.4. Неравенство Клаузиуса. Определение энтропии
- •10.5. Оценка эффективности тепловых машин сверху
- •Примеры оценок эффективности тепловых машин сверху кпд бензинового двигателя внутреннего сгорания
- •Кпд паровой турбины
- •Киэ бытового холодильника
- •Киэ кондиционера воздуха
- •Киэ теплового насоса
- •Тепловое загрязнение окружающей среды
- •11.1. Формулировки второго начала термодинамики
- •Энтропийная формулировка второго начала термодинамики Часть первая
- •Часть вторая
- •Информационное содержание постулата
- •11.2. Закон возрастания энтропии в изолированных системах
- •Демон Максвелла
- •Формулировка парадокса
- •Разрешение парадокса
- •11.3. Область применимости второго начала термодинамики
- •Статистический характер второго начала
- •11.4. Концепция тепловой смерти Вселенной
- •Концепция Клаузиуса
- •Флуктуационная гипотеза Больцмана
- •Несостоятельность концепции тепловой смерти Вселенной
- •11.5. Энтропия и её изменение в различных процессах
- •Постановка задачи
- •Описание системы
- •Актуальные свойства системы и процесса
- •Решение
- •Парадокс Гиббса Описание
- •По разные стороны перегородки находятся различные газы. После устранения перегородки начнется диффузия.
- •По разные стороны перегородки находится один и тот же газ.
- •12.1. Термодинамические функции
- •Свободная энергия
- •Термодинамический потенциал Гиббса
- •12.3. Условия термодинамической устойчивости макроскопических систем. Принцип Ле Шателье-Брауна
- •Принцип Ле Шателье-Брауна
- •Проведение полного термодинамического анализа вещества на полуэмпирической основе
- •12.4. Третье начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата (варианты)
- •Информационное содержание постулата
- •Статус постулата
- •Следствия третьего начала
- •III. Физика реальных макросистем
- •13.1. Твердые тела
- •13.2. Реальные газы и жидкости
- •Потенциал межмолекулярного взаимодействия
- •Природа межмолекулярного взаимодействия
- •Структура жидкостей
- •13.3. Переход из газообразного состояния в жидкое.
- •13.4. Уравнения состояния реального газа
- •13.5. Модель газа Ван-дер-Ваальса. Уравнение Ван-дер-Ваальса
- •14.1. Изотермы газа Ван-дер-Ваальса
- •14.2. Критическое состояние вещества
- •Закон соответственных состояний
- •Свойства вещества в критическом состоянии
- •Анализ применения уравнения Ван-дер-Ваальса для описания свойств реальных газов
- •14.3. Внутренняя энергия газа Ван-дер-Ваальса
- •14.4. Эффект Джоуля-Томсона Основные определения
- •Описание процесса Джоуля-Томсона
- •Сущность эффекта Джоуля-Томсона
- •Расчет дифференциального эффекта Джоуля-Томсона
- •Расчет интегрального эффекта Джоуля-Томсона
- •14.5. Методы получения низких температур
- •Метод противоточного обмена теплотой
- •Метод адиабатического размагничивания
- •15.1. Условие равновесия фаз химически однородного вещества
- •15.2. Классификация фазовых переходов по Эренфесту
- •Фазовые переходы первого рода
- •Фазовые переходы второго рода
- •15.3. Фазовые переходы первого рода. Диаграмма состояний
- •15.4. Уравнение Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса методом циклов
- •Актуальные свойства процесса
- •Постановка задачи
- •Вывод уравнения
- •15.5. Диаграмма состояний гелия. Сверхтекучесть жидкого гелия.
- •16.1. Релаксационные процессы в молекулярных системах
- •16.2. Стационарные уравнения переноса в газах, жидкостях и твердых телах
- •Уравнение теплопроводности
- •Уравнение самодиффузии
- •Уравнение внутреннего трения
- •16.3. Внутренняя теплопроводность и внешняя теплопередача
- •Стационарное распределение температуры в бесконечной плоско-параллельной пластинке
- •Стационарное распределение температуры между двумя концентрическими бесконечно длинными цилиндрами
- •Стационарное распределение температуры между двумя концентрическими сферами
- •Внешняя теплопередача
- •17.1. Столкновения молекул и их количественные характеристики
- •Эффективное сечение молекул
- •Средняя длина свободного пробега молекулы
- •Кинематические параметры и
- •17.2. Обобщенное уравнение переноса
- •Вывод обобщенного уравнения процесса Описание системы
- •Актуальные свойства модели процесса
- •Постановка задачи
- •Вывод уравнения
- •17.3. Элементарная кинетическая теория теплопроводности,
- •17.4. Явления переноса в ультраразреженных газах
- •Трение и теплопроводность ультраразреженных газов
- •Тепловая и изотермическая эффузия
- •18.1. Атмосфера как открытая система и как открытая книга
- •18.2. Состав и структура атмосферы Земли.
- •18.3. Термофизическая модель атмосферы
- •18.4. Парниковый эффект
- •Сущность парникового эффекта
- •Парниковые газы
- •Проблема глобального потепления
- •Киотский протокол
- •18.5. Инверсия температуры в стратосфере. Озоносфера Земли
- •Мониторинг озонового слоя
- •Монреальский Протокол
- •18.6. Концепция «ядерной зимы»
- •«Ядерная зима» Сценарии ядерной войны
- •Огненные смерчи – суперподъемники
- •Антипарниковый эффект
- •Глобальный характер климатических последствий
- •Список литературы
- •Общая физика. Молекулярная физика
- •660041, Г. Красноярск, пр. Свободный, 79
Связь между теплоёмкостями и(общий случай)
Описание системы
Рассматриваемая термодинамическая система является закрытой, т. е. она может обмениваться энергией с окружающей средой.
Актуальная информация о процессе и системе
• Процесс теплообмена является квазистатическим.
• Известно термическое уравнение
состояния данной системы
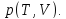
• Известно калорическое уравнение
состояния

Постановка задачи
Найти соотношение между молярными
теплоёмкостями
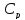 и
и
Вывод формулы
• Воспользовавшись записью первого начала термодинамики в дифференциальной форме (9.2), получим выражение для теплоёмкости произвольного процесса:
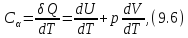
• Представим полный дифференциал
внутренней энергии через частные
производные по параметрам
 и
и :
:

После чего формулу (9.6) перепишем в виде
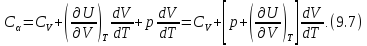
Соотношение (9.7) имеет самостоятельное
значение, поскольку определяет
теплоёмкость
 в любом термодинамическом процессе и
для любой макроскопической системы,
если известны калорическое и термическое
уравнения состояния.
в любом термодинамическом процессе и
для любой макроскопической системы,
если известны калорическое и термическое
уравнения состояния.
• Рассмотрим процесс при постоянном
давлении
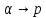 и получим общее соотношение между
и получим общее соотношение между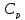 и
и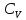 .
.
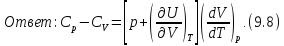
Исходя из полученной формулы, можно
легко найти связь между теплоемкостями
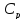 и
и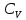 в идеальном газе. Этим мы и займемся.
Впрочем, ответ уже известен, мы его
активно использовали в 7.5.
в идеальном газе. Этим мы и займемся.
Впрочем, ответ уже известен, мы его
активно использовали в 7.5.
Уравнение Роберта Майера
Выразим частные производные в правой части уравнения (9.8), с помощью термического и калорического уравнений, записанных для одного моля идеального газа. Внутренняя энергия идеального газа зависит только от температуры и не зависит от объёма газа, следовательно

Из термического уравнения легко получить
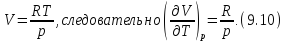
Подставим (9.9) и (9.10) в (9.8), тогда

Окончательно запишем
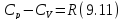
Вы, надеюсь, узнали (9.11). Да, конечно, это уравнение Майера. Еще раз напомним, что уравнение Майера справедливо только для идеального газа.
9.3. Политропические процессы в идеальном газе
Как отмечалось выше первое начало
термодинамики можно использовать для
вывода уравнений процессов, происходящих
в газе. Большое практическое применение
находит класс процессов, называемых
политропическими. Политропическим
называется процесс, проходящий
при постоянной теплоемкости
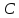 .
.
Уравнение процесса задается функциональной
связью двух макроскопических параметров,
описывающих систему. На соответствующей
координатной плоскости
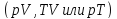 уравнение процесса наглядно представляется
в виде графика - кривой процесса. Кривая,
изображающая политропический процесс,
называется политропой. Уравнение
политропического процесса для любого
вещества может быть получено на основе
первого начала термодинамики с
использованием его термического и
калорического уравнений состояния.
Продемонстрируем, как это делается на
примере вывода уравнения процесса для
идеального газа.
уравнение процесса наглядно представляется
в виде графика - кривой процесса. Кривая,
изображающая политропический процесс,
называется политропой. Уравнение
политропического процесса для любого
вещества может быть получено на основе
первого начала термодинамики с
использованием его термического и
калорического уравнений состояния.
Продемонстрируем, как это делается на
примере вывода уравнения процесса для
идеального газа.
Вывод уравнения политропического процесса в идеальном газе
• Требование постоянства теплоёмкости
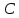 в процессе позволяет записать первое
начало термодинамики в виде
в процессе позволяет записать первое
начало термодинамики в виде
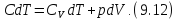
• Используя уравнение Майера (9.11) и
уравнение состояния идеального газа,
получаем следующее выражение для


• Разделив уравнение (9.12) на Tи подставив в него (9.13) придем к выражению
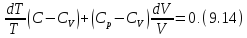
• Разделив (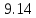 )
на
)
на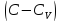 ,
находим
,
находим

• Интегрированием (9.15), получаем
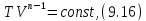
где
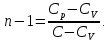
Это уравнение политропы в переменных
Исключая из уравнения ( )
) ,
с помощью равенства
,
с помощью равенства получаем уравнение политропы в переменных
получаем уравнение политропы в переменных
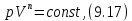
где

Параметр
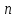 называется показателем политропы,
который может принимать согласно (
называется показателем политропы,
который может принимать согласно (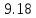 )
самые разные значения, положительные
и отрицательные, целые и дробные. За
формулой (
)
самые разные значения, положительные
и отрицательные, целые и дробные. За
формулой ( )
скрывается множество процессов. Известные
вам изобарный, изохорный и изотермический
процессы являются частными случаями
политропического.
)
скрывается множество процессов. Известные
вам изобарный, изохорный и изотермический
процессы являются частными случаями
политропического.
К этому классу процессов относится
также адиабатный или адиабатический
процесс. Адиабатным называется
процесс, проходящий без теплообмена
( ).
Реализовать такой процесс можно двумя
способами. Первый способ предполагает
наличие у системы теплоизолирующей
оболочки, способной изменять свой объем.
Второй – заключается в осуществлении
столь быстрого процесса, при котором
система не успевает обмениваться
количеством теплоты с окружающей средой.
Процесс распространения звука в газе
можно считать адиабатным благодаря его
большой скорости.
).
Реализовать такой процесс можно двумя
способами. Первый способ предполагает
наличие у системы теплоизолирующей
оболочки, способной изменять свой объем.
Второй – заключается в осуществлении
столь быстрого процесса, при котором
система не успевает обмениваться
количеством теплоты с окружающей средой.
Процесс распространения звука в газе
можно считать адиабатным благодаря его
большой скорости.
Из определения теплоемкости следует,
что в адиабатическом процессе
 .
Согласно
.
Согласно

где
 – показатель адиабаты.
– показатель адиабаты.
В этом случае уравнение политропы принимает вид
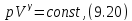
Уравнение адиабатного процесса (9.20)
называют также уравнением Пуассона,
поэтому параметр
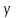 часто именуют постоянной Пуассона.
Постоянная
часто именуют постоянной Пуассона.
Постоянная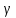 является важной характеристикой газов.
Из опыта следует, что ее значения для
разных газов лежат в интервале 1,30 ÷
1,67, поэтому на диаграмме процессов
является важной характеристикой газов.
Из опыта следует, что ее значения для
разных газов лежат в интервале 1,30 ÷
1,67, поэтому на диаграмме процессов адиабата «падает» более круто, чем
изотерма.
адиабата «падает» более круто, чем
изотерма.
Графики политропических процессов для
различных значений
 представлены на рис. 9.1.
представлены на рис. 9.1.
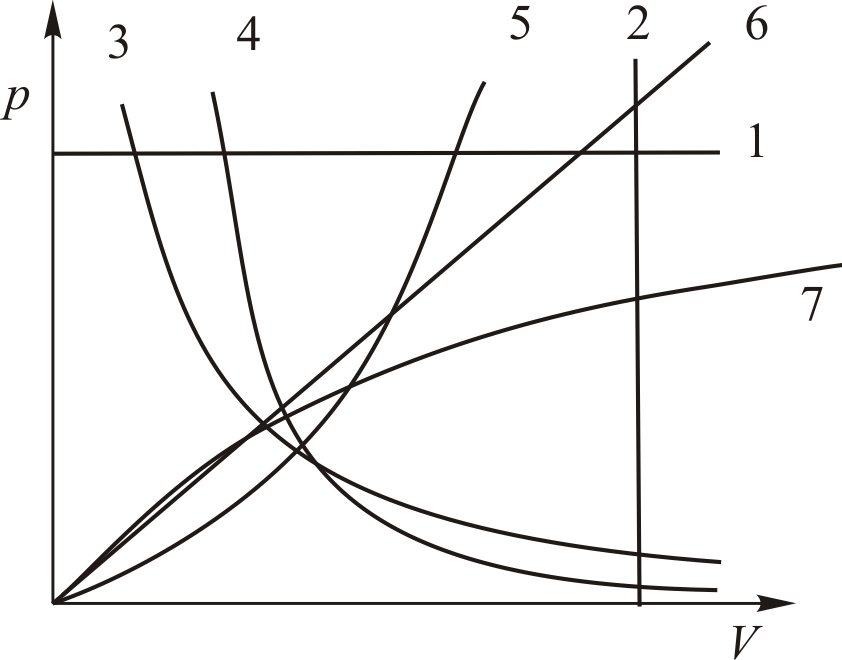
Рис. 9.1.
На рис. 9.1 графики процессов пронумерованы в соответствии с табл. 9.1.
Таблица. 9.1.
|
Номер политропы на рис. 9.1 |
Значение показателя политропы |
Уравнение
политропы ( |
Название процесса |
|
1 |
|
|
изобарический |
|
2 |
|
|
изохорический |
|
3 |
|
|
изотермический |
|
4 |
|
|
адиабатический |
|
5 |
|
|
- |
|
6 |
|
|
- |
|
7 |
|
|
- |
Знание показателя политропы
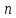 позволяет без особого труда рассчитать
теплоёмкость системы. Знание теплоёмкости
в свою очередь даёт возможность рассчитать
количество теплоты, сообщённое
макросистеме в данном политропическом
процессе. Действительно, из
позволяет без особого труда рассчитать
теплоёмкость системы. Знание теплоёмкости
в свою очередь даёт возможность рассчитать
количество теплоты, сообщённое
макросистеме в данном политропическом
процессе. Действительно, из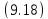 следует
следует
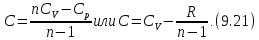
Тогда, бесконечно малое количество теплоты, сообщённое макросистеме в политропическом процессе равно
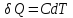 .
.
Соответственно полное количество
теплоты, полученное системой при
изменении её температуры от
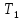 до
до ,
определяется простой формулой
,
определяется простой формулой
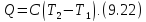
Зная
 ,
можно определить макроскопическую
работу
,
можно определить макроскопическую
работу ,
совершенную системой в политропическом
процессе, с помощью уравнения первого
начала в интегральной форме и формулы
,
совершенную системой в политропическом
процессе, с помощью уравнения первого
начала в интегральной форме и формулы



Таким образом, мы можем получить исчерпывающую информацию об энергообмене системы с окружающей средой.
Теперь уместно поставить следующие вопросы. Что делать, если процесс не политропический? Можно ли глядя на график процесса, догадаться, что это не политропа?
Иногда можно. Взгляните на рис. 9.2. Это уж точно не политропы.
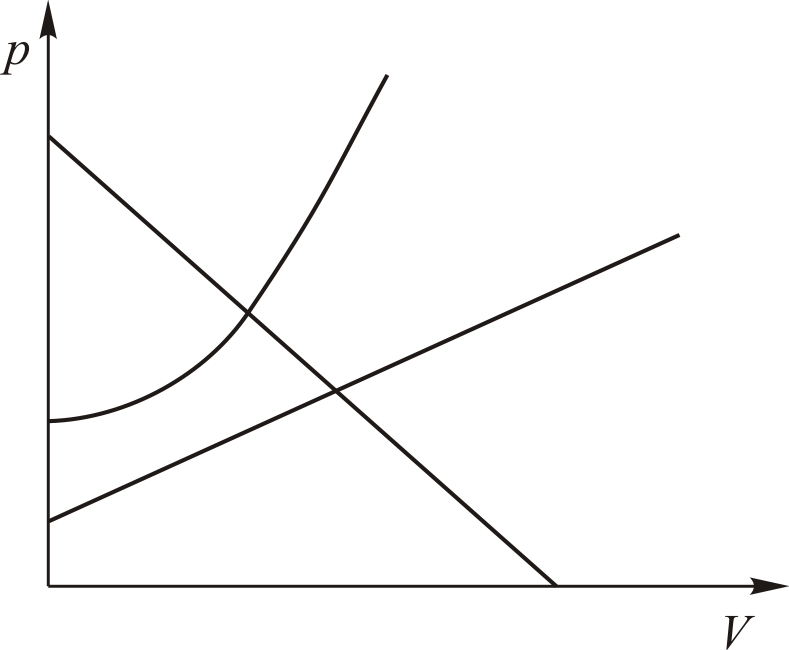
Рис. 9.2.
Для подобных процессов количество
теплоты рассчитать не так просто как
в случае политропных процессов
 так как теплоёмкость системы будет
зависеть от температуры
так как теплоёмкость системы будет
зависеть от температуры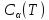 .
Соответственно
.
Соответственно
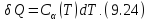
Полное количество теплоты, полученное
системой в произвольном процессе, можно
рассчитать только интегрированием
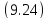
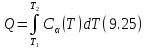
Вычисление теплоемкости и количества теплоты в различных процессах является внутренней подзадачей многих учебных задач, с которыми вы встретитесь при изучении термодинамики.

 )
)
 st
st