
- •О.И.Москвич общая физика Молекулярная физика
- •Предисловие
- •I. Основы молекулярной статистики
- •1.1. Предмет молекулярной физики
- •1.2. Масштабы физических величин в молекулярном мире
- •1.3. Теоретические и экспериментальные методы молекулярной физики
- •1.4. Эволюция молекулярных систем. Порядок и хаос
- •1.5. Принципы организации статистического и термодинамического методов изучения макросистем
- •Статистический метод
- •Термодинамический метод
- •2.1. Классификация моделей молекулярных систем
- •2.2. Идеальные статистические системы
- •Модели идеальных систем
- •2.3. Элементарные сведения из теории вероятностей
- •Случайные события
- •Определения вероятности событий
- •Статистическое или частотное определение вероятности.
- •Теоремы теории вероятностей
- •Условие нормировки вероятности
- •Случайная величина
- •Плотность вероятности
- •2.4. Основные понятия молекулярной статистики
- •Вероятность микроскопического состояния. Статистический ансамбль
- •Статистические постулаты
- •Комментарий к постулату равновероятности
- •Эргодическая гипотеза:
- •Постулат равновероятности доступных микроскопических состояний изолированной системы в состоянии термодинамического
- •Комментарий к эргодической гипотезе
- •Вероятность макроскопического состояния
- •3.1. Вывод закона распределения вероятностей Описание системы
- •Актуальные свойства модели системы
- •Постановка задачи
- •Вывод закона
- •Математические преобразования больших чисел. Введение общепринятых обозначений
- •Формула для вероятности макросостояния. Закон Бернулли, или биномиальное распределение.
- •3.2. Графическое представление биномиального распределения.
- •Основные характеристики биномиального распределении.
- •3.3. Предельные случаи биномиального распределения
- •4.1. Распределение энергии в статической системе
- •Вывод распределения Гиббса
- •4.2. Вывод распределения Максвелла
- •4.3. Плотность вероятности и характерные скорости распределения Максвелла
- •4.4. Распределение Максвелла по компонентам скорости
- •4.5. Экспериментальная проверка распределения Максвелла
- •5.1. Вывод формулы для давления идеального газа
- •5.2. Основное уравнение молекулярно-кинетической теории. Газовые законы
- •5.3. Уравнение эффузии
- •5.4. Измерение давления
- •5.5. Определение и измерение температуры
- •5.6. Построение эмпирической шкалы на основе газового термометра
- •Преимущества газовой шкалы температур
- •Построение газовой шкалы температур
- •Термодинамическая шкала температур
- •6.1. Распределение молекул по энергиям во внешнем потенциальном поле
- •6.2. Формула Больцмана для концентрации молекул в потенциальном поле
- •6.3. Зависимость концентрации молекул газа от координат в однородном гравитационном поле и поле центробежных сил
- •Графическое представление зависимости концентрации молекул от координат
- •6.4. Экспериментальное подтверждение распределения Больцмана: опыты Перрена
- •Получение макромолекул
- •Выделение частиц одинакового размера
- •Измерение диаметра макромолекулы
- •Подсчёт количества частиц на определённой высоте
- •6.5. Барометрическая формула
- •6.6. Закон распределения Максвелла – Больцмана
- •7.1. Формулировка теоремы и её доказательство Формулировка теоремы
- •Актуальные свойства модели статистической системы
- •Доказательство теоремы
- •7.2. Статистические степени свободы
- •7.3. Броуновское движение и его статистическое описание
- •Поступательное броуновское движение
- •Вращательное броуновское движение
- •7.4. Броуновский критерий точности физических измерений
- •7.5. Классическая теория теплоёмкости многоатомных газов. Область её применимости
- •7.6. Классическая теория теплоёмкости твёрдых тел.
- •7.7. Применение квантовых моделей в теории теплоёмкости твёрдых тел
- •Модель Эйнштейна
- •Модель Дебая
- •II. Основы термодинамики
- •8.1. Четыре постулата термодинамики
- •8.2. Нулевое (общее) начало термодинамики
- •Формулировка постулата
- •Свойство транзитивности термодинамического равновесия
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •8.3. Макроскопические процессы
- •8.4. Функция состояния
- •Математические свойства функции состояния
- •8.5. Внутренняя энергия системы. Работа и теплота Внутренняя энергия
- •Макроскопическая работа и теплота
- •8.6. Калорическое и термическое уравнения состояния
- •9.1. Первое начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •9.2. Теплоёмкость
- •Связь между теплоёмкостями и(общий случай)
- •Уравнение Роберта Майера
- •9.3. Политропические процессы в идеальном газе
- •Вывод уравнения политропического процесса в идеальном газе
- •9.4. Тепловые машины и их эффективность.
- •Принципиальная схема работы тепловой машины
- •Показатели эффективности тепловых машин
- •10.1. Цикл Карно
- •Расчёт кпд машины Карно
- •10.2. Теоремы Карно
- •Термодинамическая шкала температур
- •10.3. Метод циклов
- •Задача о нахождении зависимости внутренней энергии макроскопического тела от его объема
- •10.4. Неравенство Клаузиуса. Определение энтропии
- •10.5. Оценка эффективности тепловых машин сверху
- •Примеры оценок эффективности тепловых машин сверху кпд бензинового двигателя внутреннего сгорания
- •Кпд паровой турбины
- •Киэ бытового холодильника
- •Киэ кондиционера воздуха
- •Киэ теплового насоса
- •Тепловое загрязнение окружающей среды
- •11.1. Формулировки второго начала термодинамики
- •Энтропийная формулировка второго начала термодинамики Часть первая
- •Часть вторая
- •Информационное содержание постулата
- •11.2. Закон возрастания энтропии в изолированных системах
- •Демон Максвелла
- •Формулировка парадокса
- •Разрешение парадокса
- •11.3. Область применимости второго начала термодинамики
- •Статистический характер второго начала
- •11.4. Концепция тепловой смерти Вселенной
- •Концепция Клаузиуса
- •Флуктуационная гипотеза Больцмана
- •Несостоятельность концепции тепловой смерти Вселенной
- •11.5. Энтропия и её изменение в различных процессах
- •Постановка задачи
- •Описание системы
- •Актуальные свойства системы и процесса
- •Решение
- •Парадокс Гиббса Описание
- •По разные стороны перегородки находятся различные газы. После устранения перегородки начнется диффузия.
- •По разные стороны перегородки находится один и тот же газ.
- •12.1. Термодинамические функции
- •Свободная энергия
- •Термодинамический потенциал Гиббса
- •12.3. Условия термодинамической устойчивости макроскопических систем. Принцип Ле Шателье-Брауна
- •Принцип Ле Шателье-Брауна
- •Проведение полного термодинамического анализа вещества на полуэмпирической основе
- •12.4. Третье начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата (варианты)
- •Информационное содержание постулата
- •Статус постулата
- •Следствия третьего начала
- •III. Физика реальных макросистем
- •13.1. Твердые тела
- •13.2. Реальные газы и жидкости
- •Потенциал межмолекулярного взаимодействия
- •Природа межмолекулярного взаимодействия
- •Структура жидкостей
- •13.3. Переход из газообразного состояния в жидкое.
- •13.4. Уравнения состояния реального газа
- •13.5. Модель газа Ван-дер-Ваальса. Уравнение Ван-дер-Ваальса
- •14.1. Изотермы газа Ван-дер-Ваальса
- •14.2. Критическое состояние вещества
- •Закон соответственных состояний
- •Свойства вещества в критическом состоянии
- •Анализ применения уравнения Ван-дер-Ваальса для описания свойств реальных газов
- •14.3. Внутренняя энергия газа Ван-дер-Ваальса
- •14.4. Эффект Джоуля-Томсона Основные определения
- •Описание процесса Джоуля-Томсона
- •Сущность эффекта Джоуля-Томсона
- •Расчет дифференциального эффекта Джоуля-Томсона
- •Расчет интегрального эффекта Джоуля-Томсона
- •14.5. Методы получения низких температур
- •Метод противоточного обмена теплотой
- •Метод адиабатического размагничивания
- •15.1. Условие равновесия фаз химически однородного вещества
- •15.2. Классификация фазовых переходов по Эренфесту
- •Фазовые переходы первого рода
- •Фазовые переходы второго рода
- •15.3. Фазовые переходы первого рода. Диаграмма состояний
- •15.4. Уравнение Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса методом циклов
- •Актуальные свойства процесса
- •Постановка задачи
- •Вывод уравнения
- •15.5. Диаграмма состояний гелия. Сверхтекучесть жидкого гелия.
- •16.1. Релаксационные процессы в молекулярных системах
- •16.2. Стационарные уравнения переноса в газах, жидкостях и твердых телах
- •Уравнение теплопроводности
- •Уравнение самодиффузии
- •Уравнение внутреннего трения
- •16.3. Внутренняя теплопроводность и внешняя теплопередача
- •Стационарное распределение температуры в бесконечной плоско-параллельной пластинке
- •Стационарное распределение температуры между двумя концентрическими бесконечно длинными цилиндрами
- •Стационарное распределение температуры между двумя концентрическими сферами
- •Внешняя теплопередача
- •17.1. Столкновения молекул и их количественные характеристики
- •Эффективное сечение молекул
- •Средняя длина свободного пробега молекулы
- •Кинематические параметры и
- •17.2. Обобщенное уравнение переноса
- •Вывод обобщенного уравнения процесса Описание системы
- •Актуальные свойства модели процесса
- •Постановка задачи
- •Вывод уравнения
- •17.3. Элементарная кинетическая теория теплопроводности,
- •17.4. Явления переноса в ультраразреженных газах
- •Трение и теплопроводность ультраразреженных газов
- •Тепловая и изотермическая эффузия
- •18.1. Атмосфера как открытая система и как открытая книга
- •18.2. Состав и структура атмосферы Земли.
- •18.3. Термофизическая модель атмосферы
- •18.4. Парниковый эффект
- •Сущность парникового эффекта
- •Парниковые газы
- •Проблема глобального потепления
- •Киотский протокол
- •18.5. Инверсия температуры в стратосфере. Озоносфера Земли
- •Мониторинг озонового слоя
- •Монреальский Протокол
- •18.6. Концепция «ядерной зимы»
- •«Ядерная зима» Сценарии ядерной войны
- •Огненные смерчи – суперподъемники
- •Антипарниковый эффект
- •Глобальный характер климатических последствий
- •Список литературы
- •Общая физика. Молекулярная физика
- •660041, Г. Красноярск, пр. Свободный, 79
Описание процесса Джоуля-Томсона
В опыте используется теплоизолированная
трубка, разделенная посередине пористой
перегородкой, например, пробкой из ваты.
По обе стороны пробки находится реальный
газ (рис. 14.2). Под действием разности
давлений, создаваемой с помощью поршней
П1и П2, исследуемый газ
медленно протекает через пробку из
одной части трубки в другую. Давление
газа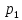 и
и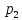 по разным сторонам пробки поддерживаются
постоянными.
по разным сторонам пробки поддерживаются
постоянными.
При стационарном течении по одну сторону
перегородки устанавливается постоянная
температура
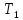 ,
а по другую – постоянная температура
,
а по другую – постоянная температура .
Для измерения
.
Для измерения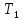 и
и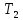 обычно используют термопары.
обычно используют термопары.

Рис. 14.2.
Несмотря на медленность течения, этот процесс необратим, так как система в целом не является равновесной. Энтропия в изолированной системе возрастает.
Попробуем разобраться, какая функция
состояния в этом процессе остается
неизменной. Пусть один моль газа при
давлении
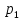 (до пробки) занимает объем
(до пробки) занимает объем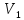 .
Для того, чтобы переместить этот газ
через пробку надо затратить работу
внешних сил
.
Для того, чтобы переместить этот газ
через пробку надо затратить работу
внешних сил .
Расширяясь после прохождения пробки
до объема
.
Расширяясь после прохождения пробки
до объема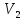 при давлении
при давлении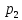 ,
сам газ совершает работу
,
сам газ совершает работу .
.
Запишем уравнение первого начала
термодинамики применительно к
рассматриваемому процессу с учетом
наличия теплоизолирующей оболочки
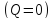

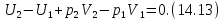
или, что, то же самое,
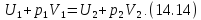
Посмотрите внимательно на выражение (14.14). Узнаёте? Конечно, здесь написано, что энтальпия «до того» равно энтальпии «после того». Таким образом, в процессе Джоуля-Томсона
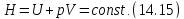
Полученное условие постоянства энтальпии является принципиально важным для вычисления эффекта Джоуля-Томсона.
Сущность эффекта Джоуля-Томсона
Природу этого эффекта можно понять на
основе анализа зависимости потенциала
межмолекулярного взаимодействия от
расстояния между частицами (рис. 13.2).
Наличие минимума на кривой Леннарда-Джонса
указывает на то, что слева от
 производная
производная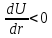 ,
правее
,
правее .
.
Поскольку сумма потенциальной энергии взаимодействия и кинетической энергии величина постоянная, то получаем простое соотношение

Теперь рассмотрим два случая.
1. Пусть
температура газа
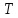 и его плотность
и его плотность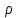 настолько велики, что среднее расстояние
между молекулами меньше чем
настолько велики, что среднее расстояние
между молекулами меньше чем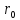 :
: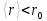 .
Тогда
.
Тогда
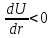 ,
а
,
а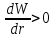 ,
это значит, что кинетическая энергия
газа при расширении увеличивается, т.е.
его температура повышается. В этом и
заключается суть отрицательного эффекта
Джоуля-Томсона.
,
это значит, что кинетическая энергия
газа при расширении увеличивается, т.е.
его температура повышается. В этом и
заключается суть отрицательного эффекта
Джоуля-Томсона.
2. Пусть
температура газа
 и его плотность
и его плотность настолько низки, что
настолько низки, что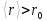 .
Тогда
.
Тогда
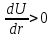 ,
а
,
а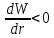 ,
следовательно, кинетическая энергия
газа при расширении уменьшается, т.е.
его температура понижается. Наблюдается
положительный эффект Джоуля-Томсона.
,
следовательно, кинетическая энергия
газа при расширении уменьшается, т.е.
его температура понижается. Наблюдается
положительный эффект Джоуля-Томсона.
Следовательно,
один и тот же газ при одних условиях (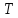 ,
, – «велики») будет после протекания
через пробку нагреваться, а при других
условиях (
– «велики») будет после протекания
через пробку нагреваться, а при других
условиях (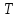 ,
,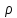 – «малы») – охлаждаться. Из приведенных
рассуждений также очевидно, что в
идеальном газе эффект Джоуля-Томсона
невозможен.
– «малы») – охлаждаться. Из приведенных
рассуждений также очевидно, что в
идеальном газе эффект Джоуля-Томсона
невозможен.
Расчет дифференциального эффекта Джоуля-Томсона
Получим формулу эффекта Джоуля-Томсона
методом термодинамических потенциалов.
Выберем в качестве независимых переменных
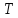 и
и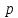 и запишем условие (14.15) в дифференциальной
форме
и запишем условие (14.15) в дифференциальной
форме

Сделаем замену
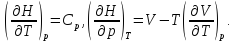
Последнее равенство получается из (12.10) и соотношения Максвелла, имеющего вид

Окончательно из (14.16) получаем
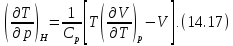
Это и есть искомая формула для дифференциального эффекта Джоуля-Томсона.
Температура, при которой
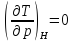 ,
т.е. происходит изменение знака эффекта
Джоуля-Томсона, называется температурой
инверсии.
,
т.е. происходит изменение знака эффекта
Джоуля-Томсона, называется температурой
инверсии.
Вычисление величины эффекта по формуле
(14.17) неизбежно связано с вычислением
производной
 ,
что требует знания термического уравнения
состояния исследуемого реального газа.
При вычислении эффекта в разреженном
газе Ван-дер-Ваальса получается следующее
выражение
,
что требует знания термического уравнения
состояния исследуемого реального газа.
При вычислении эффекта в разреженном
газе Ван-дер-Ваальса получается следующее
выражение

Приравняв к нулю правую часть (14.18), получим температуру инверсии газа Ван-дер-Ваальса:
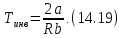
Температура инверсии определяется
индивидуальными параметрами исследуемого
газа. Если температура газа больше чем
 ,
то газ при расширении нагревается
(отрицательный эффект), а если его
,
то газ при расширении нагревается
(отрицательный эффект), а если его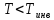 ,
то газ охлаждается (положительный
эффект).
,
то газ охлаждается (положительный
эффект).
Для большинства газов
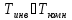 .
Например, для кислорода
.
Например, для кислорода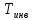 =1063K, для углекислого
газа
=1063K, для углекислого
газа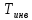 = 2073K. Поэтому, если
начальная температура газов равна
комнатной
= 2073K. Поэтому, если
начальная температура газов равна
комнатной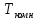 ,
то для них наблюдается положительный
эффект: газы охлаждаются.
,
то для них наблюдается положительный
эффект: газы охлаждаются.
Для таких газов как водород и гелий
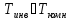 .
Для водорода
.
Для водорода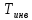 = 200K. Эти газы в процессе
Джоуля – Томсона при начальной комнатной
температуре нагреваются (отрицательный
эффект). Заметим, что в дифференциальном
эффекте изменение температуры для
обычных газов составляет сотые или
десятые долиK. В связи
с этим измерение эффекта представляет
не простую экспериментальную задачу.
= 200K. Эти газы в процессе
Джоуля – Томсона при начальной комнатной
температуре нагреваются (отрицательный
эффект). Заметим, что в дифференциальном
эффекте изменение температуры для
обычных газов составляет сотые или
десятые долиK. В связи
с этим измерение эффекта представляет
не простую экспериментальную задачу.
