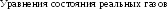- •О.И.Москвич общая физика Молекулярная физика
- •Предисловие
- •I. Основы молекулярной статистики
- •1.1. Предмет молекулярной физики
- •1.2. Масштабы физических величин в молекулярном мире
- •1.3. Теоретические и экспериментальные методы молекулярной физики
- •1.4. Эволюция молекулярных систем. Порядок и хаос
- •1.5. Принципы организации статистического и термодинамического методов изучения макросистем
- •Статистический метод
- •Термодинамический метод
- •2.1. Классификация моделей молекулярных систем
- •2.2. Идеальные статистические системы
- •Модели идеальных систем
- •2.3. Элементарные сведения из теории вероятностей
- •Случайные события
- •Определения вероятности событий
- •Статистическое или частотное определение вероятности.
- •Теоремы теории вероятностей
- •Условие нормировки вероятности
- •Случайная величина
- •Плотность вероятности
- •2.4. Основные понятия молекулярной статистики
- •Вероятность микроскопического состояния. Статистический ансамбль
- •Статистические постулаты
- •Комментарий к постулату равновероятности
- •Эргодическая гипотеза:
- •Постулат равновероятности доступных микроскопических состояний изолированной системы в состоянии термодинамического
- •Комментарий к эргодической гипотезе
- •Вероятность макроскопического состояния
- •3.1. Вывод закона распределения вероятностей Описание системы
- •Актуальные свойства модели системы
- •Постановка задачи
- •Вывод закона
- •Математические преобразования больших чисел. Введение общепринятых обозначений
- •Формула для вероятности макросостояния. Закон Бернулли, или биномиальное распределение.
- •3.2. Графическое представление биномиального распределения.
- •Основные характеристики биномиального распределении.
- •3.3. Предельные случаи биномиального распределения
- •4.1. Распределение энергии в статической системе
- •Вывод распределения Гиббса
- •4.2. Вывод распределения Максвелла
- •4.3. Плотность вероятности и характерные скорости распределения Максвелла
- •4.4. Распределение Максвелла по компонентам скорости
- •4.5. Экспериментальная проверка распределения Максвелла
- •5.1. Вывод формулы для давления идеального газа
- •5.2. Основное уравнение молекулярно-кинетической теории. Газовые законы
- •5.3. Уравнение эффузии
- •5.4. Измерение давления
- •5.5. Определение и измерение температуры
- •5.6. Построение эмпирической шкалы на основе газового термометра
- •Преимущества газовой шкалы температур
- •Построение газовой шкалы температур
- •Термодинамическая шкала температур
- •6.1. Распределение молекул по энергиям во внешнем потенциальном поле
- •6.2. Формула Больцмана для концентрации молекул в потенциальном поле
- •6.3. Зависимость концентрации молекул газа от координат в однородном гравитационном поле и поле центробежных сил
- •Графическое представление зависимости концентрации молекул от координат
- •6.4. Экспериментальное подтверждение распределения Больцмана: опыты Перрена
- •Получение макромолекул
- •Выделение частиц одинакового размера
- •Измерение диаметра макромолекулы
- •Подсчёт количества частиц на определённой высоте
- •6.5. Барометрическая формула
- •6.6. Закон распределения Максвелла – Больцмана
- •7.1. Формулировка теоремы и её доказательство Формулировка теоремы
- •Актуальные свойства модели статистической системы
- •Доказательство теоремы
- •7.2. Статистические степени свободы
- •7.3. Броуновское движение и его статистическое описание
- •Поступательное броуновское движение
- •Вращательное броуновское движение
- •7.4. Броуновский критерий точности физических измерений
- •7.5. Классическая теория теплоёмкости многоатомных газов. Область её применимости
- •7.6. Классическая теория теплоёмкости твёрдых тел.
- •7.7. Применение квантовых моделей в теории теплоёмкости твёрдых тел
- •Модель Эйнштейна
- •Модель Дебая
- •II. Основы термодинамики
- •8.1. Четыре постулата термодинамики
- •8.2. Нулевое (общее) начало термодинамики
- •Формулировка постулата
- •Свойство транзитивности термодинамического равновесия
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •8.3. Макроскопические процессы
- •8.4. Функция состояния
- •Математические свойства функции состояния
- •8.5. Внутренняя энергия системы. Работа и теплота Внутренняя энергия
- •Макроскопическая работа и теплота
- •8.6. Калорическое и термическое уравнения состояния
- •9.1. Первое начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •9.2. Теплоёмкость
- •Связь между теплоёмкостями и(общий случай)
- •Уравнение Роберта Майера
- •9.3. Политропические процессы в идеальном газе
- •Вывод уравнения политропического процесса в идеальном газе
- •9.4. Тепловые машины и их эффективность.
- •Принципиальная схема работы тепловой машины
- •Показатели эффективности тепловых машин
- •10.1. Цикл Карно
- •Расчёт кпд машины Карно
- •10.2. Теоремы Карно
- •Термодинамическая шкала температур
- •10.3. Метод циклов
- •Задача о нахождении зависимости внутренней энергии макроскопического тела от его объема
- •10.4. Неравенство Клаузиуса. Определение энтропии
- •10.5. Оценка эффективности тепловых машин сверху
- •Примеры оценок эффективности тепловых машин сверху кпд бензинового двигателя внутреннего сгорания
- •Кпд паровой турбины
- •Киэ бытового холодильника
- •Киэ кондиционера воздуха
- •Киэ теплового насоса
- •Тепловое загрязнение окружающей среды
- •11.1. Формулировки второго начала термодинамики
- •Энтропийная формулировка второго начала термодинамики Часть первая
- •Часть вторая
- •Информационное содержание постулата
- •11.2. Закон возрастания энтропии в изолированных системах
- •Демон Максвелла
- •Формулировка парадокса
- •Разрешение парадокса
- •11.3. Область применимости второго начала термодинамики
- •Статистический характер второго начала
- •11.4. Концепция тепловой смерти Вселенной
- •Концепция Клаузиуса
- •Флуктуационная гипотеза Больцмана
- •Несостоятельность концепции тепловой смерти Вселенной
- •11.5. Энтропия и её изменение в различных процессах
- •Постановка задачи
- •Описание системы
- •Актуальные свойства системы и процесса
- •Решение
- •Парадокс Гиббса Описание
- •По разные стороны перегородки находятся различные газы. После устранения перегородки начнется диффузия.
- •По разные стороны перегородки находится один и тот же газ.
- •12.1. Термодинамические функции
- •Свободная энергия
- •Термодинамический потенциал Гиббса
- •12.3. Условия термодинамической устойчивости макроскопических систем. Принцип Ле Шателье-Брауна
- •Принцип Ле Шателье-Брауна
- •Проведение полного термодинамического анализа вещества на полуэмпирической основе
- •12.4. Третье начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата (варианты)
- •Информационное содержание постулата
- •Статус постулата
- •Следствия третьего начала
- •III. Физика реальных макросистем
- •13.1. Твердые тела
- •13.2. Реальные газы и жидкости
- •Потенциал межмолекулярного взаимодействия
- •Природа межмолекулярного взаимодействия
- •Структура жидкостей
- •13.3. Переход из газообразного состояния в жидкое.
- •13.4. Уравнения состояния реального газа
- •13.5. Модель газа Ван-дер-Ваальса. Уравнение Ван-дер-Ваальса
- •14.1. Изотермы газа Ван-дер-Ваальса
- •14.2. Критическое состояние вещества
- •Закон соответственных состояний
- •Свойства вещества в критическом состоянии
- •Анализ применения уравнения Ван-дер-Ваальса для описания свойств реальных газов
- •14.3. Внутренняя энергия газа Ван-дер-Ваальса
- •14.4. Эффект Джоуля-Томсона Основные определения
- •Описание процесса Джоуля-Томсона
- •Сущность эффекта Джоуля-Томсона
- •Расчет дифференциального эффекта Джоуля-Томсона
- •Расчет интегрального эффекта Джоуля-Томсона
- •14.5. Методы получения низких температур
- •Метод противоточного обмена теплотой
- •Метод адиабатического размагничивания
- •15.1. Условие равновесия фаз химически однородного вещества
- •15.2. Классификация фазовых переходов по Эренфесту
- •Фазовые переходы первого рода
- •Фазовые переходы второго рода
- •15.3. Фазовые переходы первого рода. Диаграмма состояний
- •15.4. Уравнение Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса методом циклов
- •Актуальные свойства процесса
- •Постановка задачи
- •Вывод уравнения
- •15.5. Диаграмма состояний гелия. Сверхтекучесть жидкого гелия.
- •16.1. Релаксационные процессы в молекулярных системах
- •16.2. Стационарные уравнения переноса в газах, жидкостях и твердых телах
- •Уравнение теплопроводности
- •Уравнение самодиффузии
- •Уравнение внутреннего трения
- •16.3. Внутренняя теплопроводность и внешняя теплопередача
- •Стационарное распределение температуры в бесконечной плоско-параллельной пластинке
- •Стационарное распределение температуры между двумя концентрическими бесконечно длинными цилиндрами
- •Стационарное распределение температуры между двумя концентрическими сферами
- •Внешняя теплопередача
- •17.1. Столкновения молекул и их количественные характеристики
- •Эффективное сечение молекул
- •Средняя длина свободного пробега молекулы
- •Кинематические параметры и
- •17.2. Обобщенное уравнение переноса
- •Вывод обобщенного уравнения процесса Описание системы
- •Актуальные свойства модели процесса
- •Постановка задачи
- •Вывод уравнения
- •17.3. Элементарная кинетическая теория теплопроводности,
- •17.4. Явления переноса в ультраразреженных газах
- •Трение и теплопроводность ультраразреженных газов
- •Тепловая и изотермическая эффузия
- •18.1. Атмосфера как открытая система и как открытая книга
- •18.2. Состав и структура атмосферы Земли.
- •18.3. Термофизическая модель атмосферы
- •18.4. Парниковый эффект
- •Сущность парникового эффекта
- •Парниковые газы
- •Проблема глобального потепления
- •Киотский протокол
- •18.5. Инверсия температуры в стратосфере. Озоносфера Земли
- •Мониторинг озонового слоя
- •Монреальский Протокол
- •18.6. Концепция «ядерной зимы»
- •«Ядерная зима» Сценарии ядерной войны
- •Огненные смерчи – суперподъемники
- •Антипарниковый эффект
- •Глобальный характер климатических последствий
- •Список литературы
- •Общая физика. Молекулярная физика
- •660041, Г. Красноярск, пр. Свободный, 79
13.3. Переход из газообразного состояния в жидкое.
Экспериментальные изотермы
Голландский ученый Ван Марум еще в XVIIIвеке, занимаясь проверкой применимости
закона Бойля-Мариотта к газу аммиаку в
широком диапазоне температур и давлений,
установил удивительную закономерность.
Производя изотермическое сжатие газа
в сосуде под поршнем, он обнаружил, что
достигая некоторого определенного
давления (в его опыте около 7 атм),
изотермический процесс сжатия становится
также и изобарическим: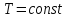 ,
,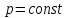 .
Изотерма на диаграмме
.
Изотерма на диаграмме образует «полочку» (рис. 13.3). Все точки
этой полочки за исключением самых
крайних соответствуют двухфазному
состоянию. В них газ и жидкость сосуществуют
в состоянии термодинамического
равновесия. В точке 1 и при более низких
давлениях всё вещество находится в
газообразной фазе, а в точке 2 и при более
высоких давлениях всё вещество находится
в жидкой фазе.
образует «полочку» (рис. 13.3). Все точки
этой полочки за исключением самых
крайних соответствуют двухфазному
состоянию. В них газ и жидкость сосуществуют
в состоянии термодинамического
равновесия. В точке 1 и при более низких
давлениях всё вещество находится в
газообразной фазе, а в точке 2 и при более
высоких давлениях всё вещество находится
в жидкой фазе.
В XIXвеке экспериментальными исследованиями перехода вещества из газообразного состояния в жидкое занимались многие ученые, из них наиболее успешно Каньяр де ля Тур, Дмитрий Иванович Менделеев, Томас Эндрюс, Майкл Фарадей, Хейке Камерлинг Оннес. Эксперименты с самыми разными веществами показали следующее.
В семействе изотерм для одного и того
же вещества наблюдается уменьшение
изобарного участка с ростом температуры
пока при некоторой температуре, называемой
критической температурой, изобарный
участок графика («полочка») не превратится
в точку (на рис. 13.3 она обозначена буквой
К). Эта точка называется критической
точкой. Она соответствует критическому
состоянию вещества при давлении
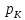 и объеме
и объеме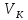 .
Изотерма
.
Изотерма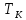 ,
разумеется, называется критической
изотермой. Заметим, что понятие критической
температуры было введено Менделеевым
в 1860 году.
,
разумеется, называется критической
изотермой. Заметим, что понятие критической
температуры было введено Менделеевым
в 1860 году.
В критическом состоянии вещества нет
различий между жидкостью и газом. Это
состояние в научной литературе иногда
называют флюидным. Оно обладает многими
интересными свойствами, в дальнейшем
мы их подробно обсудим. Сейчас же отметим,
что при
 все изотермы идут монотонно (на рис.
13.3 это
все изотермы идут монотонно (на рис.
13.3 это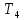 и
и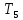 )
и соответствуют исключительно
газообразному состоянию. Последнее
означает, что невозможно перевести газ
в жидкое состояние с помощью изотермического
сжатия, если его температура выше
)
и соответствуют исключительно
газообразному состоянию. Последнее
означает, что невозможно перевести газ
в жидкое состояние с помощью изотермического
сжатия, если его температура выше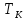 .
.
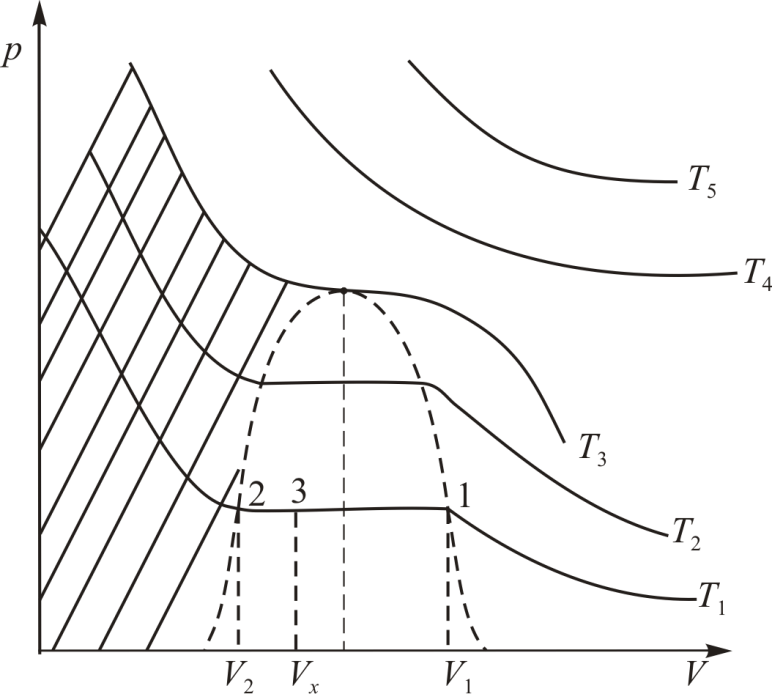
Рис. 13.3.
По графику изотермы двухфазного состояния
(рис. 13.3) можно определить массы
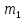 и
и жидкой и газообразной фаз в любой точке
3 на изобаре 2-3-1, используя правило рычага
и закон сохранения массы
жидкой и газообразной фаз в любой точке
3 на изобаре 2-3-1, используя правило рычага
и закон сохранения массы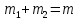 .
Правило рычага выражается равенством
.
Правило рычага выражается равенством
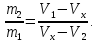
Понимание всех закономерностей, наблюдающихся в экспериментах по сжижению газов возможно только на основе термического уравнения состояния реального газа.
13.4. Уравнения состояния реального газа
Любое уравнение состояния, полученное
либо из первых принципов, либо на
полуэмпирический основе, дающее
функциональную зависимость
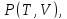 должно прежде всего отвечать двум
требованиям:
должно прежде всего отвечать двум
требованиям:
1.Условие механической устойчивости
выполняется во всей области значений
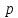 и
и ,
а именно
,
а именно
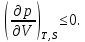
2.В предельном случае, когда
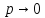 ,
уравнение состояния реального газа
,
уравнение состояния реального газа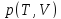 переходит в уравнение Клапейрона –
Менделеева
переходит в уравнение Клапейрона –
Менделеева
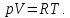
Если уравнение состояния отвечает этим требованиям, то его подвергают экспериментальной проверке, если нет, то возможны два варианта: его исправляют или от него отказываются.
Существует несколько десятков уравнений
состояния реального газа, полученных
на полуэмпирической основе и адекватно
описывающих их свойства. Некоторые из
них приведены на схеме 13.4.1. Наибольшее
признание в современной научной практике
имеют уравнения Редлиха - Квонга, Пенга
-Робинсона и их модификации. Параметры
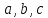 и прочие, фигурирующие в уравнениях на
схеме 13.4.1, имеют в каждом уравнении свой
определенный смысл и значение. Кроме
того, они различны для разных газов и
могут быть получены из эксперимента.
и прочие, фигурирующие в уравнениях на
схеме 13.4.1, имеют в каждом уравнении свой
определенный смысл и значение. Кроме
того, они различны для разных газов и
могут быть получены из эксперимента.
Самое первое уравнение реального газа было предложено известным голландским физиком Ван-дер-Ваальсом в 1873 году. Уравнение Ван-дер-Ваальса имеет простую и физически ясную структуру, позволяющую сравнительно легко получать результаты в аналитической форме. Поэтому в дальнейшем мы будем часто прибегать именно к этому уравнению для описания свойств реальных газов и жидкостей.
Схема 13.4.1