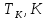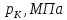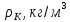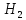- •О.И.Москвич общая физика Молекулярная физика
- •Предисловие
- •I. Основы молекулярной статистики
- •1.1. Предмет молекулярной физики
- •1.2. Масштабы физических величин в молекулярном мире
- •1.3. Теоретические и экспериментальные методы молекулярной физики
- •1.4. Эволюция молекулярных систем. Порядок и хаос
- •1.5. Принципы организации статистического и термодинамического методов изучения макросистем
- •Статистический метод
- •Термодинамический метод
- •2.1. Классификация моделей молекулярных систем
- •2.2. Идеальные статистические системы
- •Модели идеальных систем
- •2.3. Элементарные сведения из теории вероятностей
- •Случайные события
- •Определения вероятности событий
- •Статистическое или частотное определение вероятности.
- •Теоремы теории вероятностей
- •Условие нормировки вероятности
- •Случайная величина
- •Плотность вероятности
- •2.4. Основные понятия молекулярной статистики
- •Вероятность микроскопического состояния. Статистический ансамбль
- •Статистические постулаты
- •Комментарий к постулату равновероятности
- •Эргодическая гипотеза:
- •Постулат равновероятности доступных микроскопических состояний изолированной системы в состоянии термодинамического
- •Комментарий к эргодической гипотезе
- •Вероятность макроскопического состояния
- •3.1. Вывод закона распределения вероятностей Описание системы
- •Актуальные свойства модели системы
- •Постановка задачи
- •Вывод закона
- •Математические преобразования больших чисел. Введение общепринятых обозначений
- •Формула для вероятности макросостояния. Закон Бернулли, или биномиальное распределение.
- •3.2. Графическое представление биномиального распределения.
- •Основные характеристики биномиального распределении.
- •3.3. Предельные случаи биномиального распределения
- •4.1. Распределение энергии в статической системе
- •Вывод распределения Гиббса
- •4.2. Вывод распределения Максвелла
- •4.3. Плотность вероятности и характерные скорости распределения Максвелла
- •4.4. Распределение Максвелла по компонентам скорости
- •4.5. Экспериментальная проверка распределения Максвелла
- •5.1. Вывод формулы для давления идеального газа
- •5.2. Основное уравнение молекулярно-кинетической теории. Газовые законы
- •5.3. Уравнение эффузии
- •5.4. Измерение давления
- •5.5. Определение и измерение температуры
- •5.6. Построение эмпирической шкалы на основе газового термометра
- •Преимущества газовой шкалы температур
- •Построение газовой шкалы температур
- •Термодинамическая шкала температур
- •6.1. Распределение молекул по энергиям во внешнем потенциальном поле
- •6.2. Формула Больцмана для концентрации молекул в потенциальном поле
- •6.3. Зависимость концентрации молекул газа от координат в однородном гравитационном поле и поле центробежных сил
- •Графическое представление зависимости концентрации молекул от координат
- •6.4. Экспериментальное подтверждение распределения Больцмана: опыты Перрена
- •Получение макромолекул
- •Выделение частиц одинакового размера
- •Измерение диаметра макромолекулы
- •Подсчёт количества частиц на определённой высоте
- •6.5. Барометрическая формула
- •6.6. Закон распределения Максвелла – Больцмана
- •7.1. Формулировка теоремы и её доказательство Формулировка теоремы
- •Актуальные свойства модели статистической системы
- •Доказательство теоремы
- •7.2. Статистические степени свободы
- •7.3. Броуновское движение и его статистическое описание
- •Поступательное броуновское движение
- •Вращательное броуновское движение
- •7.4. Броуновский критерий точности физических измерений
- •7.5. Классическая теория теплоёмкости многоатомных газов. Область её применимости
- •7.6. Классическая теория теплоёмкости твёрдых тел.
- •7.7. Применение квантовых моделей в теории теплоёмкости твёрдых тел
- •Модель Эйнштейна
- •Модель Дебая
- •II. Основы термодинамики
- •8.1. Четыре постулата термодинамики
- •8.2. Нулевое (общее) начало термодинамики
- •Формулировка постулата
- •Свойство транзитивности термодинамического равновесия
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •8.3. Макроскопические процессы
- •8.4. Функция состояния
- •Математические свойства функции состояния
- •8.5. Внутренняя энергия системы. Работа и теплота Внутренняя энергия
- •Макроскопическая работа и теплота
- •8.6. Калорическое и термическое уравнения состояния
- •9.1. Первое начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •9.2. Теплоёмкость
- •Связь между теплоёмкостями и(общий случай)
- •Уравнение Роберта Майера
- •9.3. Политропические процессы в идеальном газе
- •Вывод уравнения политропического процесса в идеальном газе
- •9.4. Тепловые машины и их эффективность.
- •Принципиальная схема работы тепловой машины
- •Показатели эффективности тепловых машин
- •10.1. Цикл Карно
- •Расчёт кпд машины Карно
- •10.2. Теоремы Карно
- •Термодинамическая шкала температур
- •10.3. Метод циклов
- •Задача о нахождении зависимости внутренней энергии макроскопического тела от его объема
- •10.4. Неравенство Клаузиуса. Определение энтропии
- •10.5. Оценка эффективности тепловых машин сверху
- •Примеры оценок эффективности тепловых машин сверху кпд бензинового двигателя внутреннего сгорания
- •Кпд паровой турбины
- •Киэ бытового холодильника
- •Киэ кондиционера воздуха
- •Киэ теплового насоса
- •Тепловое загрязнение окружающей среды
- •11.1. Формулировки второго начала термодинамики
- •Энтропийная формулировка второго начала термодинамики Часть первая
- •Часть вторая
- •Информационное содержание постулата
- •11.2. Закон возрастания энтропии в изолированных системах
- •Демон Максвелла
- •Формулировка парадокса
- •Разрешение парадокса
- •11.3. Область применимости второго начала термодинамики
- •Статистический характер второго начала
- •11.4. Концепция тепловой смерти Вселенной
- •Концепция Клаузиуса
- •Флуктуационная гипотеза Больцмана
- •Несостоятельность концепции тепловой смерти Вселенной
- •11.5. Энтропия и её изменение в различных процессах
- •Постановка задачи
- •Описание системы
- •Актуальные свойства системы и процесса
- •Решение
- •Парадокс Гиббса Описание
- •По разные стороны перегородки находятся различные газы. После устранения перегородки начнется диффузия.
- •По разные стороны перегородки находится один и тот же газ.
- •12.1. Термодинамические функции
- •Свободная энергия
- •Термодинамический потенциал Гиббса
- •12.3. Условия термодинамической устойчивости макроскопических систем. Принцип Ле Шателье-Брауна
- •Принцип Ле Шателье-Брауна
- •Проведение полного термодинамического анализа вещества на полуэмпирической основе
- •12.4. Третье начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата (варианты)
- •Информационное содержание постулата
- •Статус постулата
- •Следствия третьего начала
- •III. Физика реальных макросистем
- •13.1. Твердые тела
- •13.2. Реальные газы и жидкости
- •Потенциал межмолекулярного взаимодействия
- •Природа межмолекулярного взаимодействия
- •Структура жидкостей
- •13.3. Переход из газообразного состояния в жидкое.
- •13.4. Уравнения состояния реального газа
- •13.5. Модель газа Ван-дер-Ваальса. Уравнение Ван-дер-Ваальса
- •14.1. Изотермы газа Ван-дер-Ваальса
- •14.2. Критическое состояние вещества
- •Закон соответственных состояний
- •Свойства вещества в критическом состоянии
- •Анализ применения уравнения Ван-дер-Ваальса для описания свойств реальных газов
- •14.3. Внутренняя энергия газа Ван-дер-Ваальса
- •14.4. Эффект Джоуля-Томсона Основные определения
- •Описание процесса Джоуля-Томсона
- •Сущность эффекта Джоуля-Томсона
- •Расчет дифференциального эффекта Джоуля-Томсона
- •Расчет интегрального эффекта Джоуля-Томсона
- •14.5. Методы получения низких температур
- •Метод противоточного обмена теплотой
- •Метод адиабатического размагничивания
- •15.1. Условие равновесия фаз химически однородного вещества
- •15.2. Классификация фазовых переходов по Эренфесту
- •Фазовые переходы первого рода
- •Фазовые переходы второго рода
- •15.3. Фазовые переходы первого рода. Диаграмма состояний
- •15.4. Уравнение Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса методом циклов
- •Актуальные свойства процесса
- •Постановка задачи
- •Вывод уравнения
- •15.5. Диаграмма состояний гелия. Сверхтекучесть жидкого гелия.
- •16.1. Релаксационные процессы в молекулярных системах
- •16.2. Стационарные уравнения переноса в газах, жидкостях и твердых телах
- •Уравнение теплопроводности
- •Уравнение самодиффузии
- •Уравнение внутреннего трения
- •16.3. Внутренняя теплопроводность и внешняя теплопередача
- •Стационарное распределение температуры в бесконечной плоско-параллельной пластинке
- •Стационарное распределение температуры между двумя концентрическими бесконечно длинными цилиндрами
- •Стационарное распределение температуры между двумя концентрическими сферами
- •Внешняя теплопередача
- •17.1. Столкновения молекул и их количественные характеристики
- •Эффективное сечение молекул
- •Средняя длина свободного пробега молекулы
- •Кинематические параметры и
- •17.2. Обобщенное уравнение переноса
- •Вывод обобщенного уравнения процесса Описание системы
- •Актуальные свойства модели процесса
- •Постановка задачи
- •Вывод уравнения
- •17.3. Элементарная кинетическая теория теплопроводности,
- •17.4. Явления переноса в ультраразреженных газах
- •Трение и теплопроводность ультраразреженных газов
- •Тепловая и изотермическая эффузия
- •18.1. Атмосфера как открытая система и как открытая книга
- •18.2. Состав и структура атмосферы Земли.
- •18.3. Термофизическая модель атмосферы
- •18.4. Парниковый эффект
- •Сущность парникового эффекта
- •Парниковые газы
- •Проблема глобального потепления
- •Киотский протокол
- •18.5. Инверсия температуры в стратосфере. Озоносфера Земли
- •Мониторинг озонового слоя
- •Монреальский Протокол
- •18.6. Концепция «ядерной зимы»
- •«Ядерная зима» Сценарии ядерной войны
- •Огненные смерчи – суперподъемники
- •Антипарниковый эффект
- •Глобальный характер климатических последствий
- •Список литературы
- •Общая физика. Молекулярная физика
- •660041, Г. Красноярск, пр. Свободный, 79
14.2. Критическое состояние вещества
Как вы помните, к понятию критического состояния вещества нас привел анализ экспериментальных изотерм. Для того, чтобы разобраться в сущности критических явлений и понять, как они связаны с уравнением состояния и условиями устойчивости термодинамического равновесия, обратимся к уравнению Ван-дер-Ваальса. Не потому, что это уравнение очень точное, а потому, что оно простое и «модельное».
Прежде всего, займемся нахождением
критических параметров
 ,
,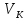 ,
,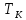 .
Это можно сделать двумя способами.
.
Это можно сделать двумя способами.
Первый способ основан на
конкретной математической структуре
уравнения Ван-дер-Ваальса. Это уравнение
третьей степени относительно .
В критической точке оно принимает вид
.
В критической точке оно принимает вид
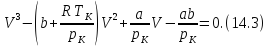
Поскольку в критическом состоянии все
три корня уравнения совпадают и равны
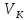 ,
то (14.3) должно приводиться к виду
,
то (14.3) должно приводиться к виду

Возведем в куб выражение в скобках и
приравняем коэффициенты при одинаковых
степенях
 в полученном уравнении и уравнении
(14.3). Получим три уравнения, связывающие
критические параметры и постоянные
в полученном уравнении и уравнении
(14.3). Получим три уравнения, связывающие
критические параметры и постоянные ,
, .
.
Второй способ основан на
использовании математических свойств
точки на критической изотерме (рис. 14.1). Отметим,
что второй способ является более
универсальным. Этим способом можно
вычислить критические параметры на
основе любого уравнения состояния
реального газа (Схема 13.4.1). Математические
свойства критической точки таковы:
на критической изотерме (рис. 14.1). Отметим,
что второй способ является более
универсальным. Этим способом можно
вычислить критические параметры на
основе любого уравнения состояния
реального газа (Схема 13.4.1). Математические
свойства критической точки таковы:
• Она является точкой перегиба изотермы, поэтому в ней
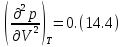
• Касательная в этой точке горизонтальна, следовательно
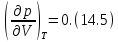
Исходя из уравнения изотермы (14.1), вычислим первую и вторую производные от давления по объему. Решая совместно (14.4), (14.5) и (14.1), найдем критические параметры. Тем и другим способом из уравнения Ван-дер-Ваальса получаются следующие выражения для критических параметров
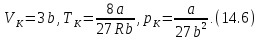
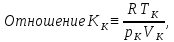
называется критическим коэффициентом. В теории Ван-дер-Ваальса согласно (14.6) критический коэффициент равен
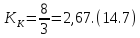
Как видно, его значение не зависит от природы газа, что не соответствует действительности. Опыт показывает, что критические коэффициенты для реальных газов имеют различные значения в интервале 3,0 ÷ 4,5. Использование более точных уравнений состояния вещества позволяет получить лучшее согласие теоретических значений критических параметров с экспериментальными результатами. Значения критических величин для некоторых газов приведены в табл. 14.2.1.
Таблица.14.2.1.
|
Вещество |
|
|
|
|
|
|
33,2 |
1,28 |
31 |
3,03 |
|
|
5,2 |
0,23 |
69 |
3,13 |
|
|
126 |
3,35 |
311 |
3,42 |
|
|
305 |
7,3 |
460 |
4,49 |
На основании (14.6) можно записать
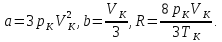
Таким образом, полученные из эксперимента
и критические параметры могут быть
использованы для нахождения постоянных
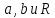 .
Молярная газовая постоянная
.
Молярная газовая постоянная в критическом состоянии обозначается
как
в критическом состоянии обозначается
как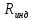 (индивидуальная). Оказывается, что для
различных веществ она разная, но всегда
меньше чем 8,31 Дж/моль∙
(индивидуальная). Оказывается, что для
различных веществ она разная, но всегда
меньше чем 8,31 Дж/моль∙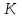 .
Например, для водорода
.
Например, для водорода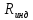 = 6,76 Дж/моль∙
= 6,76 Дж/моль∙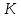 ,
а для водяного пара
,
а для водяного пара = 5,01 Дж/моль∙
= 5,01 Дж/моль∙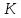 .
Такое поведение газовой постоянной
находит следующее объяснение.
.
Такое поведение газовой постоянной
находит следующее объяснение.
Поскольку
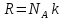 ,
где
,
где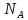 – число структурных элементов в моле,
то получается, что в критическом состоянии
происходит уменьшение структурных
единиц. Действительно, молекулы вещества
в критическом состоянии слипаются,
объединяются в комплексы, которые при
удалении от критического состояния
распадаются, и
– число структурных элементов в моле,
то получается, что в критическом состоянии
происходит уменьшение структурных
единиц. Действительно, молекулы вещества
в критическом состоянии слипаются,
объединяются в комплексы, которые при
удалении от критического состояния
распадаются, и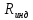 становится равной универсальной газовой
постоянной. Следует иметь в виду, что
при анализе явлений вблизи критического
состояния необходимо использовать
значение
становится равной универсальной газовой
постоянной. Следует иметь в виду, что
при анализе явлений вблизи критического
состояния необходимо использовать
значение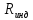 .
.