
- •О.И.Москвич общая физика Молекулярная физика
- •Предисловие
- •I. Основы молекулярной статистики
- •1.1. Предмет молекулярной физики
- •1.2. Масштабы физических величин в молекулярном мире
- •1.3. Теоретические и экспериментальные методы молекулярной физики
- •1.4. Эволюция молекулярных систем. Порядок и хаос
- •1.5. Принципы организации статистического и термодинамического методов изучения макросистем
- •Статистический метод
- •Термодинамический метод
- •2.1. Классификация моделей молекулярных систем
- •2.2. Идеальные статистические системы
- •Модели идеальных систем
- •2.3. Элементарные сведения из теории вероятностей
- •Случайные события
- •Определения вероятности событий
- •Статистическое или частотное определение вероятности.
- •Теоремы теории вероятностей
- •Условие нормировки вероятности
- •Случайная величина
- •Плотность вероятности
- •2.4. Основные понятия молекулярной статистики
- •Вероятность микроскопического состояния. Статистический ансамбль
- •Статистические постулаты
- •Комментарий к постулату равновероятности
- •Эргодическая гипотеза:
- •Постулат равновероятности доступных микроскопических состояний изолированной системы в состоянии термодинамического
- •Комментарий к эргодической гипотезе
- •Вероятность макроскопического состояния
- •3.1. Вывод закона распределения вероятностей Описание системы
- •Актуальные свойства модели системы
- •Постановка задачи
- •Вывод закона
- •Математические преобразования больших чисел. Введение общепринятых обозначений
- •Формула для вероятности макросостояния. Закон Бернулли, или биномиальное распределение.
- •3.2. Графическое представление биномиального распределения.
- •Основные характеристики биномиального распределении.
- •3.3. Предельные случаи биномиального распределения
- •4.1. Распределение энергии в статической системе
- •Вывод распределения Гиббса
- •4.2. Вывод распределения Максвелла
- •4.3. Плотность вероятности и характерные скорости распределения Максвелла
- •4.4. Распределение Максвелла по компонентам скорости
- •4.5. Экспериментальная проверка распределения Максвелла
- •5.1. Вывод формулы для давления идеального газа
- •5.2. Основное уравнение молекулярно-кинетической теории. Газовые законы
- •5.3. Уравнение эффузии
- •5.4. Измерение давления
- •5.5. Определение и измерение температуры
- •5.6. Построение эмпирической шкалы на основе газового термометра
- •Преимущества газовой шкалы температур
- •Построение газовой шкалы температур
- •Термодинамическая шкала температур
- •6.1. Распределение молекул по энергиям во внешнем потенциальном поле
- •6.2. Формула Больцмана для концентрации молекул в потенциальном поле
- •6.3. Зависимость концентрации молекул газа от координат в однородном гравитационном поле и поле центробежных сил
- •Графическое представление зависимости концентрации молекул от координат
- •6.4. Экспериментальное подтверждение распределения Больцмана: опыты Перрена
- •Получение макромолекул
- •Выделение частиц одинакового размера
- •Измерение диаметра макромолекулы
- •Подсчёт количества частиц на определённой высоте
- •6.5. Барометрическая формула
- •6.6. Закон распределения Максвелла – Больцмана
- •7.1. Формулировка теоремы и её доказательство Формулировка теоремы
- •Актуальные свойства модели статистической системы
- •Доказательство теоремы
- •7.2. Статистические степени свободы
- •7.3. Броуновское движение и его статистическое описание
- •Поступательное броуновское движение
- •Вращательное броуновское движение
- •7.4. Броуновский критерий точности физических измерений
- •7.5. Классическая теория теплоёмкости многоатомных газов. Область её применимости
- •7.6. Классическая теория теплоёмкости твёрдых тел.
- •7.7. Применение квантовых моделей в теории теплоёмкости твёрдых тел
- •Модель Эйнштейна
- •Модель Дебая
- •II. Основы термодинамики
- •8.1. Четыре постулата термодинамики
- •8.2. Нулевое (общее) начало термодинамики
- •Формулировка постулата
- •Свойство транзитивности термодинамического равновесия
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •8.3. Макроскопические процессы
- •8.4. Функция состояния
- •Математические свойства функции состояния
- •8.5. Внутренняя энергия системы. Работа и теплота Внутренняя энергия
- •Макроскопическая работа и теплота
- •8.6. Калорическое и термическое уравнения состояния
- •9.1. Первое начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата
- •Информационное содержание постулата
- •Фундаментальное и прикладное значение постулата
- •9.2. Теплоёмкость
- •Связь между теплоёмкостями и(общий случай)
- •Уравнение Роберта Майера
- •9.3. Политропические процессы в идеальном газе
- •Вывод уравнения политропического процесса в идеальном газе
- •9.4. Тепловые машины и их эффективность.
- •Принципиальная схема работы тепловой машины
- •Показатели эффективности тепловых машин
- •10.1. Цикл Карно
- •Расчёт кпд машины Карно
- •10.2. Теоремы Карно
- •Термодинамическая шкала температур
- •10.3. Метод циклов
- •Задача о нахождении зависимости внутренней энергии макроскопического тела от его объема
- •10.4. Неравенство Клаузиуса. Определение энтропии
- •10.5. Оценка эффективности тепловых машин сверху
- •Примеры оценок эффективности тепловых машин сверху кпд бензинового двигателя внутреннего сгорания
- •Кпд паровой турбины
- •Киэ бытового холодильника
- •Киэ кондиционера воздуха
- •Киэ теплового насоса
- •Тепловое загрязнение окружающей среды
- •11.1. Формулировки второго начала термодинамики
- •Энтропийная формулировка второго начала термодинамики Часть первая
- •Часть вторая
- •Информационное содержание постулата
- •11.2. Закон возрастания энтропии в изолированных системах
- •Демон Максвелла
- •Формулировка парадокса
- •Разрешение парадокса
- •11.3. Область применимости второго начала термодинамики
- •Статистический характер второго начала
- •11.4. Концепция тепловой смерти Вселенной
- •Концепция Клаузиуса
- •Флуктуационная гипотеза Больцмана
- •Несостоятельность концепции тепловой смерти Вселенной
- •11.5. Энтропия и её изменение в различных процессах
- •Постановка задачи
- •Описание системы
- •Актуальные свойства системы и процесса
- •Решение
- •Парадокс Гиббса Описание
- •По разные стороны перегородки находятся различные газы. После устранения перегородки начнется диффузия.
- •По разные стороны перегородки находится один и тот же газ.
- •12.1. Термодинамические функции
- •Свободная энергия
- •Термодинамический потенциал Гиббса
- •12.3. Условия термодинамической устойчивости макроскопических систем. Принцип Ле Шателье-Брауна
- •Принцип Ле Шателье-Брауна
- •Проведение полного термодинамического анализа вещества на полуэмпирической основе
- •12.4. Третье начало термодинамики
- •Формулировка постулата
- •Математическая запись постулата (варианты)
- •Информационное содержание постулата
- •Статус постулата
- •Следствия третьего начала
- •III. Физика реальных макросистем
- •13.1. Твердые тела
- •13.2. Реальные газы и жидкости
- •Потенциал межмолекулярного взаимодействия
- •Природа межмолекулярного взаимодействия
- •Структура жидкостей
- •13.3. Переход из газообразного состояния в жидкое.
- •13.4. Уравнения состояния реального газа
- •13.5. Модель газа Ван-дер-Ваальса. Уравнение Ван-дер-Ваальса
- •14.1. Изотермы газа Ван-дер-Ваальса
- •14.2. Критическое состояние вещества
- •Закон соответственных состояний
- •Свойства вещества в критическом состоянии
- •Анализ применения уравнения Ван-дер-Ваальса для описания свойств реальных газов
- •14.3. Внутренняя энергия газа Ван-дер-Ваальса
- •14.4. Эффект Джоуля-Томсона Основные определения
- •Описание процесса Джоуля-Томсона
- •Сущность эффекта Джоуля-Томсона
- •Расчет дифференциального эффекта Джоуля-Томсона
- •Расчет интегрального эффекта Джоуля-Томсона
- •14.5. Методы получения низких температур
- •Метод противоточного обмена теплотой
- •Метод адиабатического размагничивания
- •15.1. Условие равновесия фаз химически однородного вещества
- •15.2. Классификация фазовых переходов по Эренфесту
- •Фазовые переходы первого рода
- •Фазовые переходы второго рода
- •15.3. Фазовые переходы первого рода. Диаграмма состояний
- •15.4. Уравнение Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса
- •Вывод уравнения Клапейрона-Клаузиуса методом циклов
- •Актуальные свойства процесса
- •Постановка задачи
- •Вывод уравнения
- •15.5. Диаграмма состояний гелия. Сверхтекучесть жидкого гелия.
- •16.1. Релаксационные процессы в молекулярных системах
- •16.2. Стационарные уравнения переноса в газах, жидкостях и твердых телах
- •Уравнение теплопроводности
- •Уравнение самодиффузии
- •Уравнение внутреннего трения
- •16.3. Внутренняя теплопроводность и внешняя теплопередача
- •Стационарное распределение температуры в бесконечной плоско-параллельной пластинке
- •Стационарное распределение температуры между двумя концентрическими бесконечно длинными цилиндрами
- •Стационарное распределение температуры между двумя концентрическими сферами
- •Внешняя теплопередача
- •17.1. Столкновения молекул и их количественные характеристики
- •Эффективное сечение молекул
- •Средняя длина свободного пробега молекулы
- •Кинематические параметры и
- •17.2. Обобщенное уравнение переноса
- •Вывод обобщенного уравнения процесса Описание системы
- •Актуальные свойства модели процесса
- •Постановка задачи
- •Вывод уравнения
- •17.3. Элементарная кинетическая теория теплопроводности,
- •17.4. Явления переноса в ультраразреженных газах
- •Трение и теплопроводность ультраразреженных газов
- •Тепловая и изотермическая эффузия
- •18.1. Атмосфера как открытая система и как открытая книга
- •18.2. Состав и структура атмосферы Земли.
- •18.3. Термофизическая модель атмосферы
- •18.4. Парниковый эффект
- •Сущность парникового эффекта
- •Парниковые газы
- •Проблема глобального потепления
- •Киотский протокол
- •18.5. Инверсия температуры в стратосфере. Озоносфера Земли
- •Мониторинг озонового слоя
- •Монреальский Протокол
- •18.6. Концепция «ядерной зимы»
- •«Ядерная зима» Сценарии ядерной войны
- •Огненные смерчи – суперподъемники
- •Антипарниковый эффект
- •Глобальный характер климатических последствий
- •Список литературы
- •Общая физика. Молекулярная физика
- •660041, Г. Красноярск, пр. Свободный, 79
13.2. Реальные газы и жидкости
При описании свойств газов мы считали их идеальными только потому, что выполнялись одновременно два условия:
• Среднее расстояние между молекулами
 в десятки тысяч раз больше чем их
собственный размер
в десятки тысяч раз больше чем их
собственный размер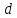 :
: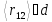 .
.
• Потенциальная энергия взаимодействия частиц пренебрежимо мала по сравнению с их кинетической энергией.
Если эти условия не выполняются, например, при высоких давлениях и низких температурах, то отклонение от идеальности может быть установлено экспериментально, путем проверки справедливости уравнения Клапейрона-Менделеева для некоторого газа при различных давлениях. Измерения позволяют установить область, где отклонения от этого закона становятся значительными.
Чувствительным индикатором неидеальности газов является термодинамический коэффициент сжатия. Для идеального газа согласно его определению.

Экспериментальные измерения этого свойства показывают, что при высоких давлениях
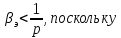
существенны силы отталкивания, а при низких давлениях

- существенны силы притяжения.
У жидкостей сжимаемость в тысячи раз
меньше, чем у газов, поскольку молекулы
упакованы очень плотно. Требуются
достаточно большое давление, чтобы
совсем незначительно уменьшить объем
жидкости. Числовое значение
 для большинства жидкостей порядка 10-10÷ 10-12
для большинства жидкостей порядка 10-10÷ 10-12 .
.
Потенциал межмолекулярного взаимодействия
Для описания взаимодействий молекул в жидкостях и газах широко используется потенциал Леннарда-Джонса
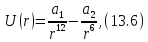
где
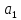 и
и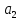 – константы, индивидуальные для каждого
вещества. Первое слагаемое в (13.6)
соответствует энергии короткодействующего
отталкивания, а второе слагаемое дает
энергию дальнодействующего притяжения
между двумя молекулами в зависимости
от расстояния
– константы, индивидуальные для каждого
вещества. Первое слагаемое в (13.6)
соответствует энергии короткодействующего
отталкивания, а второе слагаемое дает
энергию дальнодействующего притяжения
между двумя молекулами в зависимости
от расстояния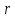 между ними.
между ними.
Характер изменения
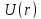 показан на рис. 13.2.
показан на рис. 13.2.
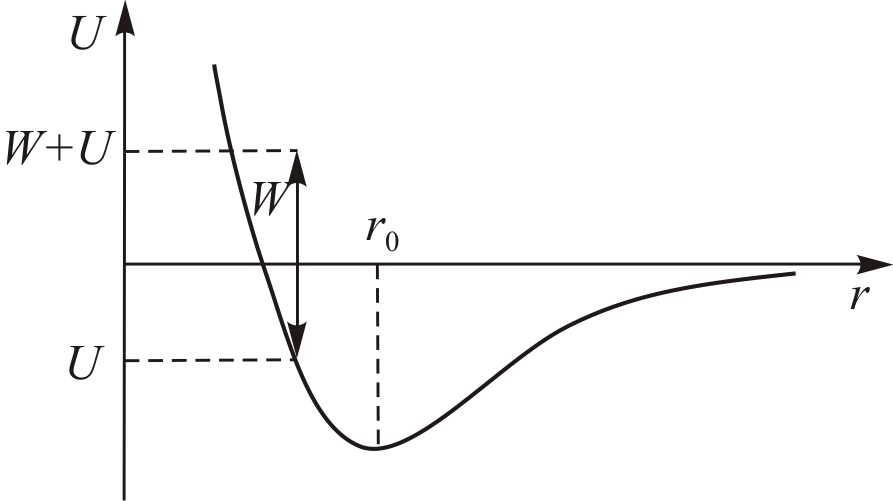
Рис. 13.2.
Природа межмолекулярного взаимодействия
Теперь в общих чертах обсудим природу притяжения и отталкивания молекул в жидкостях и газах. Силы притяжения, действующие на больших расстояниях между молекулами, называются силами Ван-дер-Ваальса. Эти силы возникают благодаря наличию у молекулы постоянных или индуцированных электрических дипольных моментов. Полярные молекулы, обращенные друг к другу разноименными зарядами, притягиваются друг к другу. При таком взаимодействии отсутствует какой либо обмен зарядами в отличие от ковалентной и ионной связи. Кстати, в молекулярных кристаллах также действуют только силы Ван-дер-Ваальса.
Короткодействующие силы отталкивания в веществе возникают вследствие перекрывания электронных оболочек молекул. Одноименные заряды отталкиваются. Чтобы рассчитать энергию их взаимодействия необходимо знать распределение электронной плотности в пространстве. Такую информацию можно получить только в рамках квантово-механического подхода. Мы не имеем возможности углубляться в понимание этого вопроса. Однако, следует обратить внимание на то, что механизм соударения молекул реальных газов не включает в себя прямого упругого удара как это предполагается в модели идеального газа.
Структура жидкостей
Молекулы в жидкостях находятся значительно ближе друг к другу, чем в газах. Силы Ван-дер-Ваальса действуют в них во всем интервале давлений и температур области существования жидкого состояния. В расположении частиц жидкости наблюдается ближний порядок. Это означает, что по отношению к любой частице расположение ближайших частиц является упорядоченным. На фоне хаотического перемещения молекул относительно друг друга в жидкостях могут образовываться и существовать в течение продолжительных промежутков времени агрегаты молекул. Эти структурные образования по своим свойствам близки твердому телу. Сочетание у жидкостей свойств газа и твердого тела делает их теоретическое описание весьма затруднительным. В жидкостях с удлиненными молекулами (особенно в органических) наблюдается одинаковая ориентация их в пределах значительного объема, что приводит к появлению анизотропии ряда свойств. Возникает некоторое промежуточное состояние между жидкостью и твёрдым телом, которое называется жидким кристаллом.
Жидкие кристаллы обладают очень важными оптическими свойствами, что обеспечило их многочисленные применения и большой интерес к их изучению. На свойства жидких кристаллов сильное влияние оказывают электрические и магнитные поля, что открывает возможности управления световыми потоками с помощью этих кристаллов. Широко известны цифровые указатели на жидких кристаллах, а также дисплеи. Большим преимуществом жидкокристаллических пленок являются их относительная дешевизна и малые величины используемых электрических мощностей и напряжений.
Несмотря на отсутствие теории жидкостей, некоторые их свойства изучены достаточно полно, например, поверхностное натяжение и связанные с ним явления. Предлагаемый курс лекций не содержит данную тему, хотя она заявлена в программе дисциплины. Её самостоятельное изучение вами предусматривается в физическом практикуме по молекулярной физике, содержащем две лабораторные работы по данной теме. В описании этих работ достаточно подробно излагается теория поверхностных явлений, там же даны ссылки на учебную литературу.
Теперь мы обратимся к изучению процесса перехода из газообразного состояния в жидкое, что, безусловно, может расширить наши представления об этих состояниях вещества.
