
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с. Электронное оглавление
- •10. Генетические функции 19
- •11. Передача информации в клетках 46
- •12. Генетический код 79
- •13. Генетический контроль синтеза днк 115
- •14. Рекомбинация 143
- •15. Регуляция экспрессии генов у прокариот 179
- •16. Регуляция экспрессии генов у эукариот 218
- •17. Генетический анализ развития 260
- •18 .Генетика соматических клеток: картирование генома человека 302
- •19. Количественные признаки 346
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Генетическая информация
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •"Врожденные ошибки метаболизма" по Гэрроду
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Гипотеза "один ген - один фермент"
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Биохимические превращения при метаболизме
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Гены и белки
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Структура белков
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Внутригенная комплементация
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •11. Передача информации в клетках
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Синтез днк
- •Синтез рнк
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Синтез белка
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Специализированный перенос информации Репликация рнк
- •Обратная транскрипция
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Трансляция днк
- •Запрещенные (неизвестные) варианты переноса информации
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Колинеарность генов и полипептидов (прокариоты)
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Колинеарность генов и полипептидов (эукариоты)
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Центральная догма
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •12. Генетический код
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Генетическое изучение кода
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Генетическое подтверждение существования терминаторных кодонов
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Расшифровка кода с помощью биохимических методов
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Особенности построения генетического кода
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Терминаторные кодоны
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Организация нуклеотидной последовательности фагаφ χ74
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Генетические факторы, влияющие на трансляцию кода
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Генетический код митохондрии
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •13. Генетический контроль синтеза днк
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Полимеризация днк в репликативной вилке
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Генетический анализ репликации днк
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Биохимический анализ репликации днк
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Инициация синтеза днк в точке начала репликации
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Синтез днк у эукариот
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Точность синтеза днк
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Исправление ошибок репликации и репарация днк
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •14. Рекомбинация
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Общая рекомбинация
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Консервативный разрыв и воссоединение
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Генетический анализ рекомбинации
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Высокая отрицательная интерференция и генная конверсия
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Образование структур Холлидея у эукариот
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Сайт-специфическая и незаконная рекомбинация
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Интеграция и эксцизия профагаλ
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Подвижные генетические элементы
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Общая картина метаболизма днк
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •15. Регуляция экспрессии генов у прокариот
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Участки днк, контролирующие транскрипцию
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Катаболитная репрессия
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Бактериофагλ
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Опероны биосинтеза аминокислот
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Регуляция экспрессии генов с помощью сайт-специфической рекомбинации
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •16. Регуляция экспрессии генов у эукариот
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Участки днк, контролирующие транскрипцию
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Сплайсинг гяРнк-транскриптов
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Транскрипция и структура хроматина
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Согласованная регуляция экспрессии генов
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Метилирование днк
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Регуляция гемоглобиновых генов в ходе развития организма
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Контроль экспрессии генов, основанный на перестройках днк
- •Типы спаривания у дрожжей
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Белки клеточной поверхности у трипаносомы
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Иммуноглобулиновые гены
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •16. Регуляция экспрессии генов у эукариот 243
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Заключение
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •17. Генетический анализ развития
- •Дифференциальная экспрессия генов
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Клеточная детерминация
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Эмбриогенез мыши
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Генетический анализ развития
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Мутации, затрагивающие эмбриогенез у мыши
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Мутации с материнским эффектом у дрозофилы
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Гомеозисные мутации уDrosophila
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Определение пола и дозовая компенсация
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Определение пола у млекопитающих
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Механизмы генетической регуляции
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •18 .Генетика соматических клеток: картирование генома человека
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Геном человека
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Гибридизация клеток в культуре
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Отбор клеточных гибридов с помощью методаHat
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Внутрихромосомное картирование генов с помощью хромосомных перестроек
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Микроклетки и изолированные хромосомы
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Картирование генов с помощью днк-зондов
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Гибридизация in situ
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Генетическая карта человека
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Трансфекция и наследственные болезни
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Онкогены
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Трансфекция генов и рак
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Генетика соматических клеток растений
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •19. Количественные признаки
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Пенетрантность и экспрессивность
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Гены-модификаторы и гены, имеющие эпистатическое действие
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Плейотропия
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Непрерывная изменчивость
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Окраска семян у пшеницы
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Полигенное наследование
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Генетическая и средовая изменчивость
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Наследуемость в различных популяциях
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с. Оглавление
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
- •Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
20 Экспрессия генетического материала
|
|
|
Рис. 10.12. Первые семь аминокислотных остатков ß-цепи человеческого гемоглобина, состоящей из 146 аминокислотных остатков. Замещение глутаминовой кислоты в шестом положении на валин приводит к тяжелому заболеванию - серповидноклеточной анемии. |
ло ясно, что гены определяют аминокислотную последовательность белков.
Полипептидные цепи - и ß-субъединиц гемоглобина кодируются различными генами. Многие другие белки и ферменты (хотя и не все) также состоят из двух или более полипептидных цепей, кодируемых разными генами. На этом основании Ингрэм предложил уточнить формулировку гипотезы «один ген-один фермент» в виде «один ген-одна полипептидная цепь».
Структура белков
Белки играют важнейшую роль в жизнедеятельности любых организмов. Многообразие и сложность живой материи, по сути дела, отражают многообразие и сложность самих белков. Каждый белок имеет свою уникальную функцию, которая определяется присущими ему структурой и химическими свойствами. Некоторые белки являются ферментами, то есть катализаторами биохимических реакций в живых организмах. Каждая химическая реакция катализируется определенным ферментом. Без участия ферментов подобные реакции не происходят вовсе или протекают слишком медленно, чтобы обеспечить саму возможность существования живых организмов. Другие белки (структурные) выполняют в организме роль строительных белков - или сами по себе (например, коллаген), или в комплексе с нуклеиновыми кислотами (нуклеопротеины), углеводами (гликопротеины) или липидами (липопротеины). Некоторые белки, такие, как, например, миоглобин и гемоглобин, вовлеченные в систему запасания и транспорта кислорода, связываются с функционально важными металлсодержащими органическими молекулами. Так, миоглобин и гемоглобин специфически связывают железосодержащую группировку, называемую гемом.
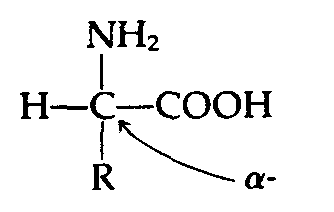
Белки-это большие полимерные молекулы, построенные из мономерных аминокислотных звеньев. В состав белков входят двадцать различных видов аминокислот. Все белковые аминокислоты (за исключег нием одной - пролина) характеризуются общей структурой типа
Айала ф., Кайгер Дж. Современная генетика: в 3-х т. Т. 2. Пер. С англ.: – м.: Мир, 1988. – 368 с.
10. Генетические функции 21
обязательными элементами которой являются аминогруппа (—NH2) и карбоксильная группа (—СООН), связанные с центральным углеродным атомом. С этим же атомом углерода связаны также атом водорода (—Н) и боковая группа (радикал, обозначенный символом R). Подробнее о свойствах аминокислот см. в дополнении 10.1.
Дополнение 10.1. Химическая структура аминокислот
|
Двадцать аминокислот, обычно входящих в состав белков, можно классифицировать различными способами. Избранный нами способ классификации, проиллюстрированный на рис. 10.13, помогает выявить некоторые важные в биологическом отношении свойства аминокислотных остатков в белках. Эти свойства определяются исключительно природой боковых групп. |
ная группа (—СООН). Две основные аминокислоты (лизин и аргинин) содержат в своих боковых цепях аминогруппу (—NH2). Эти карбоксильные и аминогруппы при физиологических значениях pH в значительной степени подвергаются ионизации. (—СООН)-группа теряет протон с образованием карбоксил-иона (—СОО–), а (—NH2)-группа связывает |
|
Восемь аминокислот объединены в группу неполярных или гидрофобных |
протон с образованием замещенного аммониевого катиона ( — NH3+). |
|
(т. е. отталкивающих воду). Обратите внимание на то, что одна из них - пролин - в структурном отношении существенно отличается от 19 остальных аминокислот. Из двенадцати полярных или гидрофильных аминокислот (образующих энергетически выгодные контакты с молекула- |
Две аминокислоты - метионин (неполярная) и цистеин (полярная) содержат атом серы. Атом водорода — SH-группы цистеина легко удаляется, благодаря чему между двумя остатками цистеина может возникнуть дисульфидный (— S — S — ) мостик. |
|
ми воды) семь при физиологических значениях pH электрически нейтральны, три аминокислоты являются основными и, следовательно, склонны нести избыточный положительный заряд, а две другие -кислотными (склонны нести отрицательный заряд). В боковых цепях обеих кислотных аминокислот (аспарагиновой и глутаминовой) находится карбоксиль- |
Три аминокислоты - фенилаланин (неполярная), а также тирозин и триптофан (полярные) - являются ароматическими, т.е. содержат в боковой цепи ароматические радикалы. (У триптофана полярность выражена настолько слабо, что его иногда относят к неполярным аминокислотам.) |
Аминокислоты в белках связаны между собой прочными ковалентными пептидными связями, возникающими в результате химического взаимодействия между карбоксильной группой одной аминокислоты и аминогруппой следующей аминокислоты (рис. 10.14). Образующийся в результате такого взаимодействия двух или нескольких аминокислот олигомер называется пептидом. Дипептид состоит из двух аминокислот, трипептид - из трех и т.д. Аминокислоты, входящие в состав пептида, часто называют аминокислотными остатками. Структурную основу любого пептида составляет зигзагообразный остов, образованный атомами углерода и азота (рис. 10.15). Направленные вовне по отношению к остову боковые R-группы любых соседних аминокислотных остатков

