
- •Государственное образовательное учреждение
- •Нормативные документы
- •2. Требования к уровню подготовки абитуриента
- •3.Общие требования к основной образовательной программе подготовки выпускника по специальности
- •040100 - Лечебное дело
- •4. Требования к обязательному минимуму содержания
- •Основной образовательной программы
- •Подготовки врача
- •По специальности 040100 - Лечебное дело
- •5. Сроки освоения основной образовательной программы выпускника
- •6. Требования к разработке и условиям реализации
- •6.1. Требования к разработке основной образовательной программы подготовки Врача
- •6.2. Требования к кадровому обеспечению учебного процесса
- •6.3. Требования к учебно-методическому обеспечению учебного процесса
- •6.4. Требования к материально-техническому обеспечению учебного процесса.
- •6.5. Требования к организации практик
- •7. Требования к уровню подготовки выпускника
- •7.1. Требования к профессиональной подготовленности специалиста.
- •7.2. Требования к итоговой государственной аттестации выпускника.
- •П о л о ж е н и е
- •1. Общие положения.
- •2. Структура, состав и содержание умк.
- •3. Порядок рассмотрения и утверждения умк.
- •Положение
- •Текущий и рубежный контроль учебных достижений
- •Промежуточная аттестация
- •Положение о рейтинговой системе оценки учебных достижений студентов Ярославской государственной медицинской академии
- •Положение о рейтинговой системе на кафедре микробиологии с вирусологией и иммунологией
- •По формуле:
- •Положение об итоговой аттестации студентов на кафедре микробиологии с вирусологией и иммунологией в 2008/2009 учебном году
- •Учебно-методические документы
- •Программа
- •Введение
- •1. Микробиология
- •1.1. История развития микробиологии
- •1.2. Связь микробиологии с другими дисциплинами.
- •Общая микробиология
- •2. Общая бактериология, микология,
- •2.1. Систематика микробов
- •2.2. Морфология микробов
- •2.3. Физиология микробов
- •2.4. Генетика микробов
- •2.5. Экология микробов
- •2.6. Микрофлора организма человека и ее функции
- •2.7. Влияние факторов окружающей среды на микробы
- •2.8. Антибиотики
- •3. Учение об инфекции
- •3.1. Роль микроорганизмов в инфекционном процессе
- •3.2. Роль макроорганизма в инфекционном процессе
- •3.3. Понятие о патогенезе инфекционных болезней
- •4. Медицинская иммунология
- •4.1. Задачи и история развития иммунологии
- •4.2. Неспецифические факторы защиты организма человека
- •4.3. Антигены
- •4.4. Иммунная система организма человека
- •4.5. Специфические формы иммунного ответа
- •4.6. Аллергические реакции
- •4.8. Иммунный статус человека
- •4.9. Методы оценки иммунного статуса
- •4.10. Иммунопатология
- •4.11. Иммунопрофилактика, иммунотерапия и иммунокоррекция
- •4.12. Иммунобиологические препараты
- •4.13. Иммунологические реакции в диагностике инфекционных
- •4.14. Биотехнология и генная инженерия
- •Частная медицинская микробиология
- •1. Бактерии – возбудители инфекционных
- •1.1. Грамположительные кокки
- •1.2. Грамотрицательные кокки
- •1.3. Грамотрицательные факультативно анаэробные палочки
- •1.4. Грамотрицательные аэробные палочки
- •1.5. Грамотрицательные анаэробные палочки
- •1.6. Грамположительные спорообразующие палочки
- •1.7. Грамположительные правильной формы палочки
- •1.8. Грамположительные неправильной формы палочки
- •1.9. Спирохеты и другие спиральные, изогнутые бактерии
- •1.10. Риккетсии. Эрлихии. Коксиеллы
- •1.11. Хламидии
- •1.12. Микоплазмы
- •4.2. Рнк-геномные вирусы
- •4.3. Онкогенные вирусы
- •4.4. Медленные вирусные инфекции
- •5. Клиническая микробиология
- •Рекомендуемый план лекций для студентов лечебных и медико-профилактических факультетов
- •IV семестр (18 недель – 36 часов)
- •V семестр (19 недель – 38 часов)
- •Рекомендуемый план практических занятий для студентов лечебных факультетов
- •IV семестр (18 недель – 18 занятий по 3 часа)
- •Рекомендуемый план практических занятий для студентов медико-профилактических факультетов
- •Тематический план лекций для студентов педиатрических факультетов (64 часа)
- •Тематический план практических занятий для студентов педиатрических факультетов (120 часов)
- •Конечные цели обучения дисциплине
- •Рекомендуемый перечень экзаменационных вопросов
- •Дополнительный перечень вопросов для студентов педиатрических факультетов
- •Дополнительный перечень вопросов для студентов стоматологического факультета
- •Литература
- •Государственное образовательное учреждение
- •1.Цель и задачи дисциплины
- •2. Содержание дисциплины
- •2.1.Наименование тем, их содержание и объем в часах.
- •2.2. Семинарские занятия, их содержание и объем в часах.
- •2.3.Лабораторные занятия.
- •3. Учебно-методические материалы по дисциплине
- •П р о т о к о л
- •Перечень основной и дополнительной литературы а. Основная:
- •Б. Дополнительная
- •Руководство к практическим занятиям
- •Предмет и задачи медицинской микробиологии.
- •Аппаратура, используемая в микробиологической лаборатории:
- •Самостоятельная работа студентов
- •Правила работы в микробиологических лабораториях.
- •3. Освоение техники микроскопии с иммерсионным объективом:
- •Разрешающая способность иммерсионного микроскопа – 0,2-0,4 мкм.
- •5. Освоение техники приготовления мазка из агаровой культуры бактерий и окраски его простым способом:
- •Педиатрические аспекты
- •Тема 2. Морфология микроорганизмов. Структура бактериальной клетки Самостоятельная работа студентов
- •2. Выявление включений волютина у дифтерийной палочки – Corynebacterium diphtheriae (окраска по Нейссеру) – рис.6.
- •Тема 3. Морфология и классификация бактерий, спирохет, риккетсий, хламидий, микоплазм и актиномицетов. Самостоятельная работа студентов
- •3. Выявление подвижности протея методом «раздавленной капли».
- •Все микропрепараты описать, зарисовать.
- •2. Знакомство с методами асептики, антисептики, дезинфекции и стерилизации.
- •Тема 5. Физиология бактерий. Дыхание и размножение бактерий. Методы культивирования аэробов и анаэробов Самостоятельная работа студентов
- •2. Выделение чистой культуры анаэробных бактерий из почвы (демонстрация).
- •Тема 6. Физиология бактерий. Ферменты бактерий. Выделение чистых культур аэробных и анаэробных бактерий
- •Перечень конкретных учебно-целевых вопросов
- •Самостоятельная работа студентов
- •Тема 7. Ферменты бактерий. Бактериологический метод исследования. Итоговое занятие по теме "морфология и физиология микробов» Самостоятельная работа студентов.
- •Тема 8. Вирусы бактерий (бактериофаги)
- •Самостоятельная работа студентов
- •Тема 9. Генетика микроооганизмов. Самостоятельная работа студентов
- •2. Изучение характера роста s (e.Coli) и r (b. Cereus) форм бактерий на плотной и жидкой питательных средах (демонстрация).
- •Педиатрические аспекты
- •Тема 10. Экология микроорганизмов. Микр0флора организма человека. Микробиологические основы химиотерапии инфекционных болезней. Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 11. Экология микроорганизмов. Микробиология воды, воздуха, почвы, пищевых продуктов
- •Перечень конкретных учебно-целевых вопросов
- •Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 12. Учение об инфекции. Факторы патогенности бактерий. Роль макроорганизма, внешней среды и социальных условий в развитии инфекции. Формы инфекции Самостоятельная работа студентов.
- •Педиатрические аспекты темы
- •Тема 13. Учение об иммунитете. Виды иммунитета. Неспецифическая резистентность. Серологические реакции
- •Перечень конкретных учебно-целевых вопросов
- •Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 14. Учение об иммунитете. Серологические реакции. Антигены и их характеристика. Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 15. Учение об иммунитете. Клетки иммунной системы. Иммунный статус организма человека и методы его оценки. Современные иммунологические методы
- •Перечень конкретных учебно-целевых вопросов
- •Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 16. Учение об иммунитете. Специфическая профилактика и лечение инфекционных заболеваний. Диагностические биопрепараты. Аллергены
- •Перечень конкретных учебно-целевых вопросов
- •Самостоятельная работа студентов
- •Вакцины и анатоксины
- •Сыворотки и иммуноглобулины.
- •А л л е р г е н ы
- •В а к ц и н ы д л я л е ч е н и я
- •Методы диагностических микробиологических исследований Методы обнаружения возбудителя инфекции в материале от больного
- •Биохимические и молекулярно-биологические методы диагностики
- •Оценка результатов клинико-диагностических микробиологических исследований
- •Микробиологическая диагностика стафилококковых инфекций
- •Самостоятельная работа студентов
- •Микробиологическая диагностика стрептококковых инфекций.
- •Самостоятельная работа студентов
- •Микробиологическая диагностика заболеваний, вызываемых гноеродными условно-патогенными грамотрицательными аэробными микроорганизмами.
- •Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 2. Возбудители раневой анаэробной инфекции: анаэробной газовой инфекции, столбняка. Бактероиды. Микробиологическая диагностика анаэробной инфекции.
- •Самостоятельная работа студентов.
- •Микробиологическая диагностика столбняка.
- •Самостоятельная работа студентов.
- •4. Ознакомление с биопрепаратами, применяемыми для специфической профилактики и терапии столбняка:
- •Микробиологическая диагностика неклостридиальной анаэробной инфекции
- •Педиатрические аспекты темы
- •Тема 3. Возбудители бактериальных зоонозных инфекций: чумы, туляремии, сибирской язвы
- •Перечень конкретных учебно-целевых вопросов
- •Микробиологическая диагностика чумы.
- •Микроскопический метод
- •Бактериологический метод.
- •Биопроба
- •А б
- •Самостоятельная работа студентов
- •Микробиологическая диагностика туляремии
- •Биологический и бактериологический метод.
- •Биопроба
- •Самостоятельная работа студентов
- •2. Серологический метод диагностики туляремии.
- •Микробиологическая диагностика сибирской язвы
- •Бактериологический метод.
- •Микроскопический метод.
- •Биопроба
- •Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 4. Возбудители бактериальных зоонозных инфекций: бруцеллеза, лептоспироза, боррелиозов, листериоза Микробиологическая диагностика бруцеллеза
- •Бактериологический метод.
- •Биопроба
- •Самостоятельная работа студентов
- •Микробиологическая диагностика лептоспироза
- •Микроскопический метод.
- •Бактериологический метод.
- •Биопроба
- •Самостоятельная работа студентов
- •4. Знакомоство с биопрепаратами для профилактики и лечения лептоспироза.
- •Микробиологическая диагностика боррелиозов (возвратные тифы, болезнь Лайма)
- •Самостоятельная работа студентов
- •Микробиологическая диагностика листериоза
- •Педиатрические аспекты темы
- •Серологический метод
- •Самостоятельная работа студентов
- •1. Бактериологический метод – выделение гемокультуры:
- •2. Серологический метод диагностики тифо-паратифозных заболеваний.
- •Педиатрические аспекты темы
- •Микробиологическая диагностика сальмонеллезов
- •Серологический метод
- •Самостоятельная работа студентов
- •1. Учет посевов сальмонелл на среде Левина и Олькеницкого (демонстрация).
- •3. Идентификация выделенной культуры возбудителя:
- •Педиатрические аспекты темы
- •Тема 6. Микробиология бактериальных кишечных инфекций: патогенные кишечные палочки, иерсинии, кампилобактерии, хеликобактерии Микробиологическая диагностика эшерихиозов
- •Серологический метод - ра, рнга, ифа с целью выявления антител к эшерихиям и их динамики (исследование парных сывороток) в процессе инфекции.
- •Самостоятельная работа студентов
- •Микробиологическая диагностика иерсиниозов
- •Самостоятельная работа студентов
- •Микробиологическая диагностика кампилобактериозов
- •Самостоятельная работа студентов
- •Микробиологическая диагностика геликобактериоза
- •Самостоятельная работа студентов
- •Тема 7. Микробиология бактериальных кишечных инфекций: возбудители дизентерии, холеры. Пищевые интоксикации бактериальной природы Лабораторная диагностика бактериальной дизентерии.
- •Серологический метод. Постановка ра, рнга с целью выявления антител к шигеллам и их динамики (исследование парных сывороток) в процессе инфекции.
- •Самостоятельная работа студентов
- •3. Идентификация выделенной культуры шигелл:
- •Микробиологическая диагностика холеры
- •Серологический метод: Постановка ра, рнга, теста иммобилизации вибрионов с целью выявления антител к холерному вибриону и их динамики (исследование парных сывороток) в процессе инфекции.
- •Пищевые интоксикации бактериальной природы Лабораторная диагностика ботулизма
- •Самостоятельная работа студентов
- •Пищевые интоксикации бактериальной этиологии способны также вызывать:
- •Педиатрические аспекты темы.
- •Тема 8. Возбудители бактериальных воздушно-капельных инфекций: дифтерии, коклюша, гемофильной и пневмококковой инфекции Лабораторная диагностика дифтерии
- •Серологический метод
- •Самостоятельная работа студентов
- •4. Биопрепараты для диагностики, профилактики и лечения дифтерии.
- •Микробиологическая диагностика коклюша и паракоклюша
- •Серологический метод - ра и рск с парными сыворотками больных для констатации нарастания титра антител с целью ретроспективного подтверждения коклюша и диагностики его атипичных форм.
- •Самостоятельная работа студентов
- •4. Биопрепараты для диагностики, профилактики и лечения коклюша:
- •Педиатрические аспекты темы
- •Микробиологическая диагностика гемофильной инфекции
- •Микробиологическая диагностика бактериальных пневмоний и острых респираторных заболеваний (орз)
- •Самостоятельная работа студентов
- •Тема 9. Возбудители бактериальных воздушно-капельных бактериальных инфекций: туберкулеза, менингококовой инфекции и актиномикоза Лабораторная диагностика туберкулеза и микобактериозов
- •Самостоятельная работа студентов
- •Микробиологическая диагностика проказы
- •Микробиологическая диагностика менингококковой инфекции
- •4. Биопрепараты для диагностики и профилактики менингококковой инфекции:
- •Микробиологическая диагностика актиномикоза
- •Микробиологическая диагностика сифилиса
- •Самостоятельная работа студентов
- •2. Серологическая диагностика сифилиса.
- •3. Ознакомиться с препаратами для диагностики и лечения сифилиса:
- •Микробиологическая диагностика мягкого шанкра
- •Микробиологическая диагностика гонореи
- •Самостоятельная работа студентов
- •3. Изучить препараты для диагностики и лечения гонореи.
- •Микробиологическая диагностика урогенитального микоплазмоза
- •Лабораторная диагностика урогенитального хламидиоза
- •Самостоятельная работа студентов
- •Микробиологическая диагностика бактериального вагиноза
- •Самостоятельная работа студентов.
- •Тема 11. Возбудители риккетсиозов. Микробиологическая диагностика риккетсиозов
- •Микробиологическая диагностика эпидемического сыпного тифа.
- •Микробиологическая диагностика эндемического сыпного тифа.
- •Микробиологическая диагностика Ку-лихорадка.
- •Микробиологическая диагностика эрлихиозов
- •Микробиологическая диагностика бартонеллезов
- •Самостоятельная работа студентов
- •3. Серологический метод диагностики сыпного тифа:
- •Педиатрические аспекты темы
- •Тема 12. Общая вирусология: морфология и ультраструктура вирусов, методы их культивирования. Экспресс-диагностика вирусных инфекций. Методы лабораторной диагностики вирусных инфекций
- •Взятие и подготовка материала для вирусологической диагностики
- •Выделение вирусов на развивающихся куриных эмбрионах
- •Выделение вирусов на экспериментальных животных.
- •Самостоятельная работа студентов
- •1. Изучение морфологии вирусов по электронограммам.
- •Индикация вирусов
- •Учет вирусиндуцированных патологических изменений в чувствительных живых системах.
- •Серологический метод диагностики вирусных инфекций
- •Самостоятельная работа студентов
- •2. Индикация вирусов в клетках культуры ткани:
- •3. Выделение и индикация вирусов на ркэ.
- •4. Идентификация вирусов:
- •Самостоятельная работа студентов
- •Вирусологическая диагностика натуральной оспы
- •Вирусологическая диагностика герпеса
- •Вирусологическая диагностика кори
- •Вирусологическая диагностика краснухи.
- •Вирусологическая диагностика эпидемического паротита.
- •Самостоятельная работа студентов
- •Тема 15. Пикорнавирусы. Вирусы гепатитов. Ротавирусы Вирусологическая диагностика пикорнавирусных инфекций Энтеровирусные инфекции
- •Самостоятельная работа студентов
- •4. Изучить биопрепараты для профилактики, диагностики и лечения:
- •Гепатит а
- •Гепатит в
- •Другие гепатиты
- •Самостоятельная работа студентов
- •1. Лабораторная диагностика вирусных гепатитов
- •Вирусологическая диагностика ротавирусных гастроэнтеритов.
- •Тема 16. Арбовирусы. Нейровирусы. Онкогенные вирусы. Медленные вирусные инфекции. Ретровирусы Вирусологическая диагностика нейровирусных инфекций Арбовирусные инфекции
- •Самостоятельная работа студентов
- •3. Изучить биопрепараты для профилактики, диагностики и лечения клещевого энцефалита:
- •Бешенство
- •Самостоятельная работа студентов
- •2. Изучить биопрепараты, используемые для специфической профилактики и лечения бешенства:
- •Лабораторная диагностика вич-инфекции
- •Самостоятельная работа студентов
- •Вирусологическая диагностика парвовирусных инфекций
- •Вирусологическая диагностика аренавирусных инфекций
- •Вирусологическая диагностика филовирусных инфекций (Марбургская лихорадка и лихорадка Эбола)
- •Тема 17. Патогенные грибы. Возбудители глубоких и субкутанных микозов, дерматомикозов, оппортунистических микозов
- •Элементы общей микологии и принципы лабораторной
- •Диагностики микозов
- •Биологические свойства грибов
- •Лабораторная диагностика микозов
- •Лабораторная диагностика отдельных микозов Лабораторная диагностика глубоких (системных) микозов
- •Криптокккоз
- •Североамериканский бластомикоз (болезнь Джилкрайста—Стокса)
- •Южноамериканский бластомикоз (паракокцидиоидоз)
- •Хромомикоз
- •Лабораторная диагностика эпидермомикозов Рубромикоз (руброфития).
- •Эпидермофития паховая.
- •Эпидермофития стоп.
- •Трихомикозы Трихофития
- •Микроспория.
- •Фавус (парша).
- •Лабораторная диагностика поверхностных микозов
- •Лабораторная диагностика микозов, вызываемых условно-патогенными грибами (оппортунистические микозы)
- •Кандидоз (кандидамикоз)
- •Другие оппортунистические микозы
- •Аспергиллез
- •Пенициллиоз
- •Фикомикоз (мукороз)
- •Пневмоцистоз
- •Самостоятельная работ студентов Лабораторная диагностика эпидермомикозов.
- •Лабораторная диагностика кандидозов.
- •Лабораторная диагностика глубоких микозов.
- •2. Серологический метод:
- •Педиатрические аспекты темы
- •Тема 18. Микробиологическая диагностика протозойных инфекций
- •Перечень конкретных учебно-целевых вопросов
- •Основные методы лабораторной диагностики протозойных инфекций
- •Малярия
- •Криптоспоридиоз
- •Токсоплазмоз
- •Трипаносомоз
- •Лейшманиоз
- •Лямблиоз
- •Трихомониаз
- •Амебиаз
- •Балантидиаз
- •Самостоятельная работ студентов
- •Взятие спинномозговой жидкости
- •Взятие мочи
- •Взятие желчи.
- •Взятие материала из дыхательных путей
- •Взятие материала из уха.
- •Взятие отделяемого из ран, язв, брюшной полости
- •Взятие материала из глаз.
- •Взятие материала из женских половых органов
- •Взятие материала при аутопсии
- •Взятие, условия хранения и доставки венозной крови для проведения ифа и пцр.
- •Правила взятия и доставки биологических материалов для вирусологических исследований
- •Методические материалы и рекомендации для преподавателя о средствах и методах обучения, способах учебной деятельности
- •Тема 1. Морфология микроорганизмов. Микроскопический метод исследования микроорганизмов. Простые и сложные методы окраски бактерий
- •Перечень конкретных учебно-целевых вопросов
- •Тема 2. Морфология микроорганизмов. Структура бактериальной клетки
- •Перечень конкретных учебно-целевых вопросов
- •Тема 3. Морфология и классификация бактерий, спирохет, риккетсий, хламидий, микоплазм и актиномицетов.
- •Перечень конкретных учебно-целевых вопросов
- •Перечень конкретных учебно-целевых вопросов
- •Тема 5. Физиология бактерий. Дыхание и размножение бактерий. Методы культивирования аэробов и анаэробов
- •Перечень конкретных учебно-целевых вопросов
- •Тема 6. Физиология бактерий. Ферменты бактерий. Выделение чистых культур аэробных и анаэробных бактерий
- •Перечень конкретных учебно-целевых вопросов
- •Тема 7. Ферменты бактерий. Бактериологический метод исследования. Итоговое занятие по теме "морфология и физиология микробов»
- •Тема 8. Вирусы бактерий (бактериофаги)
- •Перечень конкретных учебно-целевых вопросов
- •Тема 9. Генетика микроооганизмов.
- •Тема 10. Экология микроорганизмов. Микр0флора организма человека. Микробиологические основы химиотерапии инфекционных болезней.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 11. Экология микроорганизмов. Микробиология воды, воздуха, почвы, пищевых продуктов
- •Перечень конкретных учебно-целевых вопросов
- •Тема 12. Учение об инфекции. Факторы патогенности бактерий. Роль макроорганизма, внешней среды и социальных условий в развитии инфекции. Формы инфекции
- •Перечень конкретных учебно-целевых вопросов
- •Тема 13. Учение об иммунитете. Виды иммунитета. Неспецифическая резистентность. Серологические реакции
- •Перечень конкретных учебно-целевых вопросов
- •Тема 14. Учение об иммунитете. Серологические реакции. Антигены и их характеристика.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 15. Учение об иммунитете. Клетки иммунной системы. Иммунный статус организма человека и методы его оценки. Современные иммунологические методы
- •Перечень конкретных учебно-целевых вопросов
- •Тема 16. Учение об иммунитете. Специфическая профилактика и лечение инфекционных заболеваний. Диагностические биопрепараты. Аллергены
- •Перечень конкретных учебно-целевых вопросов
- •Тема 17. Учение об инфекции и иммунитете. Практические аспекты иммунологии. Контрольное занятие (тестовый контроль и устное собеседование)
- •Частная микробиология
- •Перечень конкретных учебно-целевых вопросов
- •Тема 2. Возбудители раневой анаэробной инфекции: анаэробной газовой инфекции, столбняка. Бактероиды.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 3. Возбудители бактериальных зоонозных инфекций: чумы, туляремии, сибирской язвы
- •Перечень конкретных учебно-целевых вопросов
- •Тема 4. Возбудители бактериальных зоонозных инфекций: бруцеллеза, лептоспироза, боррелиозов, листериоза
- •Перечень конкретных учебно-целевых вопросов
- •Тема 5. Микробиология бактериальных кишечных инфекций: сальмонеллы - возбудители брюшного тифа, паратифов и пищевых токсикоинфекций
- •Перечень конкретных учебно-целевых вопросов
- •Тема 6. Микробиология бактериальных кишечных инфекций: патогенные кишечные палочки, иерсинии, кампилобактерии, хеликобактерии
- •Перечень конкретных учебно-целевых вопросов
- •Тема 7. Микробиология бактериальных кишечных инфекций: возбудители дизентерии, холеры. Пищевые интоксикации бактериальной природы
- •Перечень конкретных учебно-целевых вопросов
- •Тема 8. Возбудители бактериальных воздушно-капельных инфекций: дифтерии, коклюша, гемофильной и пневмококковой инфекции
- •Перечень конкретных учебно-целевых вопросов
- •Тема 9. Возбудители бактериальных воздушно-капельных бактериальных инфекций: туберкулеза, менингококовой инфекции и актиномикоза
- •Перечень конкретных учебно-целевых вопросов
- •Тема 10. Возбудители бактериальных инфекций, передающихся половым путем: гонореи, сифилиса, бактериального вагиноза, урогенитального хламидиоза и микоплазмоза.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 11. Возбудители риккетсиозов.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 13. Итоговое занятие по частной бактериологии
- •Тема 14. Общая вирусология: морфология и ультраструктура вирусов, методы их культивирования. Экспресс-диагностика вирусных инфекций.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 15. Общая вирусология: диагностика вирусных инфекций. Вирусологический метод исследования. Индикация и идентификация вирусов. Серологический метод диагностики вирусных инфекций.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 16. Вирусы - возбудители гриппа и орви. Парамиксовирусы - возбудители кори и эпидемического паротита. Вирусы, поражающие кожу и слизистые оболочки (поксвирусы, герпесвирусы). Коронавирусы
- •Перечень конкретных учебно-целевых вопросов
- •Тема 17. Пикорнавирусы. Вирусы гепатитов. Ротавирусы
- •Перечень конкретных учебно-целевых вопросов
- •Тема 18. Арбовирусы. Нейровирусы. Онкогенные вирусы. Медленные вирусные инфекции. Ретровирусы
- •Перечень конкретных учебно-целевых вопросов
- •Вопросы для самостоятельного изучения
- •Тема 19. Патогенные грибы. Возбудители глубоких и субкутанных микозов, дерматомикозов, оппортунистических микозов
- •Перечень конкретных учебно-целевых вопросов
- •П е р е ч е н ь
- •Прикладные компьютерные разработки по микробиологии, вирусологии, иммунологии Презентации лекций Общая микробиология
- •Частная микробиология и вирусология
- •Глоссарий (словарь терминов по микробиологии, вирусологии, иммунологии)
- •3. Контроль качества подготовки
- •Тема 3. Морфология и классификация бактерий, спирохет, риккетсий, хламидий, микоплазм и актиномицетов. Перечень конкретных учебно-целевых вопросов
- •Тема 10. Экология микроорганизмов. Микр0флора организма человека. Микробиологические основы химиотерапии инфекционных болезней. Перечень конкретных учебно-целевых вопросов
- •Тема 11. Экология микроорганизмов. Микробиология воды, воздуха, почвы, пищевых продуктов Перечень конкретных учебно-целевых вопросов
- •Тема 12. Учение об инфекции. Факторы патогенности бактерий. Роль макроорганизма, внешней среды и социальных условий в развитии инфекции. Формы инфекции Перечень конкретных учебно-целевых вопросов
- •Тема 13. Учение об иммунитете. Виды иммунитета. Неспецифическая резистентность. Серологические реакции Перечень конкретных учебно-целевых вопросов
- •Тема 14. Учение об иммунитете. Серологические реакции. Антигены и их характеристика. Перечень конкретных учебно-целевых вопросов
- •Тема 15. Учение об иммунитете. Клетки иммунной системы. Иммунный статус организма человека и методы его оценки. Современные иммунологические методы Перечень конкретных учебно-целевых вопросов
- •Тема 16. Учение об иммунитете. Специфическая профилактика и лечение инфекционных заболеваний. Диагностические биопрепараты. Аллергены Перечень конкретных учебно-целевых вопросов
- •Тема 17. Учение об инфекции и иммунитете. Практические аспекты иммунологии. Контрольное занятие (тестовый контроль и устное собеседование) частная микробиология
- •Перечень конкретных учебно-целевых вопросов
- •Тема 2. Возбудители раневой анаэробной инфекции: анаэробной газовой инфекции, столбняка. Бактероиды. Перечень конкретных учебно-целевых вопросов
- •Тема 4. Возбудители бактериальных зоонозных инфекций: бруцеллеза, лептоспироза, боррелиозов, листериоза Перечень конкретных учебно-целевых вопросов
- •Тема 5. Микробиология бактериальных кишечных инфекций: сальмонеллы - возбудители брюшного тифа, паратифов и пищевых токсикоинфекций Перечень конкретных учебно-целевых вопросов
- •Тема 7. Микробиология бактериальных кишечных инфекций: возбудители дизентерии, холеры. Пищевые интоксикации бактериальной природы Перечень конкретных учебно-целевых вопросов
- •Тема 8. Возбудители бактериальных воздушно-капельных инфекций: дифтерии, коклюша, гемофильной и пневмококковой инфекции Перечень конкретных учебно-целевых вопросов
- •Тема 9. Возбудители бактериальных воздушно-капельных бактериальных инфекций: туберкулеза, менингококовой инфекции и актиномикоза Перечень конкретных учебно-целевых вопросов
- •Тема 11. Возбудители риккетсиозов. Перечень конкретных учебно-целевых вопросов
- •Тема 12. Общая вирусология: морфология и ультраструктура вирусов, методы их культивирования. Экспресс-диагностика вирусных инфекций. Перечень конкретных учебно-целевых вопросов
- •Вопросы для самостоятельного изучения
- •Тема 15. Пикорнавирусы. Вирусы гепатитов. Ротавирусы Перечень конкретных учебно-целевых вопросов
- •Вопросы для самостоятельного изучения
- •Тема 16. Арбовирусы. Нейровирусы. Онкогенные вирусы. Медленные вирусные инфекции. Ретровирусы Перечень конкретных учебно-целевых вопросов
- •Вопросы для самостоятельного изучения
- •Тема 17. Патогенные грибы. Возбудители глубоких и субкутанных микозов, дерматомикозов, оппортунистических микозов Перечень конкретных учебно-целевых вопросов
- •Тема 18. Микробиологическая диагностика протозойных инфекций
- •Физиология бактерий
- •1) Температурный режим
- •Бактериофаги
- •Генетика бактерий
- •2) Дезоксирибоза
- •1) Рибоза
- •Экология микроорганизмов. Санитарная бактериология
- •Микрофлора организма человека. Химиотерапия
- •Инфектология и иммунология
- •Частная бактериология возбудители гнойно-воспалительных инфекций
- •Анаэробные инфекции
- •Зоонозные инфекции бактериальной этиологии
- •Возбудители кишечных инфекций
- •Возбудители воздушно-капельных инфекций
- •Возбудители заболеваний, передающихся половым путем
- •Возбудители риккетсиозов, хламидиозов, микоплазмозов
- •Общая вирусология
- •Частная вирусология
- •3. Т- лимфоцитов
- •Возбудители микозов
- •3. Ситуационные задачи
- •Д) Enterococcus faecalis
- •3 Borrelia recurrentis
- •2 Rickettsia typhi
- •3 Fusobacterium necrophorum
- •4 Bacteroides fragilis
- •3 Veillonella parvula
- •4 Peptostreptococcus anaerobius
- •3 Trichomonas vaginalis
- •4 Treponema pallidum
- •1 Salmonella enteritidis
- •4 Salmonella typhi
- •3 Пищевая токсикоинфекция.
- •3 Паратиф в.
- •2 Salmonella typhimurium
- •4 Salmonella cholerae suis
- •2 Пищевая токсикоинфекция.
- •4 Пищевая токсикоинфекция.
- •1 Брюшной тиф.
- •3 Salmonella paratyphi a
- •4 Salmonella schottmulleri
- •1 Vibrio cholere
- •2 Vibrio Eltor
- •4 Shigella boydii
- •3 Непрямая риф-200
- •3 Пунктат региональных лимфоузлов
- •3 Морские свинки
- •2. Clostridium perfringens a
- •2. Bordetella pertussis
- •3. Bordetella parapertussis
- •2. Neisseria meningitidis
- •4. Bacillus anthracis
- •5. Yersinia
- •3. Vibrio
- •Г) Yersinia enterocolitica
- •Г) Yersinia enterocolitica
- •Г) Yersinia enterocolitica
- •В) Shigella sonnei
- •В) Shigella sonnei
- •4. Инструменты, приборы
- •Итоговый контроль
- •1. Экзаменационные вопросы
- •1. Морфология микроорганизмов
- •2. Физиология микроорганизмов.
- •3. Инфекция и иммунитет.
- •2. П е р е ч е н ь практических умений
- •3. Экзаменационные билеты по микробиологии
- •Микропрепараты
- •Вакцины, сыворотки, иммуноглобулины
- •Бактериофаги и пробиотики для клинического применения
- •Диагностические препараты
- •5. Тест для итогового контроля знаний студентов
- •6. Инструменты, приборы
- •7.Ситуационные задачи
Педиатрические аспекты темы
1. Обратить внимание на особенности фагоцитарной реакции, незавершенность фагоцитоза у новорожденных детей.
Изучение неспецифических факторов резистентности организма проводится в сравнительном аспекте – в детском и взрослом организме, отмечается большое значение неспецифических факторов защиты в детском организме.
3. Развитие клеточных неспецифических механизмов защиты. Особенности воспалительной реакции у детей раннего возраста. Незавершенность фагоцитоза.
Тема 14. Учение об иммунитете. Серологические реакции. Антигены и их характеристика. Самостоятельная работа студентов
1. Постановка и учет реакции связывания комплемента (РСК). Реакция протекает в две фазы. В первой фазе реакции участвуют антиген, антитело, комплемент. При соответствии антигена антителу образуется комплекс, связывающий комплемент. При отсутствии соответствия антигена и антитела комплемент остается свободным. Вторая фаза реакции (индикаторная) выявляет связывание комплемента и происходит между комплементом и реагентами гемолитической системы (смесь взвеси эритроцитов барана и гемолитической сыворотки). Если комплемент связан в первой фазе реакции, гемолиза эритроцитов под действием гемолизинов не происходит ( задержка гемолиза - реакция положительна); если комплемент свободен, наблюдается гемолиз (реакция отрицательна). Реакцию ставят в соответствии с таблицей 11.
Таблица 11
Схема постановки реакции связывания комплемента
|
Компоненты реакции |
Опыт |
КПС |
КОС |
КС |
КА |
КК |
КГС |
|
Сыворотка больного 1:5, мл |
0,5 |
- |
- |
0,5 |
- |
- |
- |
|
Антиген в рабочем титре, мл |
0,5 |
0,5 |
0,5 |
- |
0,5 |
0,5 |
- |
|
Комплемент в рабочей дозе, мл |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
|
Положительная сыворотка, мл |
- |
0,5 |
- |
- |
- |
- |
- |
|
Отрицательная сыворотка, мл |
- |
- |
0,5 |
- |
- |
- |
- |
|
Физиологический раствор |
- |
- |
- |
0,5 |
0,5 |
0,5 |
1,0 |
|
Инкубация при 370 С в течение 30 минут | |||||||
|
Гемолитическая система |
1,0 |
1,0 |
1,0 |
1,0 |
1,0 |
1,0 |
1,0 |
|
Инкубация при при 370 С в течение 30 минут, учет результатов | |||||||
Обозначения: КПС – контроль положительной сыворотки, КОС – контроль отрицательной сыворотки, КА- контроль антигена, КК – контроль комплемента, КГС – контроль гемолитической системы
2. Постановка и учет реакции кольцепреципитации по Асколи. Реакция Асколи используется для выявления термостабильного антигена возбудителя сибирской язвы в материале (кожа, шерсть), подозрительном на загрязнение данными микробами. Техника постановки реакции: в преципитационную пробирку наливают цельную преципитирующую сибиреязвенную сыворотку в количестве 0,5 мл. Пастеровской пипеткой наслаивают по стенке пробирки 0,5 мл исследуемого антигена. Антиген готовят путем кипячения материала в растворе кислоты. В контрольную пробирку добавляют вместо антигена физиологический раствор. В случае положительного результата на границе антигена и сыворотки образуется преципитат в виде кольца.
3. Учет реакции преципитации в геле для определения токсигенности дифтерийных бактерий (демонстрация). Чашку Петри заливают питательным агаром, на дно чашки накладывают полоску фильтровальной бумаги, пропитанной противодифтерийной антитоксической сывороткой. Перпендикулярно полоске бумаги засевают исследуемую культуру. Посев инкубируют при 37°С в течение 24 часов. Выделяющийся при росте дифтерийной палочки токсин диффундирует в питательную среду и вступает в реакцию с антитоксическими антителами. В местах взаимодействия дифтерийного токсина с антителами формируется преципитат в виде беловатых линий.
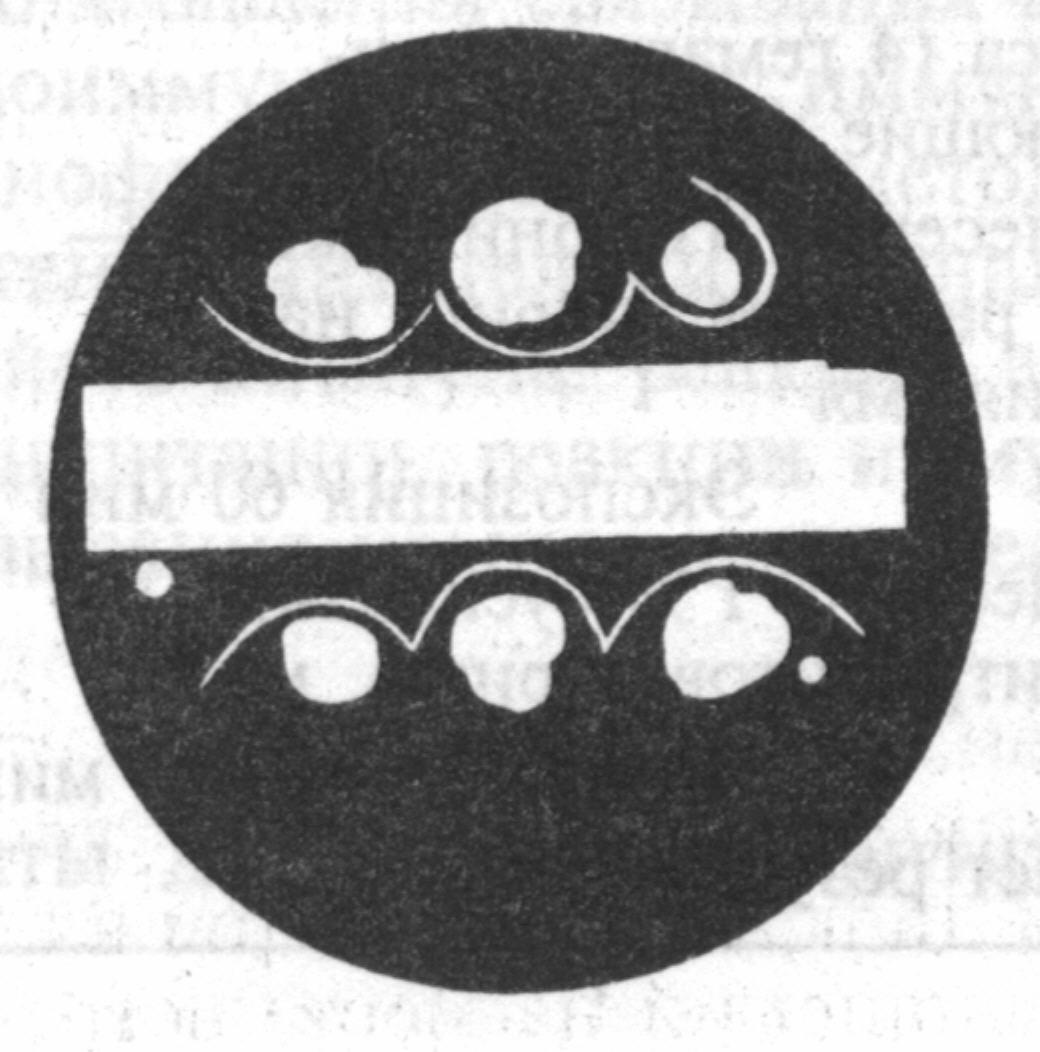
Рис. 15. Реакция преципитации в геле для определения токсигенности дифтерийных бактерий
4. Иммуноэлектрофорез (демонстрация). С помощью иммуноэлектрофореза анализируют различные антигены микробов и вирусов, антитела, сыворотку крови человека, ликвор и т.д. Исследуемый материал вносят в лунку, расположенную в геле на стеклянной пластине и разделяют его фракции электрофорезом. Затем в лунку, вырезанную в геле параллельно линии электрофоретической миграции белков, вносят сыворотки против антигенов, которые хотят обнаружить (например, против антигенов менингококка). Антитела сыворотки диффундируют в агар и в местах встречи с соответствующими антигенами образуют зоны преципитации в виде дуги.
5. Реакция нейтрализации токсина антитоксином при ботулизме (демонстрация). Реакцию ставят с фильтратом, полученным из консервов домашнего приготовления (например, из грибов), послуживших причиной отравления больного. К фильтрату добавляют поливалентную противоботулиническую сыворотку в разведении 1:40. Смесь выдерживают 2 часа при температуре 370 С, вводят мыши внутрибрюшинно в объеме 0, 5 мл. Контрольной мыши вводят 0,5 мл фильтрата. Если токсин, содержащийся в фильтрате, соответствует сыворотке, то произойдет нейтрализация токсина и мышь не погибнет. Контрольная мышь погибает с явлениями параличей.
6. Учет реакции Кумбса (демонстрация). Реакция Кумбса позволяет выявить неполные (одновалентные) антитела, которые при соединении с эритроцитами, бактериями и риккетсиями не дают видимых эффектов реакции антиген-антитело. Прибавление кроличьей сыворотки против глобулинов человека приводит к агглютинации, т.к. антитела этой сыворотки бивалентны и взаимодействуют с неполными антителами, связанными с бактериями или эритроцитами, с образованием осадка.
Реакция Кумбса при бруцеллезе ставится в тех случаях, когда титр классического варианта реакции агглютинации меньше диагностического ( 1:100). Добавление в пробирки с отрицательными результатами антиглобулиновой сыворотки приводит к увеличению титра антител. Это связано с тем, что неполные антитела появляются в крови больных в более ранние сроки и в более высоких титрах, чем полные.
7. Реакция флоккуляции (демонстрация). В результате взаимодействия токсина или анатоксина с антитоксической сывороткой выпадают хлопья флоккулята. Наиболее интенсивная и ранняя (инициальная) флоккуляция происходит в пробирке, где антиген и антитело содержатся в эквивалентных соотношениях.
Реакцию ставят в два этапа. Сначала по стандартной сыворотке устанавливают пороговую величину флоккуляции Lf (Limes flocculationis) в 1 мл токсина. Lf токсина определяется его минимальным количеством, которое дает инициальную флоккуляцию с 1 международной единицей (ME) сыворотки. Затем известной силы токсин и испытуемую антитоксическую сыворотку разливают в пробирки в определенном объеме, выдерживают в водяной бане при температуре 45 °С в течение 30 мин до выпадения хлопьев в одной из них.
Инициальная флоккуляция проявляется в той пробирке, где количество токсина соответствует количеству международных единиц сыворотки. Если флоккуляция произошла в 3-й пробирке, в 0,4 мл сыворотки находится 40 ME. Следовательно, 1 мл сыворотки содержит 40:0,4=100 ME.
8. Антистрептолизиновая реакция (демонстрация). Реакция основана на феномене нейтрализации гемолитического действия микробного токсина (0-стрептолизина) антитоксическими антителами иммунной сыворотки.
Для постановки реакции предварительно определяют минимальную гемолитическую дозу токсина (0-стрептолизина), т.е. наименьшее его количество, которое вызывает гемолиз 0,2 мл 5% взвеси эритроцитов кролика. Затем определяют рабочую дозу 0-стрептолизина, т.е. наибольшее количество токсина, которое в смеси с 1 АЕ (антитоксической единицы) стандартной антитоксической сыворотки полностью нейтрализуется и не вызывает гемолиза эритроцитов. Для постановки основного опыта готовят разведения исследуемой сыворотки, к каждому из которых добавляют рабочую дозу токсина, инкубируют 45 мин при 370 С, затем вносят равный объем взвеси эритроцитов и инкубируют 1 час при 370 С и 18 часов при комнатной температуре. Обязательным является контроль на возможность спонтанного гемолиза эритроцитов. Положительная реакция характеризуется отсутствием гемолиза в результате нейтрализации стрептолизина (гемолизина) соответствующими антителами. Студенты производят учет демонстрационной реакции.
9. Реакция торможения гемагглютинации (РТГА - демонстрация) основана на взаимодействии вирусных антигенов (гемагглютининов) со специфическими антителами, в результате чего происходит блокада (торможение) гемагглютинирующей активности вируса.
Развернутую РТГА ставят в лунках полистироловых пластин. Предварительно определяют титр вирусного антигена в реакции гемагглютинации для подбора рабочей дозы. В лунках готовят 2-кратные разведения исследуемой сыворотки, добавляют равный объем взвеси вируса в рабочем разведении и инкубируют 2 ч при температуре 370 С. Затем добавляют 1 % взвеси куриных эритроцитов, инкубируют 2 ч и оценивают результат по феномену торможения гемагглютинации. Положительная РТГА характеризуется образованием плотного осадка эритроцитов на дне лунки в виде диска или кольца с ровными краями. Титр антител определяют по последней лунке с положительной РТГА. Произвести учет демонстрационной РТГА.
