
- •Государственное образовательное учреждение
- •Нормативные документы
- •2. Требования к уровню подготовки абитуриента
- •3.Общие требования к основной образовательной программе подготовки выпускника по специальности
- •040100 - Лечебное дело
- •4. Требования к обязательному минимуму содержания
- •Основной образовательной программы
- •Подготовки врача
- •По специальности 040100 - Лечебное дело
- •5. Сроки освоения основной образовательной программы выпускника
- •6. Требования к разработке и условиям реализации
- •6.1. Требования к разработке основной образовательной программы подготовки Врача
- •6.2. Требования к кадровому обеспечению учебного процесса
- •6.3. Требования к учебно-методическому обеспечению учебного процесса
- •6.4. Требования к материально-техническому обеспечению учебного процесса.
- •6.5. Требования к организации практик
- •7. Требования к уровню подготовки выпускника
- •7.1. Требования к профессиональной подготовленности специалиста.
- •7.2. Требования к итоговой государственной аттестации выпускника.
- •П о л о ж е н и е
- •1. Общие положения.
- •2. Структура, состав и содержание умк.
- •3. Порядок рассмотрения и утверждения умк.
- •Положение
- •Текущий и рубежный контроль учебных достижений
- •Промежуточная аттестация
- •Положение о рейтинговой системе оценки учебных достижений студентов Ярославской государственной медицинской академии
- •Положение о рейтинговой системе на кафедре микробиологии с вирусологией и иммунологией
- •По формуле:
- •Положение об итоговой аттестации студентов на кафедре микробиологии с вирусологией и иммунологией в 2008/2009 учебном году
- •Учебно-методические документы
- •Программа
- •Введение
- •1. Микробиология
- •1.1. История развития микробиологии
- •1.2. Связь микробиологии с другими дисциплинами.
- •Общая микробиология
- •2. Общая бактериология, микология,
- •2.1. Систематика микробов
- •2.2. Морфология микробов
- •2.3. Физиология микробов
- •2.4. Генетика микробов
- •2.5. Экология микробов
- •2.6. Микрофлора организма человека и ее функции
- •2.7. Влияние факторов окружающей среды на микробы
- •2.8. Антибиотики
- •3. Учение об инфекции
- •3.1. Роль микроорганизмов в инфекционном процессе
- •3.2. Роль макроорганизма в инфекционном процессе
- •3.3. Понятие о патогенезе инфекционных болезней
- •4. Медицинская иммунология
- •4.1. Задачи и история развития иммунологии
- •4.2. Неспецифические факторы защиты организма человека
- •4.3. Антигены
- •4.4. Иммунная система организма человека
- •4.5. Специфические формы иммунного ответа
- •4.6. Аллергические реакции
- •4.8. Иммунный статус человека
- •4.9. Методы оценки иммунного статуса
- •4.10. Иммунопатология
- •4.11. Иммунопрофилактика, иммунотерапия и иммунокоррекция
- •4.12. Иммунобиологические препараты
- •4.13. Иммунологические реакции в диагностике инфекционных
- •4.14. Биотехнология и генная инженерия
- •Частная медицинская микробиология
- •1. Бактерии – возбудители инфекционных
- •1.1. Грамположительные кокки
- •1.2. Грамотрицательные кокки
- •1.3. Грамотрицательные факультативно анаэробные палочки
- •1.4. Грамотрицательные аэробные палочки
- •1.5. Грамотрицательные анаэробные палочки
- •1.6. Грамположительные спорообразующие палочки
- •1.7. Грамположительные правильной формы палочки
- •1.8. Грамположительные неправильной формы палочки
- •1.9. Спирохеты и другие спиральные, изогнутые бактерии
- •1.10. Риккетсии. Эрлихии. Коксиеллы
- •1.11. Хламидии
- •1.12. Микоплазмы
- •4.2. Рнк-геномные вирусы
- •4.3. Онкогенные вирусы
- •4.4. Медленные вирусные инфекции
- •5. Клиническая микробиология
- •Рекомендуемый план лекций для студентов лечебных и медико-профилактических факультетов
- •IV семестр (18 недель – 36 часов)
- •V семестр (19 недель – 38 часов)
- •Рекомендуемый план практических занятий для студентов лечебных факультетов
- •IV семестр (18 недель – 18 занятий по 3 часа)
- •Рекомендуемый план практических занятий для студентов медико-профилактических факультетов
- •Тематический план лекций для студентов педиатрических факультетов (64 часа)
- •Тематический план практических занятий для студентов педиатрических факультетов (120 часов)
- •Конечные цели обучения дисциплине
- •Рекомендуемый перечень экзаменационных вопросов
- •Дополнительный перечень вопросов для студентов педиатрических факультетов
- •Дополнительный перечень вопросов для студентов стоматологического факультета
- •Литература
- •Государственное образовательное учреждение
- •1.Цель и задачи дисциплины
- •2. Содержание дисциплины
- •2.1.Наименование тем, их содержание и объем в часах.
- •2.2. Семинарские занятия, их содержание и объем в часах.
- •2.3.Лабораторные занятия.
- •3. Учебно-методические материалы по дисциплине
- •П р о т о к о л
- •Перечень основной и дополнительной литературы а. Основная:
- •Б. Дополнительная
- •Руководство к практическим занятиям
- •Предмет и задачи медицинской микробиологии.
- •Аппаратура, используемая в микробиологической лаборатории:
- •Самостоятельная работа студентов
- •Правила работы в микробиологических лабораториях.
- •3. Освоение техники микроскопии с иммерсионным объективом:
- •Разрешающая способность иммерсионного микроскопа – 0,2-0,4 мкм.
- •5. Освоение техники приготовления мазка из агаровой культуры бактерий и окраски его простым способом:
- •Педиатрические аспекты
- •Тема 2. Морфология микроорганизмов. Структура бактериальной клетки Самостоятельная работа студентов
- •2. Выявление включений волютина у дифтерийной палочки – Corynebacterium diphtheriae (окраска по Нейссеру) – рис.6.
- •Тема 3. Морфология и классификация бактерий, спирохет, риккетсий, хламидий, микоплазм и актиномицетов. Самостоятельная работа студентов
- •3. Выявление подвижности протея методом «раздавленной капли».
- •Все микропрепараты описать, зарисовать.
- •2. Знакомство с методами асептики, антисептики, дезинфекции и стерилизации.
- •Тема 5. Физиология бактерий. Дыхание и размножение бактерий. Методы культивирования аэробов и анаэробов Самостоятельная работа студентов
- •2. Выделение чистой культуры анаэробных бактерий из почвы (демонстрация).
- •Тема 6. Физиология бактерий. Ферменты бактерий. Выделение чистых культур аэробных и анаэробных бактерий
- •Перечень конкретных учебно-целевых вопросов
- •Самостоятельная работа студентов
- •Тема 7. Ферменты бактерий. Бактериологический метод исследования. Итоговое занятие по теме "морфология и физиология микробов» Самостоятельная работа студентов.
- •Тема 8. Вирусы бактерий (бактериофаги)
- •Самостоятельная работа студентов
- •Тема 9. Генетика микроооганизмов. Самостоятельная работа студентов
- •2. Изучение характера роста s (e.Coli) и r (b. Cereus) форм бактерий на плотной и жидкой питательных средах (демонстрация).
- •Педиатрические аспекты
- •Тема 10. Экология микроорганизмов. Микр0флора организма человека. Микробиологические основы химиотерапии инфекционных болезней. Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 11. Экология микроорганизмов. Микробиология воды, воздуха, почвы, пищевых продуктов
- •Перечень конкретных учебно-целевых вопросов
- •Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 12. Учение об инфекции. Факторы патогенности бактерий. Роль макроорганизма, внешней среды и социальных условий в развитии инфекции. Формы инфекции Самостоятельная работа студентов.
- •Педиатрические аспекты темы
- •Тема 13. Учение об иммунитете. Виды иммунитета. Неспецифическая резистентность. Серологические реакции
- •Перечень конкретных учебно-целевых вопросов
- •Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 14. Учение об иммунитете. Серологические реакции. Антигены и их характеристика. Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 15. Учение об иммунитете. Клетки иммунной системы. Иммунный статус организма человека и методы его оценки. Современные иммунологические методы
- •Перечень конкретных учебно-целевых вопросов
- •Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 16. Учение об иммунитете. Специфическая профилактика и лечение инфекционных заболеваний. Диагностические биопрепараты. Аллергены
- •Перечень конкретных учебно-целевых вопросов
- •Самостоятельная работа студентов
- •Вакцины и анатоксины
- •Сыворотки и иммуноглобулины.
- •А л л е р г е н ы
- •В а к ц и н ы д л я л е ч е н и я
- •Методы диагностических микробиологических исследований Методы обнаружения возбудителя инфекции в материале от больного
- •Биохимические и молекулярно-биологические методы диагностики
- •Оценка результатов клинико-диагностических микробиологических исследований
- •Микробиологическая диагностика стафилококковых инфекций
- •Самостоятельная работа студентов
- •Микробиологическая диагностика стрептококковых инфекций.
- •Самостоятельная работа студентов
- •Микробиологическая диагностика заболеваний, вызываемых гноеродными условно-патогенными грамотрицательными аэробными микроорганизмами.
- •Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 2. Возбудители раневой анаэробной инфекции: анаэробной газовой инфекции, столбняка. Бактероиды. Микробиологическая диагностика анаэробной инфекции.
- •Самостоятельная работа студентов.
- •Микробиологическая диагностика столбняка.
- •Самостоятельная работа студентов.
- •4. Ознакомление с биопрепаратами, применяемыми для специфической профилактики и терапии столбняка:
- •Микробиологическая диагностика неклостридиальной анаэробной инфекции
- •Педиатрические аспекты темы
- •Тема 3. Возбудители бактериальных зоонозных инфекций: чумы, туляремии, сибирской язвы
- •Перечень конкретных учебно-целевых вопросов
- •Микробиологическая диагностика чумы.
- •Микроскопический метод
- •Бактериологический метод.
- •Биопроба
- •А б
- •Самостоятельная работа студентов
- •Микробиологическая диагностика туляремии
- •Биологический и бактериологический метод.
- •Биопроба
- •Самостоятельная работа студентов
- •2. Серологический метод диагностики туляремии.
- •Микробиологическая диагностика сибирской язвы
- •Бактериологический метод.
- •Микроскопический метод.
- •Биопроба
- •Самостоятельная работа студентов
- •Педиатрические аспекты темы
- •Тема 4. Возбудители бактериальных зоонозных инфекций: бруцеллеза, лептоспироза, боррелиозов, листериоза Микробиологическая диагностика бруцеллеза
- •Бактериологический метод.
- •Биопроба
- •Самостоятельная работа студентов
- •Микробиологическая диагностика лептоспироза
- •Микроскопический метод.
- •Бактериологический метод.
- •Биопроба
- •Самостоятельная работа студентов
- •4. Знакомоство с биопрепаратами для профилактики и лечения лептоспироза.
- •Микробиологическая диагностика боррелиозов (возвратные тифы, болезнь Лайма)
- •Самостоятельная работа студентов
- •Микробиологическая диагностика листериоза
- •Педиатрические аспекты темы
- •Серологический метод
- •Самостоятельная работа студентов
- •1. Бактериологический метод – выделение гемокультуры:
- •2. Серологический метод диагностики тифо-паратифозных заболеваний.
- •Педиатрические аспекты темы
- •Микробиологическая диагностика сальмонеллезов
- •Серологический метод
- •Самостоятельная работа студентов
- •1. Учет посевов сальмонелл на среде Левина и Олькеницкого (демонстрация).
- •3. Идентификация выделенной культуры возбудителя:
- •Педиатрические аспекты темы
- •Тема 6. Микробиология бактериальных кишечных инфекций: патогенные кишечные палочки, иерсинии, кампилобактерии, хеликобактерии Микробиологическая диагностика эшерихиозов
- •Серологический метод - ра, рнга, ифа с целью выявления антител к эшерихиям и их динамики (исследование парных сывороток) в процессе инфекции.
- •Самостоятельная работа студентов
- •Микробиологическая диагностика иерсиниозов
- •Самостоятельная работа студентов
- •Микробиологическая диагностика кампилобактериозов
- •Самостоятельная работа студентов
- •Микробиологическая диагностика геликобактериоза
- •Самостоятельная работа студентов
- •Тема 7. Микробиология бактериальных кишечных инфекций: возбудители дизентерии, холеры. Пищевые интоксикации бактериальной природы Лабораторная диагностика бактериальной дизентерии.
- •Серологический метод. Постановка ра, рнга с целью выявления антител к шигеллам и их динамики (исследование парных сывороток) в процессе инфекции.
- •Самостоятельная работа студентов
- •3. Идентификация выделенной культуры шигелл:
- •Микробиологическая диагностика холеры
- •Серологический метод: Постановка ра, рнга, теста иммобилизации вибрионов с целью выявления антител к холерному вибриону и их динамики (исследование парных сывороток) в процессе инфекции.
- •Пищевые интоксикации бактериальной природы Лабораторная диагностика ботулизма
- •Самостоятельная работа студентов
- •Пищевые интоксикации бактериальной этиологии способны также вызывать:
- •Педиатрические аспекты темы.
- •Тема 8. Возбудители бактериальных воздушно-капельных инфекций: дифтерии, коклюша, гемофильной и пневмококковой инфекции Лабораторная диагностика дифтерии
- •Серологический метод
- •Самостоятельная работа студентов
- •4. Биопрепараты для диагностики, профилактики и лечения дифтерии.
- •Микробиологическая диагностика коклюша и паракоклюша
- •Серологический метод - ра и рск с парными сыворотками больных для констатации нарастания титра антител с целью ретроспективного подтверждения коклюша и диагностики его атипичных форм.
- •Самостоятельная работа студентов
- •4. Биопрепараты для диагностики, профилактики и лечения коклюша:
- •Педиатрические аспекты темы
- •Микробиологическая диагностика гемофильной инфекции
- •Микробиологическая диагностика бактериальных пневмоний и острых респираторных заболеваний (орз)
- •Самостоятельная работа студентов
- •Тема 9. Возбудители бактериальных воздушно-капельных бактериальных инфекций: туберкулеза, менингококовой инфекции и актиномикоза Лабораторная диагностика туберкулеза и микобактериозов
- •Самостоятельная работа студентов
- •Микробиологическая диагностика проказы
- •Микробиологическая диагностика менингококковой инфекции
- •4. Биопрепараты для диагностики и профилактики менингококковой инфекции:
- •Микробиологическая диагностика актиномикоза
- •Микробиологическая диагностика сифилиса
- •Самостоятельная работа студентов
- •2. Серологическая диагностика сифилиса.
- •3. Ознакомиться с препаратами для диагностики и лечения сифилиса:
- •Микробиологическая диагностика мягкого шанкра
- •Микробиологическая диагностика гонореи
- •Самостоятельная работа студентов
- •3. Изучить препараты для диагностики и лечения гонореи.
- •Микробиологическая диагностика урогенитального микоплазмоза
- •Лабораторная диагностика урогенитального хламидиоза
- •Самостоятельная работа студентов
- •Микробиологическая диагностика бактериального вагиноза
- •Самостоятельная работа студентов.
- •Тема 11. Возбудители риккетсиозов. Микробиологическая диагностика риккетсиозов
- •Микробиологическая диагностика эпидемического сыпного тифа.
- •Микробиологическая диагностика эндемического сыпного тифа.
- •Микробиологическая диагностика Ку-лихорадка.
- •Микробиологическая диагностика эрлихиозов
- •Микробиологическая диагностика бартонеллезов
- •Самостоятельная работа студентов
- •3. Серологический метод диагностики сыпного тифа:
- •Педиатрические аспекты темы
- •Тема 12. Общая вирусология: морфология и ультраструктура вирусов, методы их культивирования. Экспресс-диагностика вирусных инфекций. Методы лабораторной диагностики вирусных инфекций
- •Взятие и подготовка материала для вирусологической диагностики
- •Выделение вирусов на развивающихся куриных эмбрионах
- •Выделение вирусов на экспериментальных животных.
- •Самостоятельная работа студентов
- •1. Изучение морфологии вирусов по электронограммам.
- •Индикация вирусов
- •Учет вирусиндуцированных патологических изменений в чувствительных живых системах.
- •Серологический метод диагностики вирусных инфекций
- •Самостоятельная работа студентов
- •2. Индикация вирусов в клетках культуры ткани:
- •3. Выделение и индикация вирусов на ркэ.
- •4. Идентификация вирусов:
- •Самостоятельная работа студентов
- •Вирусологическая диагностика натуральной оспы
- •Вирусологическая диагностика герпеса
- •Вирусологическая диагностика кори
- •Вирусологическая диагностика краснухи.
- •Вирусологическая диагностика эпидемического паротита.
- •Самостоятельная работа студентов
- •Тема 15. Пикорнавирусы. Вирусы гепатитов. Ротавирусы Вирусологическая диагностика пикорнавирусных инфекций Энтеровирусные инфекции
- •Самостоятельная работа студентов
- •4. Изучить биопрепараты для профилактики, диагностики и лечения:
- •Гепатит а
- •Гепатит в
- •Другие гепатиты
- •Самостоятельная работа студентов
- •1. Лабораторная диагностика вирусных гепатитов
- •Вирусологическая диагностика ротавирусных гастроэнтеритов.
- •Тема 16. Арбовирусы. Нейровирусы. Онкогенные вирусы. Медленные вирусные инфекции. Ретровирусы Вирусологическая диагностика нейровирусных инфекций Арбовирусные инфекции
- •Самостоятельная работа студентов
- •3. Изучить биопрепараты для профилактики, диагностики и лечения клещевого энцефалита:
- •Бешенство
- •Самостоятельная работа студентов
- •2. Изучить биопрепараты, используемые для специфической профилактики и лечения бешенства:
- •Лабораторная диагностика вич-инфекции
- •Самостоятельная работа студентов
- •Вирусологическая диагностика парвовирусных инфекций
- •Вирусологическая диагностика аренавирусных инфекций
- •Вирусологическая диагностика филовирусных инфекций (Марбургская лихорадка и лихорадка Эбола)
- •Тема 17. Патогенные грибы. Возбудители глубоких и субкутанных микозов, дерматомикозов, оппортунистических микозов
- •Элементы общей микологии и принципы лабораторной
- •Диагностики микозов
- •Биологические свойства грибов
- •Лабораторная диагностика микозов
- •Лабораторная диагностика отдельных микозов Лабораторная диагностика глубоких (системных) микозов
- •Криптокккоз
- •Североамериканский бластомикоз (болезнь Джилкрайста—Стокса)
- •Южноамериканский бластомикоз (паракокцидиоидоз)
- •Хромомикоз
- •Лабораторная диагностика эпидермомикозов Рубромикоз (руброфития).
- •Эпидермофития паховая.
- •Эпидермофития стоп.
- •Трихомикозы Трихофития
- •Микроспория.
- •Фавус (парша).
- •Лабораторная диагностика поверхностных микозов
- •Лабораторная диагностика микозов, вызываемых условно-патогенными грибами (оппортунистические микозы)
- •Кандидоз (кандидамикоз)
- •Другие оппортунистические микозы
- •Аспергиллез
- •Пенициллиоз
- •Фикомикоз (мукороз)
- •Пневмоцистоз
- •Самостоятельная работ студентов Лабораторная диагностика эпидермомикозов.
- •Лабораторная диагностика кандидозов.
- •Лабораторная диагностика глубоких микозов.
- •2. Серологический метод:
- •Педиатрические аспекты темы
- •Тема 18. Микробиологическая диагностика протозойных инфекций
- •Перечень конкретных учебно-целевых вопросов
- •Основные методы лабораторной диагностики протозойных инфекций
- •Малярия
- •Криптоспоридиоз
- •Токсоплазмоз
- •Трипаносомоз
- •Лейшманиоз
- •Лямблиоз
- •Трихомониаз
- •Амебиаз
- •Балантидиаз
- •Самостоятельная работ студентов
- •Взятие спинномозговой жидкости
- •Взятие мочи
- •Взятие желчи.
- •Взятие материала из дыхательных путей
- •Взятие материала из уха.
- •Взятие отделяемого из ран, язв, брюшной полости
- •Взятие материала из глаз.
- •Взятие материала из женских половых органов
- •Взятие материала при аутопсии
- •Взятие, условия хранения и доставки венозной крови для проведения ифа и пцр.
- •Правила взятия и доставки биологических материалов для вирусологических исследований
- •Методические материалы и рекомендации для преподавателя о средствах и методах обучения, способах учебной деятельности
- •Тема 1. Морфология микроорганизмов. Микроскопический метод исследования микроорганизмов. Простые и сложные методы окраски бактерий
- •Перечень конкретных учебно-целевых вопросов
- •Тема 2. Морфология микроорганизмов. Структура бактериальной клетки
- •Перечень конкретных учебно-целевых вопросов
- •Тема 3. Морфология и классификация бактерий, спирохет, риккетсий, хламидий, микоплазм и актиномицетов.
- •Перечень конкретных учебно-целевых вопросов
- •Перечень конкретных учебно-целевых вопросов
- •Тема 5. Физиология бактерий. Дыхание и размножение бактерий. Методы культивирования аэробов и анаэробов
- •Перечень конкретных учебно-целевых вопросов
- •Тема 6. Физиология бактерий. Ферменты бактерий. Выделение чистых культур аэробных и анаэробных бактерий
- •Перечень конкретных учебно-целевых вопросов
- •Тема 7. Ферменты бактерий. Бактериологический метод исследования. Итоговое занятие по теме "морфология и физиология микробов»
- •Тема 8. Вирусы бактерий (бактериофаги)
- •Перечень конкретных учебно-целевых вопросов
- •Тема 9. Генетика микроооганизмов.
- •Тема 10. Экология микроорганизмов. Микр0флора организма человека. Микробиологические основы химиотерапии инфекционных болезней.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 11. Экология микроорганизмов. Микробиология воды, воздуха, почвы, пищевых продуктов
- •Перечень конкретных учебно-целевых вопросов
- •Тема 12. Учение об инфекции. Факторы патогенности бактерий. Роль макроорганизма, внешней среды и социальных условий в развитии инфекции. Формы инфекции
- •Перечень конкретных учебно-целевых вопросов
- •Тема 13. Учение об иммунитете. Виды иммунитета. Неспецифическая резистентность. Серологические реакции
- •Перечень конкретных учебно-целевых вопросов
- •Тема 14. Учение об иммунитете. Серологические реакции. Антигены и их характеристика.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 15. Учение об иммунитете. Клетки иммунной системы. Иммунный статус организма человека и методы его оценки. Современные иммунологические методы
- •Перечень конкретных учебно-целевых вопросов
- •Тема 16. Учение об иммунитете. Специфическая профилактика и лечение инфекционных заболеваний. Диагностические биопрепараты. Аллергены
- •Перечень конкретных учебно-целевых вопросов
- •Тема 17. Учение об инфекции и иммунитете. Практические аспекты иммунологии. Контрольное занятие (тестовый контроль и устное собеседование)
- •Частная микробиология
- •Перечень конкретных учебно-целевых вопросов
- •Тема 2. Возбудители раневой анаэробной инфекции: анаэробной газовой инфекции, столбняка. Бактероиды.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 3. Возбудители бактериальных зоонозных инфекций: чумы, туляремии, сибирской язвы
- •Перечень конкретных учебно-целевых вопросов
- •Тема 4. Возбудители бактериальных зоонозных инфекций: бруцеллеза, лептоспироза, боррелиозов, листериоза
- •Перечень конкретных учебно-целевых вопросов
- •Тема 5. Микробиология бактериальных кишечных инфекций: сальмонеллы - возбудители брюшного тифа, паратифов и пищевых токсикоинфекций
- •Перечень конкретных учебно-целевых вопросов
- •Тема 6. Микробиология бактериальных кишечных инфекций: патогенные кишечные палочки, иерсинии, кампилобактерии, хеликобактерии
- •Перечень конкретных учебно-целевых вопросов
- •Тема 7. Микробиология бактериальных кишечных инфекций: возбудители дизентерии, холеры. Пищевые интоксикации бактериальной природы
- •Перечень конкретных учебно-целевых вопросов
- •Тема 8. Возбудители бактериальных воздушно-капельных инфекций: дифтерии, коклюша, гемофильной и пневмококковой инфекции
- •Перечень конкретных учебно-целевых вопросов
- •Тема 9. Возбудители бактериальных воздушно-капельных бактериальных инфекций: туберкулеза, менингококовой инфекции и актиномикоза
- •Перечень конкретных учебно-целевых вопросов
- •Тема 10. Возбудители бактериальных инфекций, передающихся половым путем: гонореи, сифилиса, бактериального вагиноза, урогенитального хламидиоза и микоплазмоза.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 11. Возбудители риккетсиозов.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 13. Итоговое занятие по частной бактериологии
- •Тема 14. Общая вирусология: морфология и ультраструктура вирусов, методы их культивирования. Экспресс-диагностика вирусных инфекций.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 15. Общая вирусология: диагностика вирусных инфекций. Вирусологический метод исследования. Индикация и идентификация вирусов. Серологический метод диагностики вирусных инфекций.
- •Перечень конкретных учебно-целевых вопросов
- •Тема 16. Вирусы - возбудители гриппа и орви. Парамиксовирусы - возбудители кори и эпидемического паротита. Вирусы, поражающие кожу и слизистые оболочки (поксвирусы, герпесвирусы). Коронавирусы
- •Перечень конкретных учебно-целевых вопросов
- •Тема 17. Пикорнавирусы. Вирусы гепатитов. Ротавирусы
- •Перечень конкретных учебно-целевых вопросов
- •Тема 18. Арбовирусы. Нейровирусы. Онкогенные вирусы. Медленные вирусные инфекции. Ретровирусы
- •Перечень конкретных учебно-целевых вопросов
- •Вопросы для самостоятельного изучения
- •Тема 19. Патогенные грибы. Возбудители глубоких и субкутанных микозов, дерматомикозов, оппортунистических микозов
- •Перечень конкретных учебно-целевых вопросов
- •П е р е ч е н ь
- •Прикладные компьютерные разработки по микробиологии, вирусологии, иммунологии Презентации лекций Общая микробиология
- •Частная микробиология и вирусология
- •Глоссарий (словарь терминов по микробиологии, вирусологии, иммунологии)
- •3. Контроль качества подготовки
- •Тема 3. Морфология и классификация бактерий, спирохет, риккетсий, хламидий, микоплазм и актиномицетов. Перечень конкретных учебно-целевых вопросов
- •Тема 10. Экология микроорганизмов. Микр0флора организма человека. Микробиологические основы химиотерапии инфекционных болезней. Перечень конкретных учебно-целевых вопросов
- •Тема 11. Экология микроорганизмов. Микробиология воды, воздуха, почвы, пищевых продуктов Перечень конкретных учебно-целевых вопросов
- •Тема 12. Учение об инфекции. Факторы патогенности бактерий. Роль макроорганизма, внешней среды и социальных условий в развитии инфекции. Формы инфекции Перечень конкретных учебно-целевых вопросов
- •Тема 13. Учение об иммунитете. Виды иммунитета. Неспецифическая резистентность. Серологические реакции Перечень конкретных учебно-целевых вопросов
- •Тема 14. Учение об иммунитете. Серологические реакции. Антигены и их характеристика. Перечень конкретных учебно-целевых вопросов
- •Тема 15. Учение об иммунитете. Клетки иммунной системы. Иммунный статус организма человека и методы его оценки. Современные иммунологические методы Перечень конкретных учебно-целевых вопросов
- •Тема 16. Учение об иммунитете. Специфическая профилактика и лечение инфекционных заболеваний. Диагностические биопрепараты. Аллергены Перечень конкретных учебно-целевых вопросов
- •Тема 17. Учение об инфекции и иммунитете. Практические аспекты иммунологии. Контрольное занятие (тестовый контроль и устное собеседование) частная микробиология
- •Перечень конкретных учебно-целевых вопросов
- •Тема 2. Возбудители раневой анаэробной инфекции: анаэробной газовой инфекции, столбняка. Бактероиды. Перечень конкретных учебно-целевых вопросов
- •Тема 4. Возбудители бактериальных зоонозных инфекций: бруцеллеза, лептоспироза, боррелиозов, листериоза Перечень конкретных учебно-целевых вопросов
- •Тема 5. Микробиология бактериальных кишечных инфекций: сальмонеллы - возбудители брюшного тифа, паратифов и пищевых токсикоинфекций Перечень конкретных учебно-целевых вопросов
- •Тема 7. Микробиология бактериальных кишечных инфекций: возбудители дизентерии, холеры. Пищевые интоксикации бактериальной природы Перечень конкретных учебно-целевых вопросов
- •Тема 8. Возбудители бактериальных воздушно-капельных инфекций: дифтерии, коклюша, гемофильной и пневмококковой инфекции Перечень конкретных учебно-целевых вопросов
- •Тема 9. Возбудители бактериальных воздушно-капельных бактериальных инфекций: туберкулеза, менингококовой инфекции и актиномикоза Перечень конкретных учебно-целевых вопросов
- •Тема 11. Возбудители риккетсиозов. Перечень конкретных учебно-целевых вопросов
- •Тема 12. Общая вирусология: морфология и ультраструктура вирусов, методы их культивирования. Экспресс-диагностика вирусных инфекций. Перечень конкретных учебно-целевых вопросов
- •Вопросы для самостоятельного изучения
- •Тема 15. Пикорнавирусы. Вирусы гепатитов. Ротавирусы Перечень конкретных учебно-целевых вопросов
- •Вопросы для самостоятельного изучения
- •Тема 16. Арбовирусы. Нейровирусы. Онкогенные вирусы. Медленные вирусные инфекции. Ретровирусы Перечень конкретных учебно-целевых вопросов
- •Вопросы для самостоятельного изучения
- •Тема 17. Патогенные грибы. Возбудители глубоких и субкутанных микозов, дерматомикозов, оппортунистических микозов Перечень конкретных учебно-целевых вопросов
- •Тема 18. Микробиологическая диагностика протозойных инфекций
- •Физиология бактерий
- •1) Температурный режим
- •Бактериофаги
- •Генетика бактерий
- •2) Дезоксирибоза
- •1) Рибоза
- •Экология микроорганизмов. Санитарная бактериология
- •Микрофлора организма человека. Химиотерапия
- •Инфектология и иммунология
- •Частная бактериология возбудители гнойно-воспалительных инфекций
- •Анаэробные инфекции
- •Зоонозные инфекции бактериальной этиологии
- •Возбудители кишечных инфекций
- •Возбудители воздушно-капельных инфекций
- •Возбудители заболеваний, передающихся половым путем
- •Возбудители риккетсиозов, хламидиозов, микоплазмозов
- •Общая вирусология
- •Частная вирусология
- •3. Т- лимфоцитов
- •Возбудители микозов
- •3. Ситуационные задачи
- •Д) Enterococcus faecalis
- •3 Borrelia recurrentis
- •2 Rickettsia typhi
- •3 Fusobacterium necrophorum
- •4 Bacteroides fragilis
- •3 Veillonella parvula
- •4 Peptostreptococcus anaerobius
- •3 Trichomonas vaginalis
- •4 Treponema pallidum
- •1 Salmonella enteritidis
- •4 Salmonella typhi
- •3 Пищевая токсикоинфекция.
- •3 Паратиф в.
- •2 Salmonella typhimurium
- •4 Salmonella cholerae suis
- •2 Пищевая токсикоинфекция.
- •4 Пищевая токсикоинфекция.
- •1 Брюшной тиф.
- •3 Salmonella paratyphi a
- •4 Salmonella schottmulleri
- •1 Vibrio cholere
- •2 Vibrio Eltor
- •4 Shigella boydii
- •3 Непрямая риф-200
- •3 Пунктат региональных лимфоузлов
- •3 Морские свинки
- •2. Clostridium perfringens a
- •2. Bordetella pertussis
- •3. Bordetella parapertussis
- •2. Neisseria meningitidis
- •4. Bacillus anthracis
- •5. Yersinia
- •3. Vibrio
- •Г) Yersinia enterocolitica
- •Г) Yersinia enterocolitica
- •Г) Yersinia enterocolitica
- •В) Shigella sonnei
- •В) Shigella sonnei
- •4. Инструменты, приборы
- •Итоговый контроль
- •1. Экзаменационные вопросы
- •1. Морфология микроорганизмов
- •2. Физиология микроорганизмов.
- •3. Инфекция и иммунитет.
- •2. П е р е ч е н ь практических умений
- •3. Экзаменационные билеты по микробиологии
- •Микропрепараты
- •Вакцины, сыворотки, иммуноглобулины
- •Бактериофаги и пробиотики для клинического применения
- •Диагностические препараты
- •5. Тест для итогового контроля знаний студентов
- •6. Инструменты, приборы
- •7.Ситуационные задачи
Самостоятельная работа студентов
1. Изучить морфологические и тинкториальные свойства возбудителя коклюша (Bordetella pertussis) в демонстрационных препаратах из чистой культуры
2. Бактериологический метод. Изучить культуральные свойства возбудителя коклюша культивируются на казеиново-угольном агаре КУА или на среде Борде-Жангу (картофельно-глицериновый МПА с кровью) - демонстрация. Колонии Bordetella pertussis мелкие, выпуклые, блестящие в виде капелек ртути. При микроскопии обнаруживают мелкие овоидные грамотрицательные палочки. Изучение ферментативных и антигенных свойств палочки коклюша (демонстрация в соответствии с табл. 17).
3. Серологический метод. Учесть демонстрационные РА и РСК, поставленные с парными сыворотками крови детей (10 и 21 дни болезни) с диагнозом «подозрение на коклюш». Диагностический титр 1:20
4. Биопрепараты для диагностики, профилактики и лечения коклюша:
АКДС-вакцина (адсорбированная коклюшно-дифтерийно-столбнячная вакцина) содержит взвесь убитых коклюшных бактерий, дифтерийный и столбнячный анатоксины, адсорбированные на гидроокиси алюминия. Применяется для активной иммунизации детей против перечисленных инфекций;
Тетракокк – комбинированная вакцина для профилактики дифтерии, коклюша, столбняка и полиомиелита производства фирмы Пастер Мерье Коннот (Франция).
агглютинирующие сыворотки - для серологической идентификации коклюшных бактерий;
иммуноглобулин донорский. Получен из венозной крови человека, содержит антитела против ряда патогенных микроорганизмов (включая бордетеллы), применяется для профилактики и лечения коклюша, создает пассивный иммунитет;
агглютинирующие адсорбированные факторные сыворотки. Диагностические сыворотки, подвергнутые адсорбции родственными микробами с целью удаления групповых антител. Применяются для постановки РА при антигенной идентификации бордетелл.
Педиатрические аспекты темы
1. Коклюш - заболевание детского возраста. Бактериологическая диагностика коклюша в ранний период заболевания основана на выделении чистой культуры возбудителя и ее идентификации. Для забора материала у детей используется метод кашлевых пластинок и применяются носоглоточные тампоны (у грудных детей). Серологическая диагностика коклюша, проводимая на 3 - 4 неделях заболевания (РСК) имеет эпидемиологическое значение. В настоящее время увеличился удельный вес заболеваний, вызванных Bordetella parapertussis, что обусловливает необходимость разграничения между этими микроорганизмами.
2. Пневмококки у детей могут вызвать сепсис, менингит. Дети первого года жизни не болеют крупозной пневмонией. Трудности при диагностике пневмонии у детей раннего возраста связаны с отсутствием спонтанного отделения мокроты.
Микробиологическая диагностика гемофильной инфекции
Возбудитель гемофильной инфекции - Haemophilus influenzae, способен вызывать гнойный менингит, острое воспаление верхних дыхательных путей, бронхит, пневмонию, эмпиему, конъюнктивит, отит и другие оппортунистические заболевания. Уровень носительства гемофильной палочки среди здоровых лиц высокий (до 90 %). Гемофильная инфекция у детей в возрасте до 3 лет протекает исключительно тяжело, особенно в случае возникновения острого эпиглоттита (воспаления надгортанника).
Бактериоскопический метод может быть использован при исследовании спинномозговой жидкости при подозрении на гнойный менингит (рис.18а).
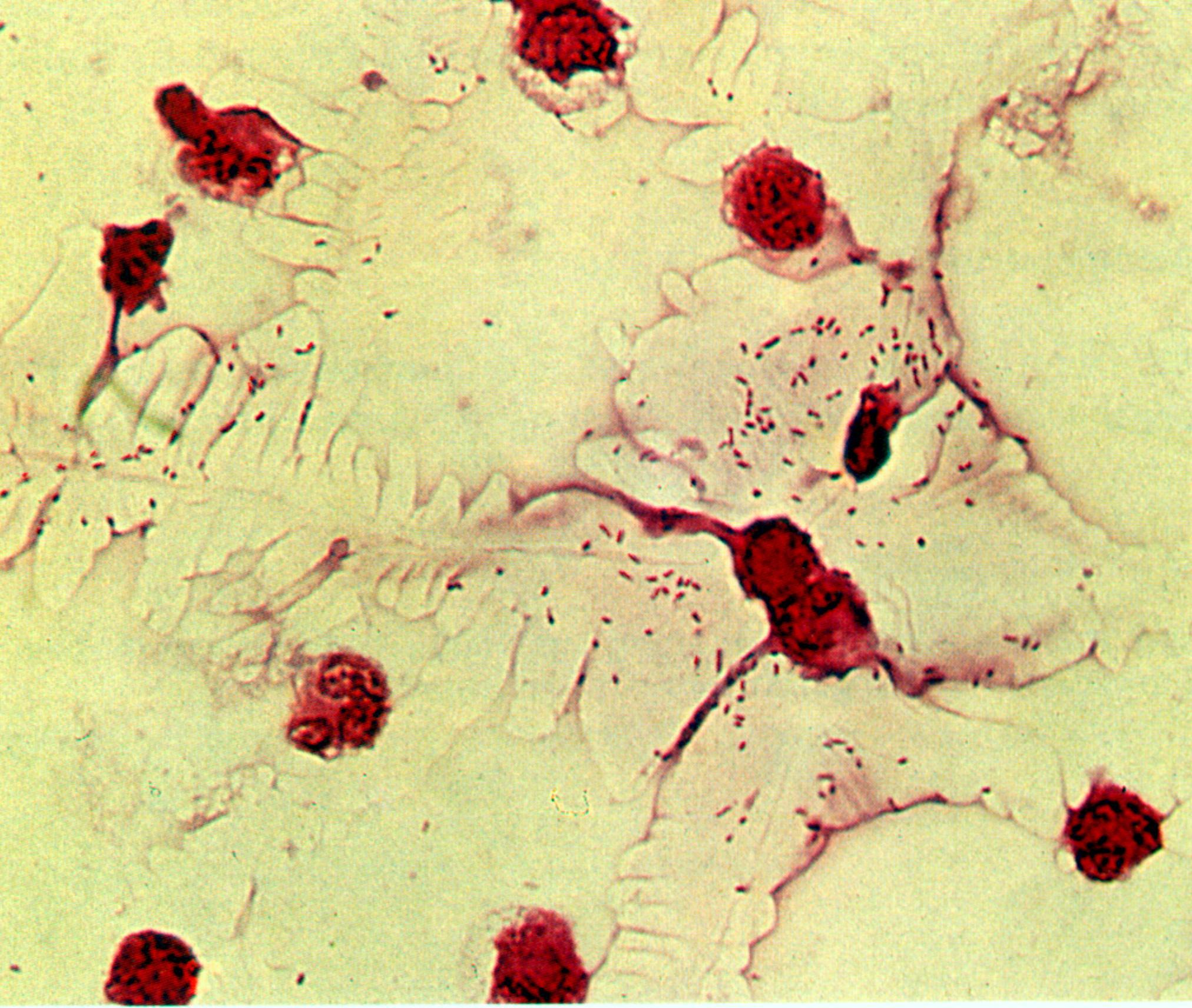 а б
а б
Рис. 18. Гемофильная палочка - Haemophilus influenzae. а – мазок из спинно-мозговой жидкости, б - мазок из чистой культуры. Окраска по Граму. мелкие грамотрицательные палочки. х900
Бактериологический метод является основным в лабораторной диагностике гемофильной инфекции. Исследуемый материал (мокрота, кровь, спинномозговая жидкость, серозную жидкость) засевают на МПА с 6 - 10 % нативной крови или на «шоколадный» агар с прогретой или кипяченой кровью. Если возможности немедленно посеять материал на среды нет, используют транспортную полужидкую среду с активированным углем и ниацином.
Серозную и спинномозговую жидкости центрифугируют, осадок засевают бактериальной петлей на шоколадный агар (МПА с 5% дефибринированной крови человека, лошади или кролика выдерживают 2-3 минуты при температуре 800 С, повторно добавляют 5% крови и вновь выдерживают при той же температуре 2-3 минуты) или среду Филдса (МПА с добавлением пептического перевара крови лошади или барана). Параллельно делают посев на обычный МПА, на котором гемофильная палочка не растет.
Колонии Haemophilus influenzae мелкие, прозрачные или полупрозрачные, вырастают через 18-24 часа; в мазках из этих колоний обнаруживаются мелкие капсулообразующие или капсулонеобразующие грамотрицательные палочки (рис. 17б). Оставшуюся часть колонии пересевают на скошенный шоколадный МПА для выделения чистой культуры. Идентификацию гемофильных бактерий проводят на основании изучения биохимических (каталазная, оксидазная активность, ферментация углеводов, гемолитическая активность, питательные потребности) и антигенных (постановка РА на стекле с групповыми сыворотками а,b,с, d, e, f к капсульному антигену) свойств.
Для идентификации Haemophilus influenzae применяют также тест сателлитных колоний, для чего на поверхность шоколадного МПА наносят исследуемую культуру и в некоторые участки среды - штамм Staphylococcus aureus. Гемофильная палочка вырастает в виде мелких сателлитных колоний, окружающих колонии S. aureus, так как стафилококк, гемолизируя кровь, высвобождает X и V факторы – стимуляторы роста Haemophilus influenzae.
Каталазу гемофильной палочки определяют по пенообразованию в капле 10% перекиси водорода на предметном стекле при внесении в нее исследуемой культуры. Оксидазу выявляют путем нанесения на диск фильтровальной бумаги, диаметром 5-7 см , 2-3 капель 1% раствора тетраметилпарафенилендиамина и исследуемой культуры, в результате чего через
10-15 сек. появляется фиолетовое окрашивание. Уреазу определяют общепринятым методом по разложению мочевины с образованием щелочных продуктов в присутствии индикатора фенолового красного; при наличии уреазы среда приобретает ярко-малиновый цвет. Порфириновый тест выявляет способность Н. influence к синтезу Δ-аминолевуленовой кислоты (АЛК) - потребности в факторе X. При внесении АЛК в среду только АЛК-независимые гемофильные бактерии синтезируют и секретируют порфобилиноген и порфирины (промежуточные соединения биосинтеза гема), тогда как АЛК-зависимые гемофильные палочки, нуждающиеся в факторе X, не способны к образованию указанных продуктов. Исследуемые бактерии засевают на шоколадный МПА, наносят на поверхность среды диски, пропитанные АЛК, и после 24-часовой выращивания в термостате при 370 С облучают УФ-лучами. При наличии Х-независимых микроорганизмов наблюдают кирпично-красную флюоресценцию.
Для специфической профилактики гемофильной инфекции в России лицензирована полисахаридная вакцина, конъюгированная со столбнячным анатоксином (вакцина Act-HIB) фирмы Пастер Мерье Коннот, которая не содержит консервантов и антибиотиков.
