
- •Содержание
- •§ 2. Краткий исторический очерк возникновения и развития отечественной токсикологической химии
- •Глава I. Общие вопросы химико-токсикологического анализа
- •§ 1. Объекты химико-токсикологического анализа. Вещественные доказательсва
- •§ 2. Особенности химико-токсикологического анализа
- •§ 3. Осмотр объектов исследования и определение некоторых их свойств
- •§ 4. Предварительные пробы в химико-токсикологическом анализе
- •§ 5. План химико-токсикологического анализа
- •§ 6. Организация органов судебно-медицинской и судебно-химической экспертизы в ссср
- •§ 7. Эксперт-химик
- •§ 8. Правила судебно-химической экспертизы вещественных доказательств
- •§ 9. Акт судебно-химической экспертизы вещественных доказательств
- •§ 10. Некоторые вопросы терминологии в токсикологической химии
- •§ 11. Классификация ядовитых и сильнодействующих веществ в токсикологической химии
- •Глава II. Отравления и некоторые вопросы токсикокинетики ядов
- •§ 1. Отравления и их классификация
- •§ 2. Пути поступления ядов в организм
- •§ 3. Всасывание ядов в организме
- •§ 4. Распределение ядов в организме
- •§ 5. Связывание ядов в организме
- •§ 6. Выделение ядов из организма
- •§ 7. Факторы, влияющие на токсичность химических соединений
- •§ 8. Методы детоксикации
- •§ 9. Метаболизм чужеродных соединений
- •§ 10. Окисление чужеродных соединений
- •§ 11. Восстановление чужеродных соединений
- •§ 12. Гидролиз чужеродных соединений
- •§ 13. Дезалкилирование, дезаминирование и десульфирование чужеродных соединений
- •§ 14. Другие метаболические превращения
- •§ 15. Реакции конъюгации
- •§ 16. Посмертные изменения лекарственных веществ и ядов в трупах
- •§ 17. Разложение биологического материала после наступления смерти
- •§ 18. Изменение ядов при разложении трупов
- •Глава III. Методы анализа, применяемые в токсикологической химии
- •§ 1. Метод экстракции
- •§ 2. Микрокристаллоскопический анализ
- •§ 3. Метод микродиффузии
- •Глава IV. Ядовитые и сильнодействующие вещества, изолируемые из биологического материала перегонкой с водяным паром
- •§ 1. Аппараты для перегонки с водяным паром
- •§2. Влияние рН среды на перегонку химических соединений с водяным паром
- •§ 3. Перегонка ядовитых веществ с водяным паром из подкисленного биологического материала
- •§ 4. Перегонка ядовитых веществ с водяным паром из подкисленного, а затем из подщелоченного биологического материала
- •§ 5. Фракционная перегонка веществ, содержащихся в дистиллятах
- •§ 6. Синильная кислота
- •§ 7. Формальдегид
- •§ 8. Метиловый спирт
- •§ 9. Этиловый спирт
- •§ 10. Изоамиловый спирт
- •§ 11. Ацетон
- •§ 12. Фенол
- •§ 13. Крезолы
- •§ 14. Хлороформ
- •§ 15. Хлоралгидрат
- •§ 16. Четыреххлористый углерод
- •§ 17. Дихлорэтан
- •§ 18. Реакции, позволяющие отличить хлорпроизводные друг от друга
- •§ 19. Тетраэтилсвинец
- •§ 20. Уксусная кислота
- •§ 21. Этиленгликоль
- •Глава V. Ядовитые и сильнодействующие вещества, изолируемые из биологического материала подкисленным этиловым спиртом или подкисленной водой
- •§ 1. Развитие методов выделения алкалоидов и других азотистых оснований из биологического материала
- •§ 2. Влияние рН среды на изолирование алкалоидов и других азотистых оснований из биологического материала
- •§ 3. Влияние состава извлекающих жидкостей на изолирование алкалоидов и других азотистых основании из биологического материала
- •§ 4. Влияние подкисленной воды и подкисленного спирта на извлечение примесей, переходящих в вытяжки из биологического материала
- •§ 5. Очистка вытяжек из биологического материала от примесей
- •§ 6. Экстракция алкалоидов и других токсических веществ из вытяжек
- •§ 7. Обнаружение ядовитых веществ, изолируемых подкисленной водой или подкисленным этиловым спиртом
- •§ 8. Количественное определение токсических веществ, изолированных подкисленной водой или подкисленным спиртом
- •§ 9. Метод выделения токсических веществ, основанный на изолировании их этиловым спиртом подкисленным щавелевой кислотой
- •§ 10. Метод выделения токсических веществ, основанный на изолировании их водой, подкисленной щавелевой кислотой
- •§ 11. Метод выделения токсических веществ, основанный на изолировании их водой, подкисленной серной кислотой
- •§ 12. Барбитураты и методы их исследования
- •§ 13. Барбамил
- •§ 14. Барбитал
- •§ 15. Фенобарбитал
- •§ 16. Бутобарбитал
- •§ 17. Этаминал-натрий
- •8.Обнаружение этаминала-натрия по уф- и ик-спектрам.
- •§ 18. Бензонал
- •§ 19. Гексенал
- •§ 20. Производные ксантина
- •§ 21. Кофеин
- •§ 22. Теобромин
- •§ 23. Теофиллин
- •§ 24. Наркотин
- •§ 25. Меконовая кислота
- •§ 26. Меконин
- •§ 27. Ноксирон
- •§ 28. Салициловая кислота
- •§ 29. Антипирин
- •§ 30. Амидопирин
- •§ 31. Фенацетин
- •§ 32. Хинин
- •§ 33. Опий и омнопон
- •§ 34. Морфин
- •§ 35. Кодеин
- •§ 36. Папаверин
- •§ 37. Галантамин
- •§ 38. Анабазин
- •§ 39. Никотин
- •§ 40. Ареколин
- •§ 41. Кониин
- •§ 42. Атропин
- •§ 43. Скополамин
- •§ 44. Кокаин
- •§ 45. Стрихнин
- •§ 46. Бруцин
- •§ 47. Резерпин
- •§ 48. Пахикарпин
- •§ 49. Секуренин
- •§ 50. Эфедрин
- •§ 51. Аконитин
- •§ 52. Новокаин
- •§ 53. Дикаин
- •§ 54. Аминазин
- •§ 55. Дипразин
- •§ 56. Тизерцин
- •§ 57. Хлордиазепоксид
- •§ 58. Диазепам
- •§ 59. Нитразепам
- •§ 60. Оксазепам
- •§ 61. Апоморфин
- •§ 62. Дионин
- •§ 63. Промедол
- •Глава VI. Вещества, изолируемые из объектов минерализацией биологического материала
- •§ 1. Связывание «металлических ядов» биологическим материалом
- •§ 2. Методы минерализации органических веществ
- •§ 3. Сухое озоление и сплавление органических веществ
- •§ 4. Окислители, применяемые для минерализации органических веществ
- •§ 5. Отбор и подготовка проб биологического материала для минерализации
- •§ 6. Разрушение биологического материала азотной и серной кислотами
- •§ 7. Разрушение биологического материала хлорной, азотной и серной кислотами
- •§ 8. Разрушение биологического материала пергидролем и серной кислотой
- •§ 9. Дробный метод и систематический ход анализа «металлических ядов»
- •§ 10. Маскировка ионов в дробном анализе
- •§ 11. Реактивы, применяемые в дробном анализе «металлических ядов» для маскировки ионов
- •§ 12. Реакции, применяемые в химико-токсикологическом анализе для обнаружения ионов металлов
- •§ 13. Соединения бария
- •§ 14. Соединения свинца
- •§ 15. Соединения висмута
- •§ 16. Соединения кадмия
- •§ 17. Соединения марганца
- •§ 18. Соединения меди
- •§ 19. Соединения мышьяка
- •§ 20. Соединения серебра
- •§ 21. Соединения сурьмы
- •§ 22. Соединения таллия
- •§ 23. Соединения хрома
- •§ 24, Соединения цинка
- •§ 25. Соединения ртути
- •§ 26. Количественное определение «металлических ядов» в минерализатах
- •§ 27. Количественное определение ртути
- •§ 28. Экстракционно-фотоколориметрическое определение меди
- •Глава VII. Вещества, изолируемые из биологического материала настаиванием исследуемых объектов с водой
- •Минеральные кислоты и щелочи
- •§ 1. Серная кислота
- •§ 2. Азотная кислота
- •§ 3. Соляная кислота
- •§ 4. Гидроксид калия
- •§ 5. Гидроксид натрия
- •§ 6. Аммиак
- •§ 7. Нитриты
- •Глава VIII. Ядохимикаты и методы их химико-токсикологического анализа
- •§ 1. Классификация ядохимикатов
- •§ 2. Гексахлорциклогексан (гхцг)
- •§ 3. Гептахлор
- •§ 4. Фосфорсодержащие органические соединения и методы их анализа
- •§ 5. Хлорофос
- •§ 6. Карбофос
- •§ 7. Метафос
- •§ 8. Карбарил
- •§ 9. Гранозан
- •Глава IX. Вещества, определяемые непосредственно в биологическом материале
- •§ 1. Оксид углерода (II)
- •§ 2. Спектроскопический метод обнаружения оксида углерода (II) в крови
- •§ 3. Химические методы обнаружения оксида углерода (II) в крови
- •§ 4. Количественное определение оксида углерода (II) в крови
- •Приложение 1. Приготовление реактивов
- •Приложение 2. Приготовление хроматографических пластинок
- •Список рекомендуемой литературы
§ 1. Метод экстракции
В современном химико-токсикологическом анализе метод экстракции широко используется для изолирования токсических веществиз объектов биологического происхождения, для очистки вытяжек из биологического материала от примесей, для выделения токсическихвеществиз предварительно очищенных вытяжек. Этот метод применяется для обнаружения токсическихвеществпри помощи некоторых качественных реакций, для количественного определения этихвеществэкстракционно-фотометрическими методами, дляконцентрированияисследуемыхвеществ, находящихся в сильно разбавленныхрастворах, и для ряда других целей.
Экстракция — процесс извлечения растворителямисоответствующихвеществиз различных объектов. Объекты, из которых извлекают соответствующие соединения, могут быть твердымивеществамиижидкостями. Поэтому процессы извлечения подразделяют на экстракцию в системетвердое тело—жидкостьи на экстракцию в системежидкость—жидкость(жидкостную экстракцию).
Для экстракции веществв системетвердое тело—жидкостьв качестве экстрагентов применяют органическиерастворители. Извлечение соответствующихвеществизтвердых телводойназываетсявыщелачиванием.
В химико-токсикологическом анализе метод экстракции в системе твердое тело—жидкостьи методвыщелачиванияприменяются для изолирования исследуемыхвеществ(целевых компонентов) из органов трупов, растений, почвы и других объектов.
Процесс экстракции (выщелачивания) целевых компонентов из биологического материала является многостадийным. Основными стадиями этого процесса являются: проникновение экстра-гента в клеткиитканитрупного материала и в другие объекты, в которых находится исследуемоевещество,растворениецелевого компонента в экстрагенте или взаимодействие целевого компонента с экстрагентом вклеткахитканяхбиологического материала, перенос растворенного целевого компонента через оболочкиклетокв межклеточное пространство и смешивание извлеченных изклетоквеществс основной массой экстрагента.
Степень изолирования исследуемых веществиз биологического материала зависит отрастворимостиизвлекаемыхвеществв экстрагенте, структуры (пористости) биологического материала, проникающей способности экстрагентов вклеткиитканибиологического материала, степени егоизмельчения, интенсивностиперемешиваниясмеси измельченного биологического материала и экстрагента, кратности настаивания биологического материала с экстрагеитом,температуры, рН среды и ряда других факторов. Влияние отдельных перечисленных выше факторов на изолирование токсическихвеществиз биологического материала приводится ниже (см. гл. V, § 2—4).
Жидкостная экстракция— процесс распределения растворенноговеществамежду двумя несмешивающимися жидкими фазами, одной из которых в большинстве случаев являетсявода, а второй — несмешивающийся сводойорганическийрастворитель.
Извлечение веществаиз фазы органическогорастворителяв водную фазу называется реэкстρакцией.
Некоторыми преимуществами метода экстракции объясняется широкое применение его не только в токсикологической химии, но и вхимическойтехнологии, фармации,биохимиии т. д. При использовании методов экстракции отсутствуетхимическоепревращение разделяемыхвеществи не образуются побочные продукты.Вещества, выделенные с помощью метода экстракции, как правило, не содержат примесей, связанных с процессамиадсорбциии окклюзии. Этот метод оправдывает себя при разделении термолабильныхвеществ. Использование метода экстракции дляконцентрированияпозволяет переводитьвеществаиз сильно разбавленныхрастворовв небольшой объем органическогорастворителя.
Переход экстрагируемого веществаиз одногорастворителяв другой происходит в результате разностиконцентрацийи неодинаковойрастворимостиэтоговеществав обоихрастворителях. Этот процесс происходит до тех пор, пока не наступит равновесиеконцентрацийизвлекаемоговеществав одном и другомрастворителях.
Исследования показали, что экстрагируемость химическихсоединений зависит отрастворимостиих вводеи в несмешивающихся сводойорганическихрастворителях, применяемых для экстракции. Подтверждением этого является то, что коэффициент распределения некоторыхвеществприблизительно равен отношению ихрастворимостейв органическомрастворителеи вводе.
Органические растворители, которые применяются для экстракции органических соединений, оказались непригодными для экстракции большого числа неорганических соединений. Поэтому сделаны попытки найти подходящие экстрагенты для извлечения неорганических соединений из водныхрастворов. Проведенные исследования показали, что для экстракции неорганических соединений в качестве экстрагентов с успехом могут быть использованы некоторые карбоновые и сульфоновые кислоты, отдельныефосфорорганические соединения, высокомолекулярныеамины,соличетвертичных аммониевых оснований и др. Этивеществапри экстракции взаимодействуют с неорганическими соединениями и ихионами. Кроме перечисленных соединений в качестве экстрагентов дляионовметалловпредложены так называемые хелатирующие агенты (вещества,растворыкоторых сионамиметалловобразуют хелаты). К числу хелатирующих агентов относятся;купферон, 8-оксихинолин,дитизон, дитиокар-баматы и др.
В связи с применением перечисленных выше веществдля экстракции неорганических соединений и ихионовизменилось представление об экстрагентах. В настоящее время под экстрагентом понимают органическийрастворитель(содержащий или не содержащий другие компоненты), который извлекаетвеществоиз водной фазы. Составная часть экстрагента, химически взаимодействующая с извлекаемымвеществом, называется реа гентом.
В зависимости от состава и свойств экстрагентов экстракционные системы подразделяются на две группы. К первой группе относятся экстракционные системы с так называемым «физическим» распределением компонентов. В этих системах отсутствует химическоевзаимодействие между экстрагентом (органическим растворителем) и экстрагируемымивеществами. Различнаярастворимостьнекоторыхвеществ, а следовательно, и неодинаковая экстрагируемость их объясняются физическими свойствами этихвеществи экстрагеитов (дипольный момент, диэлектрическая проницаемость и др.).
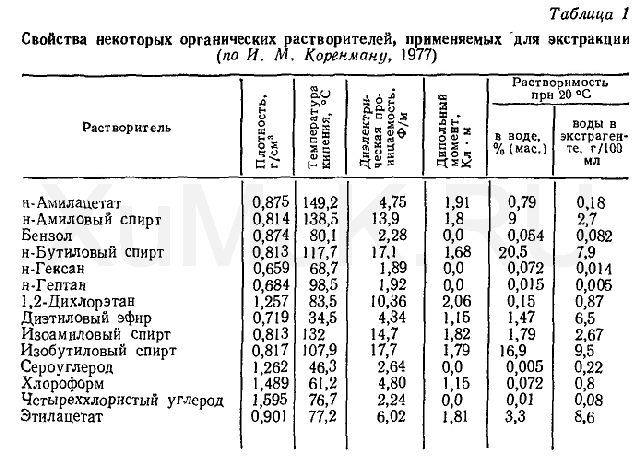
Свойства некоторых органических растворителей, применяемых в качестве экстрагентов, приведены в табл. 1.
Ко второй группе относятся экстракционные системы, в которых экстракция осуществляется за счет химическоговзаимодействия извлекаемыхвеществс экстрагентами. Эффективность разделениявеществв таких системах зависит отпрочностиобразующихся соединений или комплексов. Эти экстракционные системы используются для извлечения неорганическихвеществ.
Экстракция с помощью экстрагентов, взаимодействующих с экстрагируемыми веществами, является более сложным процессом, чем экстракция, основанная на физическом распределении. При использовании экстрагентов, взаимодействующих с экстрагируемымивеществами, процессы экстракции могут осложняться побочными реакциями. В ряде случаев одновременно может происходить экстракция нескольких различных соединений.
Основные количественные характеристики процессов экстракции
Несмотря на то что экстракция как метод разделения длительное время применяется в аналитической химииихимическойтехнологии, теоретические основы этого метода долгое время оставались неизученными. В частности, долгое время оставались неизученными основные количественные характеристики экстракционных процессов, что было определенным препятствием для широкого внедрения экстракции в практику. Для расчета количествавещества, которое экстрагируется органическимирастворителями, необходимо знать константу и коэффициент распределения, степень экстракции и т. д.
М. Бертло и Ю. Юнгфлейш были первыми исследователями, которые в 1872 г. на основании экспериментальных данныхпоказали, что отношение равновесныхконцентрацийвещества, распределяющегося между двумя жидкими фазами, является постоянным. Это отношение термодинамическим путем было выведено В. Нернстом, который в 1891 г. сформулировал закон распределения.
Согласно закону распределения, вещество, растворенное в двух несмешивающихся или ограниченно смешивающихсяжидкостях, распределяется между ними в постоянном отношении. Это отношение для идеальных систем зависит только оттемпературы, природывеществаи не зависит отконцентрации.
Из этого закона следует, что при одновременном растворениинесколькихвеществкаждое из них распределяется между обеими жидкими фазами таким образом, как будто в системе нет никаких другихвеществ, подлежащих распределению. Закон распределения справедлив лишь в том случае, если распределяемоевеществов обеих фазах находится в одной и той же форме.
Константа распределения вещества. Постоянная величина, выражающая отношениеконцентрацийраспределяемоговещества, находящегося в обеих фазах (после наступления равновесия) в одной и той же форме, называется константой распределения:

где Р о— константа распределения: [А]о—концентрациявеществав фазе органическогорастворителя, моль/л; [А]В—концентрациявеществав водной фазе, моль/л.
Величина константы распределения зависит от природы распределяемого вещества, состава и свойств применяемого экстрагента,температуры, при которой производится экстракция. Эта константа не зависит от равновесныхконцентрацийэкстрагируемоговеществаи объемов водной и неводной фаз. Числовое значение константы распределения можно вычислить и по другой формуле (9), исходя из величины степени экстракции соответствующеговеществаи объемов жидких фаз.
Коэффициент распределения. При расчетах константы распределения веществапо формуле (1) необходимо быть уверенным в том, что распределяемоевеществов обеих фазах находится в одинаковой форме (в одинаковом молекулярном состоянии). Однако во многих экстракционных системах не соблюдается указанное выше условие. В одной из жидких фаз могут происходитьдиссоциация, ассоциация,сольватация,гидролизраспределяемоговещества, образование комплексов и т. д. Для расчетов экстракционных равновесий в таких системах не принимают во внимание форму существованиявеществав каждой фазе, а учитывают только отношение суммарных (аналитических)концентрацийраспределяемоговеществав обеих фазах.
На основании определения суммарных концентрацийможно рассчитать не константу, а коэффициент распределенияданноювеществав применяемой системерастворителей(вода — органический растворитель). Коэффициент распределения — это отношение суммарной аналитическойконцентрациивеществав фазе органическогорастворителяк суммарной аналитическойконцентрацииэтоговеществав водной фазе (без учета того, в какой форме находитсявеществов каждой фазе):
![]()
где D — коэффициент распределения; С о— суммарная аналитическаяконцентрациявеществав фазе органическогорастворителя, моль/л; СВ— суммарная аналитическаяконцентрациявеществав водной фазе, моль/л.
Степень экстракции. Степень экстракции (процент экстракции) — это отношение количества экстрагированного веществак общему (начальному) количеству этоговеществав водномрастворе:
![]()
где R — степень экстракции вещества, %; А — количествовещества, которое экстрагировалось органическимрастворителем; N — общее (начальное) количествовеществав водномрастворе.
Количество веществаА, которое экстрагируется органическимрастворителем, можно определить экспериментальным путем, применив соответствующий метод количественного определения. Зная начальное количествовеществаи количество этоговещества, перешедшего в органическийрастворитель, рассчитывают степень экстракции.
Степень экстракции веществаможно определить не только экспериментальным путем, но и путем соответствующих расчетов, зная константу или коэффициент распределениявещества, а также отношение объемов водной фазы и фазы органическогорастворителя. Степень экстракции с указанными величинами связана следующим соотношением:

где R —степень экстракции; Р о— константа распределения; VB— объем водной фазы, мл; Vo— объем фазы органическогорастворителя, мл.
В формуле (4) отношение объема водной фазы к объему фазы органического растворителязаменяют величиной г:
![]()
Объем органического растворителя, необходимого для экстракции, рассчитывают по формуле
![]()
После соответствующего преобразования формулы (4) степень экстракции рассчитывают по уравнению

Из формулы (7) можно рассчитать величину r:

Если известна степень экстракции R и отношение объемов фаз r , то константу распределения Р 0можно рассчитать при помощи следующего уравнения:
![]()
На основании числовых значений константы распределения и степени экстракции можно рассчитать ряд других количественных характеристик процессов экстракции.
Ниже мы приведем несколько примеров расчетов ряда количественных характеристик экстракционных процессов неэлектролитов, к числу которых относятся многие органические соединения, имеющие значение в фармации и токсикологии.
Расчет объема органического растворителя, необходимого для однократной экстракции. Примеры этих расчетов приведены ниже.
Пример 1. Вычислить объем органического растворителя, который необходимо взять для однократной экстракции 99 %веществаиз 100 млраствора, если константа распределения Р0этоговеществамежду органическимрастворителеми водной фазой равна 20.
Для решения этой задачи пользуются формулой (7):

Значение r рассчитывают по формуле (8), а значение V o— по формуле (6):
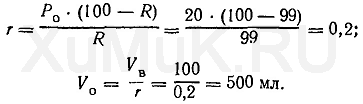
Таким образом, для однократной экстракции 99 % вещества(Ро=20) из 100 мл водногорастворатребуется 500 мл органическогорастворителя.
Пример 2. Какой объем органического растворителянеобходимо взять для однократной экстракции 99 %веществаиз 100 мл водногораствора, если Ρ = 10?
Эту задачу решают аналогично предыдущей:
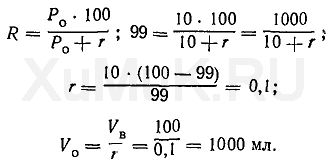
Расчеты показывают, что для однократной экстракции 99 % вещества(Ро= 10) из 100 мл водногорастворатребуется 1000 мл органическогорастворителя.
На основании произведенных выше расчетов (см. примеры 1 и 2) можно сделать такие выводы: чем больше константа распределения Р овещества, тем меньший объем органическогорастворителятребуется для однократной экстракции его из водныхрастворов; степень экстракции Rвеществатем больше, чем меньше величина r, т. е. чем больший объем органическогорастворителяприменяется для однократной экстракции.
Расчет объема органического растворителя для многократной экстракции. Из приведенных выше расчетов (см. примеры 1 и 2) следует, что для однократной экстракциивеществаиз водныхрастворовнеобходимобратьорганическиерастворители, объемы которых значительно больше объемов водныхрастворов.
Учитывая это, для извлечения веществиз водныхрастворовпроизводят многократную экстракцию их малыми объемами органическихрастворителейвместо однократной экстракции большим объемом того жерастворителя. Преимущество многократной экстракциивеществмалыми объемамирастворителейперед однократной экстракцией большими объемами этихрастворителейпоказано на приведенных ниже примерах.
Пример 3. Какой общий объем органического растворителянеобходимо использовать для многократной экстракции, чтобы из 100 мл водногораствораизвлечь 99 %вещества, если Ро= 20, а на каждую экстракциюберутпо 25 мл органическогорастворителя?
Для решения этой задачи пользуются формулой (7).
Вначале определяют степень экстракции вещества, %:

Расчеты показывают, что степень экстракции веществапри указанных выше условиях составляет 83 %. Следовательно, и при каждой последующей экстракции тоже будет экстрагироваться 83 % от оставшегося в водномрастворевещества.
При второй экстракции из водного растворабудет извлекаться Χ2вещества:
![]()
При третьей экстракции из водного растворабудет извлекаться Х3вещества:
![]()
Эти расчеты показывают, что при трех последовательных экстракциях из водного раствораизвлекается около 99,5 %веществаи при этом расходуется только 75 мл органическогорастворителя, в то время как для однократной экстракции 99 % того жевещества(см. пример 1) необходимо затратить 500 мл органическогорастворителя.
Приведенные выше расчеты показывают, что для извлечения веществаиз водныхрастворовнеобходимо производить многократную экстракцию небольшими объемами органическихрастворителейвместо однократной экстракции большим объемом этихрастворителей.
Количество экстракций, необходимых для извлечения заданного количества веществаизраствора. Для расчета полноты экстракциивеществаопределяют, сколько раз необходимо экстрагировать его из водногораствора, чтобы добиться извлечения заданного количества этоговещества.
С этой целью пользуются следующей формулой:
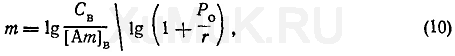
где т — количество экстракций, необходимых для извлечения заданного количества вещества; СВ— начальнаяконцентрациявеществав водномрастворе, моль/л; [Ат]В—концентрацияоставшегося в водной фазевеществапосле т экстракций, моль/л.
Пример 4. Рассчитать число экстракций, необходимых для извлечения 99 % веществаорганическимрастворителем(порциями по 10 мл) из 100 мл 1 Μ водногораствора, если Ро=20.
Для решения этой задачи вначале необходимо определить [Am] ви r:
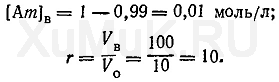
Подставим значения соответствующих величин в формулу (10).
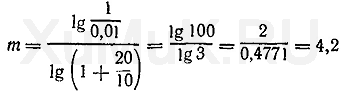
экстракции (округленно 4 экстракции).
Приведенный пример показывает зависимость числа экстракций от объемов органического растворителяи водной фазы, степени экстракции и константы распределениявещества.
Механизм процесса экстракции. Согласно теории растворов,растворениевеществавводеили в органическихрастворителяхсопровождается образованием малопрочных соединениймолекулэтоговеществасмолекуламирастворителя. Еслирастворителемявляетсявода, то враствореобразуютсягидраты, а еслирастворителемявляется органическийрастворитель, то врастворахобразуютсясольватымолекулрастворенноговещества.Гидратыисольватымолекулявляются малопрочными.
При взбалтывании водного растворавеществас органическимрастворителем, который не смешивается сводой, гидратная оболочкамолекулрастворенноговеществаразрушается.Молекулыводыв гидратной оболочке замещаютсямолекуламиорганическогорастворителя, в результате чего образуютсясольватымолекулрастворенноговещества, которые легко переходят в органическийрастворитель.
Хорошо экстрагируются молекулытехвеществ,сольватыкоторых в фазе органическогорастворителяявляются более прочными, чемгидратыэтихмолекулвводе.
Более сложными являются процессы экстракции электролитов, которые в водныхрастворахчастично или полностью распадаются наионы.Ионы, несущие определенный заряд, хорошо гидратируются диполямиводы. Связьионовс диполямиводыотносительно прочная. Поэтомуионы, имеющие прочные гидрат-ные оболочки, остаются в водной фазе и не экстрагируются органическимирастворителями. Ими могут экстрагироваться только недиссоциированныемолекулысоответствующеговещества. Это необходимо учитывать при экстракции органическихвеществ, являющихся слабымиэлектролитами. Степень экстракции этихвеществзависит от рН среды. С изменением рНраствораизменяется степеньдиссоциациимолекул, а следовательно, изменяется и относительное количество недиссоциированныхмолекулвещества. С увеличением количества недиссоциированныхмолекулувеличивается степень экстракции слабыхэлектролитови наоборот.
Экстракция органических кислот. Недиссоциированныемолекулыорганических кислот в водныхрастворахявляются электронейтральными и слабо гидратируютсямолекуламиводы. При контакте водныхрастворовс органическимирастворителямиэлектронейтральныемолекулыкислоты легко сольватируются, и поэтому переходят в слой органическогорастворителя.
Ионы, образующиеся в водныхрастворахпридиссоциациислабых кислот, имеют соответствующие заряды, и поэтому легко гидратируются диполямиводы. Связьмолекулводысионамикислоты относительно прочная. Поэтому такиеионыслабо сольватируютсямолекуламиорганическихрастворителейи не экстрагируются органическимирастворителямииз водныхрастворов.
Изменение концентрацииводородныхионовв водной фазе приводит к относительному увеличению или уменьшению количества недиссоциированныхмолекул, а следовательно, и к изменению экстрагируемости кислоты.
С повышением рН (т. е. с уменьшением концентрацииводородныхионовв водном растворе) увеличиваетсядиссоциациякислоты врастворе, что приводит к уменьшению ее недиссоциированныхмолекул. В результате этого понижается экстрагируе-мость слабой кислоты органическимирастворителямииз такихрастворов.
При повышении концентрацииводородныхионов(т. е. с понижением рН) в водномраствореувеличивается числомолекулнедиссоциированной кислоты, а следовательно, возрастает ее экстрагируемость органическимирастворителями. При значительном повышенииконцентрацииводородныхионовв водномраствореслабую кислоту практически полностью можно перевести в недиссоциированное состояние и этим повысить ее экстрагируемость.
Экстракция оснований. Многиеорганические основания, к числу которых относятсяалкалоидыи их многочисленные синтетические аналоги, являются фармацевтическими препаратами. Эти основания в нейтральной среде находятся в недиссоциированном состоянии. При действии кислот наорганические основанияобразуются ихсоли, которые в водныхрастворахдиссоциируют наионы.
Недиссоциированные молекулыорганических основанийслабо гидратируютсямолекуламиводы, но хорошо сольватируютсямолекуламиорганическихрастворителей. Поэтому недиссоциированныемолекулыорганических основанийхорошо экстрагируются из водныхраствороворганическимирастворителями.
Ионы, образующиеся придиссоциациисолейорганических оснований, хорошо гидратируютсямолекуламиводыи слабо сольватируютсямолекуламиорганическихрастворителей. Поэтомусолиорганических оснований(за небольшим исключением) не экстрагируются органическимирастворителями.
Органические основанияявляются слабымиэлектролитами. Степеньдиссоциацииих зависит от рН среды. От прибавления кислот корганическим основаниямони переходят всоли. При этом увеличивается количествоионови уменьшается количество недиссоциированныхмолекул, а следовательно, уменьшается степень экстракции этихвеществорганическимирастворителями. От прибавлениящелочейксоляморганических основанийуменьшается количествоионови увеличивается количество недиссоциированныхмолекулэтих оснований. В результате этого в щелочной среде увеличивается степень экстракцииорганических оснований.
Экстракция амфотерных соединений. К числу амфотерных соединений, имеющих токсикологическое значение, относятся вещества, вмолекулахкоторых содержится аминныйазоти фенольные группы (морфин, сальсолин и др.), а также соединения, содержащие аминныйазоти карбоксильную группу (аминокислоты и др.). Эти соединения в зависимости от рН среды диссоциируют как основания (в кислой среде) и как кислоты (в щелочной среде). Экстракция амфотерных соединений зависит от рН среды, так как при изменении рН изменяется количествоионови недиссоциированныхмолекуламфотерных соединений. Амфотерные соединения, находящиеся в молекулярном состоянии, экстрагируются органическимирастворителями.Ионыамфотерных соединений хорошо гидратируютсямолекуламиводыи почти не экстрагируются органическимирастворителями.
Наибольшие количества амфотерных соединений экстрагируются при рН, соответствующем изоэлектрической точкеэтихвеществ. Это объясняется тем, что визоэлектрической точкемолекулыамфотерных соединений не имеют электрического заряда.
Влияние различных факторов на экстракцию
На экстракцию веществорганическимирастворителямиоказывают влияние различные факторы (природа экстрагируемоговещества, природа экстрагента,температура, рН среды, присутствиеэлектролитовв водныхрастворах, скорость взбалтывания и др.).
Влияние температурына экстракцию. Изменениетемпературывлияет на константу распределения экстрагируемоговещества. Это объясняется тем, что при изменениитемпературыизменяетсярастворимостьэкстрагируемыхвеществв каждой фазе, а также изменяется взаимнаярастворимостьорганической и водной фаз. Причем с изменениемтемпературырастворимостьвеществав каждой фазе изменяется неодинаково. Это является одной из причин изменения константы распределениявеществапри изменениитемпературы.
При изменении температурыможет изменятьсядиссоциацияи ассоциациявеществав соответствующей фазе. Поэтому при изменениитемпературыизменяетсягидратация(сольватация) и экстрагируемостьхимическихсоединений.
Влияние рН среды на экстракцию. Экстрагируемость органических веществзависит от ряда факторов, в том числе и от рН среды. Количество экстрагированноговеществазависит отдиссоциацииего в водной фазе. Это связано с тем, что недиссоциированныемолекулывеществаи егоионынеодинаково экстрагируются органическимирастворителямииз водныхрастворов. При экстракции недиссоциированныемолекулыпереходят в органическую фазу, аионы, которые хорошо гидратированымолекуламиводы, остаются в водной фазе. Поэтому сильныеэлектролиты, хорошо диссоциирующие вводенаионы, не экстрагируются органическимирастворителями.
Влияние электролитовна экстракцию. Прибавление хорошо растворимыхсолейк водномурастворудругоговеществаможет понижать или повышать егорастворимостьвводе. Понижениерастворимостивеществв водныхрастворахпод влияниемэлектролитовназываетсявысаливанием, а повышениерастворимости— всаливанием.
Высаливаниеявляется фактором, понижающимрастворимостьвеществвводеи повышающим их экстрагируемость органическимирастворителямииз водныхрастворов.
Высаливающее действие электролитовзависит от природы и свойств высаливаемоговещества, от природы и свойств высаливателя,концентрациии радиусаионоввысаливателя и т. д.Ионывысаливателя с малым радиусом имеют большую плотность заряда, чемионыс большим радиусом. Поэтомуионыс малым радиусом гидратируются лучше, чемионыс большим радиусом. В связи с этим высаливающее действиеионовс малым радиусом большее, чем высаливающее действие крупныхионов. Однако это правило имеет и ряд исключений.
Установлено, что высаливающим действием обладают и некоторые хорошо растворимые в воденеэлектролиты. Так, например,этиловый спиртхорошо высаливаетуксусную кислотуиз ее водныхрастворовпри экстракции этой кислотыэтилацетатоми т. д.
Вещества, проявляющие свойства всаливателей, применяются для повышениярастворимостислаборастворимыхвеществвводе. Известно несколько теорий, объясняющих процесс всаливания. Согласно одной из них, всаливание объясняетсяхимическимвзаимодействием всаливателей и всаливающихсявеществв экстракционных системах. В результате этого могут образовываться соединения или комплексы, хорошо растворимые вводе, которые не экстрагируются органическимирастворителями.
Требования, предъявляемые к органическим растворителям для экстракции. К органическимрастворителям, применяемым для экстракции, предъявляется ряд требований.
1. Органический растворительдолжен хорошо извлекать исследуемоевеществоиз водной фазы.
2. Желательно, чтобы применяемый растворительбыл избирательным или селективным. Он должен извлекать израстворовтолько одновеществоили группу родственных соединений.
3. Растворительдолжен иметь незначительнуюрастворимостьвводе, аводане должна заметно растворяться в этомрастворителе.
При использовании для экстракции органических растворителей, растворяющихся вводеили растворяющихводу, конечные объемы фаз после взбалтывания не будут равны начальным объемам этих фаз. Это может быть источником ошибок при расчетах константы и коэффициента распределения, а также при вычислении степени экстракции. Чтобы исключить возможные ошибки при расчетах, органическийрастворительнасыщаютводой, аводу— органическимрастворителем. Только после этого производят экстракцию.
4. Органический растворительпо возможности не должен быть низкокипящим.Температуракипениярастворителядолжна быть выше 50 °С. Низкокипящие органическиерастворителидаже при комнатнойтемпературебыстро улетучиваются. Поэтому при экстракции их объемы уменьшаются, аконцентрацияэкстрагированныхвеществв этихрастворителяхувеличивается. Это может быть одним из источников ошибок при расчетах константы или коэффициента распределения экстрагируемоговещества. Однако низкаятемпературакипенияорганическихрастворителейявляется положительным фактором с точки зрениярегенерацииих после экстракции.
5. Плотность органических растворителейпо возможности должна отличаться от плотностиводыи водныхрастворов. При большой разности плотностей указанныхжидкостейразделение фаз происходит быстро.
6. Растворителине должны быть огнеопасными или ядовитыми. Есть и некоторые другие требования, предъявляемые крастворителям.
