
- •Содержание
- •§ 2. Краткий исторический очерк возникновения и развития отечественной токсикологической химии
- •Глава I. Общие вопросы химико-токсикологического анализа
- •§ 1. Объекты химико-токсикологического анализа. Вещественные доказательсва
- •§ 2. Особенности химико-токсикологического анализа
- •§ 3. Осмотр объектов исследования и определение некоторых их свойств
- •§ 4. Предварительные пробы в химико-токсикологическом анализе
- •§ 5. План химико-токсикологического анализа
- •§ 6. Организация органов судебно-медицинской и судебно-химической экспертизы в ссср
- •§ 7. Эксперт-химик
- •§ 8. Правила судебно-химической экспертизы вещественных доказательств
- •§ 9. Акт судебно-химической экспертизы вещественных доказательств
- •§ 10. Некоторые вопросы терминологии в токсикологической химии
- •§ 11. Классификация ядовитых и сильнодействующих веществ в токсикологической химии
- •Глава II. Отравления и некоторые вопросы токсикокинетики ядов
- •§ 1. Отравления и их классификация
- •§ 2. Пути поступления ядов в организм
- •§ 3. Всасывание ядов в организме
- •§ 4. Распределение ядов в организме
- •§ 5. Связывание ядов в организме
- •§ 6. Выделение ядов из организма
- •§ 7. Факторы, влияющие на токсичность химических соединений
- •§ 8. Методы детоксикации
- •§ 9. Метаболизм чужеродных соединений
- •§ 10. Окисление чужеродных соединений
- •§ 11. Восстановление чужеродных соединений
- •§ 12. Гидролиз чужеродных соединений
- •§ 13. Дезалкилирование, дезаминирование и десульфирование чужеродных соединений
- •§ 14. Другие метаболические превращения
- •§ 15. Реакции конъюгации
- •§ 16. Посмертные изменения лекарственных веществ и ядов в трупах
- •§ 17. Разложение биологического материала после наступления смерти
- •§ 18. Изменение ядов при разложении трупов
- •Глава III. Методы анализа, применяемые в токсикологической химии
- •§ 1. Метод экстракции
- •§ 2. Микрокристаллоскопический анализ
- •§ 3. Метод микродиффузии
- •Глава IV. Ядовитые и сильнодействующие вещества, изолируемые из биологического материала перегонкой с водяным паром
- •§ 1. Аппараты для перегонки с водяным паром
- •§2. Влияние рН среды на перегонку химических соединений с водяным паром
- •§ 3. Перегонка ядовитых веществ с водяным паром из подкисленного биологического материала
- •§ 4. Перегонка ядовитых веществ с водяным паром из подкисленного, а затем из подщелоченного биологического материала
- •§ 5. Фракционная перегонка веществ, содержащихся в дистиллятах
- •§ 6. Синильная кислота
- •§ 7. Формальдегид
- •§ 8. Метиловый спирт
- •§ 9. Этиловый спирт
- •§ 10. Изоамиловый спирт
- •§ 11. Ацетон
- •§ 12. Фенол
- •§ 13. Крезолы
- •§ 14. Хлороформ
- •§ 15. Хлоралгидрат
- •§ 16. Четыреххлористый углерод
- •§ 17. Дихлорэтан
- •§ 18. Реакции, позволяющие отличить хлорпроизводные друг от друга
- •§ 19. Тетраэтилсвинец
- •§ 20. Уксусная кислота
- •§ 21. Этиленгликоль
- •Глава V. Ядовитые и сильнодействующие вещества, изолируемые из биологического материала подкисленным этиловым спиртом или подкисленной водой
- •§ 1. Развитие методов выделения алкалоидов и других азотистых оснований из биологического материала
- •§ 2. Влияние рН среды на изолирование алкалоидов и других азотистых оснований из биологического материала
- •§ 3. Влияние состава извлекающих жидкостей на изолирование алкалоидов и других азотистых основании из биологического материала
- •§ 4. Влияние подкисленной воды и подкисленного спирта на извлечение примесей, переходящих в вытяжки из биологического материала
- •§ 5. Очистка вытяжек из биологического материала от примесей
- •§ 6. Экстракция алкалоидов и других токсических веществ из вытяжек
- •§ 7. Обнаружение ядовитых веществ, изолируемых подкисленной водой или подкисленным этиловым спиртом
- •§ 8. Количественное определение токсических веществ, изолированных подкисленной водой или подкисленным спиртом
- •§ 9. Метод выделения токсических веществ, основанный на изолировании их этиловым спиртом подкисленным щавелевой кислотой
- •§ 10. Метод выделения токсических веществ, основанный на изолировании их водой, подкисленной щавелевой кислотой
- •§ 11. Метод выделения токсических веществ, основанный на изолировании их водой, подкисленной серной кислотой
- •§ 12. Барбитураты и методы их исследования
- •§ 13. Барбамил
- •§ 14. Барбитал
- •§ 15. Фенобарбитал
- •§ 16. Бутобарбитал
- •§ 17. Этаминал-натрий
- •8.Обнаружение этаминала-натрия по уф- и ик-спектрам.
- •§ 18. Бензонал
- •§ 19. Гексенал
- •§ 20. Производные ксантина
- •§ 21. Кофеин
- •§ 22. Теобромин
- •§ 23. Теофиллин
- •§ 24. Наркотин
- •§ 25. Меконовая кислота
- •§ 26. Меконин
- •§ 27. Ноксирон
- •§ 28. Салициловая кислота
- •§ 29. Антипирин
- •§ 30. Амидопирин
- •§ 31. Фенацетин
- •§ 32. Хинин
- •§ 33. Опий и омнопон
- •§ 34. Морфин
- •§ 35. Кодеин
- •§ 36. Папаверин
- •§ 37. Галантамин
- •§ 38. Анабазин
- •§ 39. Никотин
- •§ 40. Ареколин
- •§ 41. Кониин
- •§ 42. Атропин
- •§ 43. Скополамин
- •§ 44. Кокаин
- •§ 45. Стрихнин
- •§ 46. Бруцин
- •§ 47. Резерпин
- •§ 48. Пахикарпин
- •§ 49. Секуренин
- •§ 50. Эфедрин
- •§ 51. Аконитин
- •§ 52. Новокаин
- •§ 53. Дикаин
- •§ 54. Аминазин
- •§ 55. Дипразин
- •§ 56. Тизерцин
- •§ 57. Хлордиазепоксид
- •§ 58. Диазепам
- •§ 59. Нитразепам
- •§ 60. Оксазепам
- •§ 61. Апоморфин
- •§ 62. Дионин
- •§ 63. Промедол
- •Глава VI. Вещества, изолируемые из объектов минерализацией биологического материала
- •§ 1. Связывание «металлических ядов» биологическим материалом
- •§ 2. Методы минерализации органических веществ
- •§ 3. Сухое озоление и сплавление органических веществ
- •§ 4. Окислители, применяемые для минерализации органических веществ
- •§ 5. Отбор и подготовка проб биологического материала для минерализации
- •§ 6. Разрушение биологического материала азотной и серной кислотами
- •§ 7. Разрушение биологического материала хлорной, азотной и серной кислотами
- •§ 8. Разрушение биологического материала пергидролем и серной кислотой
- •§ 9. Дробный метод и систематический ход анализа «металлических ядов»
- •§ 10. Маскировка ионов в дробном анализе
- •§ 11. Реактивы, применяемые в дробном анализе «металлических ядов» для маскировки ионов
- •§ 12. Реакции, применяемые в химико-токсикологическом анализе для обнаружения ионов металлов
- •§ 13. Соединения бария
- •§ 14. Соединения свинца
- •§ 15. Соединения висмута
- •§ 16. Соединения кадмия
- •§ 17. Соединения марганца
- •§ 18. Соединения меди
- •§ 19. Соединения мышьяка
- •§ 20. Соединения серебра
- •§ 21. Соединения сурьмы
- •§ 22. Соединения таллия
- •§ 23. Соединения хрома
- •§ 24, Соединения цинка
- •§ 25. Соединения ртути
- •§ 26. Количественное определение «металлических ядов» в минерализатах
- •§ 27. Количественное определение ртути
- •§ 28. Экстракционно-фотоколориметрическое определение меди
- •Глава VII. Вещества, изолируемые из биологического материала настаиванием исследуемых объектов с водой
- •Минеральные кислоты и щелочи
- •§ 1. Серная кислота
- •§ 2. Азотная кислота
- •§ 3. Соляная кислота
- •§ 4. Гидроксид калия
- •§ 5. Гидроксид натрия
- •§ 6. Аммиак
- •§ 7. Нитриты
- •Глава VIII. Ядохимикаты и методы их химико-токсикологического анализа
- •§ 1. Классификация ядохимикатов
- •§ 2. Гексахлорциклогексан (гхцг)
- •§ 3. Гептахлор
- •§ 4. Фосфорсодержащие органические соединения и методы их анализа
- •§ 5. Хлорофос
- •§ 6. Карбофос
- •§ 7. Метафос
- •§ 8. Карбарил
- •§ 9. Гранозан
- •Глава IX. Вещества, определяемые непосредственно в биологическом материале
- •§ 1. Оксид углерода (II)
- •§ 2. Спектроскопический метод обнаружения оксида углерода (II) в крови
- •§ 3. Химические методы обнаружения оксида углерода (II) в крови
- •§ 4. Количественное определение оксида углерода (II) в крови
- •Приложение 1. Приготовление реактивов
- •Приложение 2. Приготовление хроматографических пластинок
- •Список рекомендуемой литературы
Глава VI. Вещества, изолируемые из объектов минерализацией биологического материала
![]()
![]()
![]()
![]() Все
объявления
Все
объявления
ЯндексДирект
Дать объявление
Растворители в различной фасовке
Растворители 646,ацетон, у-спирит, скипидар,лак НЦ и БТ, краски МА и ПФ,в/э
www.chemservice.ru
![]() В
химико-токсикологическом анализе методминерализацииприменяется при исследовании биологического
материала (органов трупов, биологическихжидкостей,
растений, пищевых продуктов и др.) на
наличие так называемых «металлических
ядов». Эти яды в видесолей,оксидови других соединений в большинстве
случаев поступают ворганизмчерез пищевой канал, в соответствующих
отделах которого они всасываются в
кровь и вызывают отравления.
В
химико-токсикологическом анализе методминерализацииприменяется при исследовании биологического
материала (органов трупов, биологическихжидкостей,
растений, пищевых продуктов и др.) на
наличие так называемых «металлических
ядов». Эти яды в видесолей,оксидови других соединений в большинстве
случаев поступают ворганизмчерез пищевой канал, в соответствующих
отделах которого они всасываются в
кровь и вызывают отравления.
Важнейшими «металлическими ядами» являются соединения бария,висмута,кадмия,марганца,меди,ртути,свинца,серебра,таллия,хрома,цинкаи некоторых другихметаллов. В токсикологии к группе «металлических ядов» относятся и соединения некоторых неметаллов (мышьяка,сурьмыи др.). Ряд перечисленных вышехимических элементов, соединения которых являются токсичными, в небольших количествах содержатся втканяхорганизмакак нормальная их составная часть. Ввиду незначительных количеств этиххимических элементов, содержащихся ворганизме, их называютмикроэлементами.
Некоторые химические элементы, соединения которых являются токсичными, в малых количествах играют важную роль в физиологических процессах ворганизмахлюдей и животных. Так, например,кобальтвходит в составвитаминаВ12(цианокобаламина). Этотмикроэлементявляется кофактором некоторыхферментов(карбоксипептидазы, карбоксиангидразы).Медьвходит в состав рядаферментов(полифенолоксидазы,цитохромоксидазы, фенолазы и др.). Она является составной частью белка-цирулоплазмина, участвует в синтезегемоглобина.Марганецнеобходим для активизации некоторыхферментов(аргиназы, пролидазы и др.).Цинктакже входит в состав отдельныхферментов(карбоксипептидазы, карбоангидразы, лактатдегидрогеназы и др.).
Данныео наличии и роли ворганизмелюдейбария,висмута,сурьмыиталлия, соединения которых являются токсичными, в литературе не приводятся. Ворганизмесодержится и ряд другихметаллов(калий,натрий,магний, кальций), соединения которых являются нетоксичными. Количественное содержание некоторыхмикроэлементоввтканяхорганизмаприведено в табл. 7.

Несмотря на то что отдельные металлыв малых количествах содержатся ворганизмекак нормальная его составная часть, при повышении содержания их в крови итканяхони вызывают отравления.
Токсичность«металлических ядов» объясняется связыванием их с соответствующимифункциональными группамибелковых и других жизненно важных соединений ворганизме. В результате связываниякатионовметалловбелкамии другимивеществаминарушаются нормальные функции соответствующихклетокитканейворганизмеи наступает отравление, которое в ряде случаев заканчивается смертью.
§ 1. Связывание «металлических ядов» биологическим материалом
![]()
![]()
![]()
![]() Все
объявления
Все
объявления
ЯндексДирект
Дать объявление
Получение азота
Любые установки и станции для получения азота (жидкий, газообразный).
www.techgaz.com
![]() Причину
отравлений соединениямиметалловдолгое время объясняли образованием ворганизметак называемых альбуминатов. Однако
сторонники этой гипотезы химизм
образования, состав ипрочностьальбуминатов не приводят.
Причину
отравлений соединениямиметалловдолгое время объясняли образованием ворганизметак называемых альбуминатов. Однако
сторонники этой гипотезы химизм
образования, состав ипрочностьальбуминатов не приводят.
Благодаря успехам в области биологической химии, фармакологии, токсикологии и ряда других наук установлено, что ворганизмеионыметалловсвязываются не только с белковымивеществами, но и саминокислотами,пептидамии рядом других жизненно важныхвеществ.Прочностьобразовавшихся при этом соединений (комплексов) зависит от природыметаллов, наличия соответствующихфункциональных группвмолекулахвеществ, связывающихся сметаллами, природы связи в образовавшихся соединениях или комплексах и т. д.
Связывание ионов металлов аминокислотами.Аминокислотыявляются структурными элементами, из которых построеныбелкии которые определяют многие важные свойства этихбелков. В настоящее время известно значительное числоаминокислот. Однако в составбелковвходит только около двадцати α-аминокислот. Всеаминокислоты(кроме пролина), входящие в составбелков, содержат свободную карбоксильную группу и свободную незамещенную аминогруппу у α-углеродногоатома.Пролинимеет замещенную α-аминогруппу и представляет собой α-иминокислоту.
Способность ионовметалловвзаимодействовать саминокислотамизависит от наличия в их составе определенныхатомовифункциональных групп. Сионамиметалловмогут взаимодействовать концевые амино- и карбоксильные группыаминокислот. Большая роль в образовании связей междуионамиметалловиаминокислотамипринадлежит и боковымфункциональным группамаминокислот. К числу боковыхфункциональных группваминокислотахотносятся: спиртовые группы вмолекулахсе-рина итреонина, фенильная группа втирозине, сульфгидрильная группа вцистеине, дисульфидная группа вцистине, вторые карбоксильные группы в аспарагиновой иглутаминовой кислотах, вторые азотсодержащие группы варгининеигистидине.Метионинсодержитатомысерыв углеродной цепи.
В зависимости от наличия определенных групп атомоввмолекулахаминокислот, природы ихимическихсвойствметалловпри взаимодействии между ними могут образовываться связи различнойпрочности.
Аминокислотыв водныхрастворахи вкристаллическом состояниинаходятся в виде биполярныхионов:

Аминокислотыявляются амфотерными соединениями.Диссоциацияих наионызависит от рН среды. В кислой средеаминокислотыдиссоциируют как основания, в щелочной — как кислоты:

Катионыметалловвзаимодействуют санионамиаминокислот. В аминогруппахаминокислотсодержатсяатомыазота, имеющие неподеленнуюпаруэлектронов, за счет которой образуетсякоординационная связьмеждукатиономметаллаиатомомазота. Эту связь следует рассматривать как один из видовковалентной связи. При образованиикоординационной связимеждукатиономметаллаиатомомазотадоноромобоих связывающихэлектроновявляетсяатомазотааминогруппы.
Один атомкислородав карбоксильной группеаминокислотыпосле еедиссоциацииимеет отрицательный заряд. За счет этогоатомакислородакатионыметалловсаминокислотоймогут образовывать как ионные, так иковалентные связи. Характер этих связей зависит от природыкатионов. При взаимодействии отрицательно заряженныхатомовкислородав карбоксильных группах скатионамищелочных металловвозникают ионные связи (образуются соли), а скатионамитяжелыхметаллов—ковалентные связи.
Катионыметаллов, являющиеся комплексообразователями, саминокислотамиобразовывают внутрикомплексные соединения (хелаты). При этом положительные зарядыкатионовнейтрализуются отрицательными зарядамиатомовкислородав карбоксильных группах, а незаряженныеатомыазотааминогрупп скатионамиметалловобразовываюткоординационные связи.
Катионыметалловтакже могут связываться с боковыми реакционноспособнымифункциональными группами(—SH,—NH2, — СООН)аминокислотс образованием внутрикомплексных соединений. Изаминокислотбольшой способностью связыватьметаллыобладаютгистидин, содержащий вмолекулеимидазольное кольцо, ицистеин, вмолекулекоторого имеется сульфгидрильная группа.
Образование внутрикомплексных соединений катионовметалловсаминокислотамиможно показать на примерефенилаланинаицистеина;
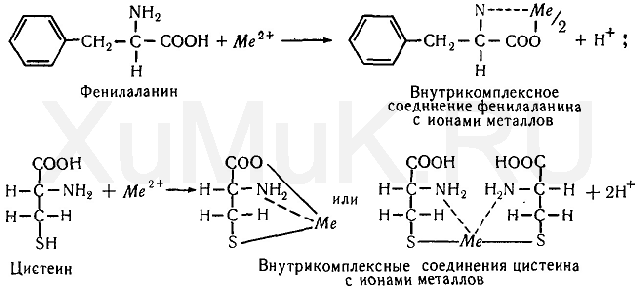
Связывание металлов пептидами.Пептидыпредставляют собой продуктыконденсацииаминокислот, связанные между собой пептидными (амидными) связями (—NH—СО—). Приставки ди-, три-, тетра- и т. д. соответствуют числу остатковаминокислотвмолекулахпептидов.Пептиды, включающие 20 и больше остатковаминокислот, называютсяполипептидами.Молекулярная массаих достигает 5000.Полипептидыс большеймолекулярной массойназываютсябелками.
Ди- и трипептиды могут связывать катионыметалловза счет образования связей с концевыми карбоксильными и аминными группами.Пептиды, представляющие собой продуктыконденсациибольшого числамолекуламинокислот, не могут связываться сметалламиуказанными концевыми группами, так как эти группы значительно удалены друг от друга. Поэтому такиепептидысвязываются скатионамиметалловв основном за счет образования связей с боковымифункциональными группамиили же с концевой карбоксильной группой и сатомомазотаамидной группы, близко расположенной к карбоксильной группе.Координационная связьметалласатомомазотаамидной группы менее прочная, чем связьметалласазотомаминной группы. Это объясняется тем, что электронодонорные свойстваатомаазотаамидной (пептидной) группы выражены значительно слабее, чем уазотааминной группы.
При образовании связей между ионамиметаллови пептидами-донорамиэлектроновмогут быть не толькоатомыазота, ко иатомысеры, находящиеся в дисульфидных мостиках.
Связывание металлов белками. Белкизанимают центральное место в структуре живой материи и играют первостепенную роль в ее функционировании. В количественном отношениибелкипредставляют собой основной материалтканейживыхорганизмов.Белкисоставляют до 75 % сухой массыклеток.
Белкипредставляют собоймакромолекулысмолекулярными массамиот 5000 до нескольких миллионов. Они состоят из α-аминокислот, связанных между собой пептидными (амидными) связями, образованными карбоксильными и аминными группами соседних аминокислотных остатков.
В образовании связей с металламимогут принимать участие концевые амино- и карбоксильные группы белковыхмолекул. Однако число концевых групп вмолекулахбелковнезначительное. Каждаямолекулабелка, представляющая длинную полипептидную цепь, содержит только две значительно удаленные друг от друга концевые (—NH2и —СООН) группы и большое число боковыхфункциональных групп. Поэтому образование связей междуионамиметалловибелкамипроисходит в основном за счет боковыхфункциональных групп(—SH, —NH2, —ОН, —СООН). Полагают, чтометаллысвязываются сбелкамиглавным образом через остаткигистидина, содержащего имидазольное кольцо, ицистеина, имеющего боковую сульфгидрильную группу.
Выше приведены сведения о связывании ионовметалловсаминокислотами,пептидамиибелкамиворганизме. Однакометаллымогут связываться ворганизмеи с другими соединениями, играющими важную роль во всех живыхклетках. К таким соединениям относятсяптеридины(в том числе фолиевая кислота),пурины,рибофлавин,нуклеиновые кислотыи многие др. В большинстве случаевионыметалловс перечисленными выше соединениями образовывают прочныековалентные связи.
При отравлениях соединениями металловна химико-токсикологическое исследование могут поступать органы трупов, биологическиежидкостии другие объекты биологического происхождения. Для изолирования «металлических ядов» из указанных объектов, в которых эти яды находятся в виде прочных соединений саминокислотами,пептидами,белкамии другимивеществами, необходимо производить разрушение (минерализацию) органическихвеществ, а затем в минерализатах обнаруживать и определять количественное содержание соответствующих «металлических ядов».
