
- •Перелік умовних скорочень
- •Структура і функціонування імунної системи
- •Природні бар'єри
- •4) Розселення т- і в-лімфоцитів на периферії та індукція толерант-
- •5) Антигенозалежний етап диференціювання лімфоцитів (імуноге-
- •Дефіцит компонентів комплементу
- •2. Інтерферони
- •3. Фактори некрозу пухлин (фнп)
- •4. Інші цитокіни
- •Toll-like рецептори
- •2. Особливості механізмів набутого і вродженого імунітету.
- •3. Структура імунної системи. Основні органи і клітини.
- •4. Функції комплементу, його роль в нормі і при патології.
- •5. Основні механізми клітинної цитотоксичності.
- •6. Популяції і субпопуляції лімфоцитів. Cd-номенклатура.
- •7. Макрофаги, їх роль у специфічному і неспецифічному імунітеті.
- •8. Класи і функції імуноглобулінів. Роль імунних комплексів.
- •9. Типи цитокінів. Їх функції і біологічна роль.
- •10. Молекули міжклітинної адгезії.
- •Організація імунної відповіді
- •4. Стадія формування та підтримки імунологічної пам'яті. Відбувається
- •5. Відповідь при повторному контакті з антигеном. За рахунок існуван-
- •Дисфункції імунної системи
- •1. Розлади процесів перетравлення (кілінгу):
- •2. Розлади хемотаксису, міграції і дегрануляції:
- •3. Дефекти опсонізації і поглинання:
- •1. Вісім або більше випадків отиту протягом 1 року.
- •2. Два або більше випадків синуситів протягом 1 року.
- •3. Два або більше місяців призначення антибіотиків без значного
- •4. Дві пневмонії або більше протягом 1 року.
- •5. Значне відставання дитини у рості або у масі тіла.
- •6. Рецидивні глибокі абсцеси підшкірної клітковини або абсцеси
- •7. Персистентна молочниця ротової порожнини або інших ділянок
- •8. Потреба у внутрішньовенному введенні антибіотиків для досяг-
- •9. Дві "глибокі" інфекції або більше: менінгіти, остеомієліти, целю-
- •10. Первинні імунодефіцити в родинному анамнезі.
- •Клінічні синдроми, які часто виявляються:
- •Клінічні синдроми, які виявляються у частини хворих:
- •1. Алергічні захворювання.
- •2. Автоімунні захворювання.
- •3. Онкозахворювання.
- •4. Дисбактеріози.
- •5. Хроніосепсис.
- •III. Розлади обміну речовин та інтоксикації, зумовлені:
- •1. Ураженням детоксикаційних органів і систем (печінка, нирки).
- •2. Хронічним ураженням інших органів.
- •3. Ендокринопатіями.
- •4, Втратою крові, білків.
- •1. Екологічні і виробничі чинники.
- •2. Аліментарні фактори (дефіцит вітамінів, мікроелементів, якіс-
- •3. Інфекційні хвороби:
- •II. Зумовлені соціальними факторами:
- •1. Спосіб життя і шкідливі звички (куріння, алкоголь, урбанізація,
- •2. Надмірний рівень сумарного стресового навантаження.
- •3. Ятрогенії:
- •Імунопатологічні синдроми
- •1. Синдром швидкої втоми [втомливості] — екологічний імуноде-
- •2. Синдром хронічної втоми - стан з глибшими імунологічними
- •Оцінка імунного статусу людини
- •3. На сьогодні у клініках та імунологічних лабораторіях світу викорис-
- •1. Забираючи кров для імунологічного обстеження, необхідно макси-
- •2. Показники імунограми найкраще порівнювати з індивідуальною нор-
- •3. Комплексний аналіз імунограми більш інформативний, ніж характе-
- •4. Якщо показники індивідуальної норми не відомі, особливо необхід-
- •5. Реальну інформацію в імунограмі несуть лише значні зсуви показни-
- •6. Висновки можна робити лише після порівняння імунологічних і
- •Період реконвалесценції:
- •Трансплантаційна імунологія. Імуногенетика
- •1990 Р. Більше 18 тис. Американців потребували тансплантації органів
- •2. Dn і do локуси розміщені між dp і dq ділянками. Dn і do
- •//|Pp|dq |drhc2|BdC4Af210hAlC4b| 21-онвн tnFojTnFpHв[ с | а
- •1. Якщо лімфоцити донора і реципієнта змішати у культурі клітин, то в
- •2. Проте mlr зазвичай проводиться у вигляді односпрямованого тесту,
- •1. Протягом певного часу забирають кілька зразків сироватки кро-
- •2. Якщо хоча б в одному випадку виявляється лізис донорських
- •2. Гостре або пришвидшене відторгнення. Реакція опосередковується
- •3. Лабораторні: лейкоцитоз із еозинофілією і збільшенням шое, пока-
- •4, Імунологічні: важливими критеріями кризу є зростання співвідношен-
- •Генетика імунної відповіді
- •1. Пептиди, які зв'язуються з ніа-і класу, містять 8-10 амінокислот,
- •2. Молекули ніа-і класу синтезуються в цитозолі клітини, де зали-
- •9 Алельних варіантів. При цьому виявилося, що лише деякі з них пов'я-
- •50 Млн хворих на віл/снід, більшість із них, очевидно, помре протя-
- •3. Автоімунні ураження:
- •1) Пряма цитопатична дія вірусу. Вона підтверджується тим, що три-
- •2) Пригнічення продукції іл-2 — основного фактора росту і актива-
- •3) Поверхневий глікопротеїд віЛу др120, одночасно зв'язуючись з
- •4) Вірусні антигени та імунні комплекси активують так званий пе-
- •5) Можливе також ураження вірусом клітин-попередників т-лімфо-
- •6) Віруси цитомегалії та мікобактерії туберкульозу, які часто акти-
- •20 І більше разів рідше, ніж у віці 60-69 років. Очевидно, імунна систе-
- •Вакцини. Імунопрофілактика
- •1 Рік після трансплантації кісткового мозку можна застосувати вбиті
- •Хірургічна імунологія
- •Медіатори септичної запальної відповіді та їх антагоністи
- •2. Етіотропне лікування при сепсисі відіграє важливу, але не вирі-
- •3. Патогенетична терапія полягає у профілактиці і лікуванні син-
- •8 Год вводять біфідумбактерин, який пришвидшує формування біфідо-
- •70 % Випадків втрата яйцеклітини відбувається до імплантації [преім-
- •4. Потужним фактором імунологічного захисту плода є децидуальна
- •5. Після дозрівання трофобласта він сам починає продукувати імуносу-
- •6. Аменорея з гіпоестрогенією.
- •7. Олігоменорея.
- •8. Нерегулярний менструальний цикл з овуляцією.
- •9. Ановуляція.
- •10. Врождені аномалії.
- •11. Непрохідність маткових труб.
- •12. Злуковий процес в малому тазі.
- •13. Ендометріоз.
- •14. Набута патологія матки, цервікального каналу.
- •15. Набута патологія труб.
- •16. Набута патологія яйників.
- •17. Туберкульоз.
- •18. Імунологічні причини.
- •19. Ятрогенна причина.
- •20. Системні захворювання.
- •21. Причина не встановлена (немає лапароскопії).
- •22. Від'ємний посткоїтальний тест.
- •23. Відсутність видимої причини безпліддя.
- •1) Вторинний імунодефіцит;
- •2) Антигаметний (антиоваріальний) імунний конфлікт;
- •3} Антигаметний (антиспермальний) імунний конфлікт;
- •4) Високий рівень гістосумісності між подружжям.
- •1. Прискіпливо зібраний анамнез (див. Вище).
- •2. Огляд пацієнтки. Клінічна оцінка фертильності жінки при огляді вклю-
- •7) З метою імунореабілітації таким хворим часто призначають фізі-
- •8) З метою покращання регуляторних зв'язків між імунною та ен-
- •9} Для отримання достовірних результатів повторне імунологічне
- •1:32, Для сім'яної плазми — 1:64. Визначення титрів у динаміці дозволяє
- •Імунологія пухлин
- •6. Антологічні пухлини швидко розсмоктуються організмом у випадку,
- •7. Частота розвитку пухлин набагато вища у період новонародженості
- •8. Позитивні шкірні проби з пухлинними антигенами (екстракт з клі-
- •9. Зростання частоти виникнення пухлин у хворих, які отримують іму-
- •10. У пацієнтів з пригніченням функції клітинної ланки імунітету зрос-
- •1. Оцінка імунного статусу хворого. Окрім формування груп підвищено-
- •2. Виявлення специфічних антигенів пухлини. Метою таких обстежень
- •Основні ембріональні антигени
- •3) Активації імунної відповіді, оскільки як сама пухлина, так і цитоста-
- •1. Моноклонові антитіла. Основний принцип дії моноклонових анти-
- •2. Пухлиноінфільтруючі лімфоцити (til) — лімфоцити, активовані іп
- •Vitro у присутності клітин пухлини та іл-2 (їх ще іноді називають
- •3. Макрофагоактивуючі фактори, застосування яких забезпечує акти-
- •5. Перші серйозні досягнення в онкоімунології третього тисячоліття
- •Автоімунні хвороби
- •9 Разів, ревматоїдним артритом — утричі. Лише при анкілозуючому
- •10 До 15 типів автоантитіл різної специфіки.
- •Основні автоімунні процеси
- •4) Тироксин (трийодотиронін) — звичайно виступає в ролі гаптену,
- •5) Тетрайодотиронін — як правило, діє як гаптен;
- •6) Поверхневі мембранні антигени залози.
- •Класифікація системних васкулітів
- •2.3. Вторинні, асоційовані з імунними комплексами:
- •3. Системні васкуліти з переважним пошкодженням середніх та малих
- •3.1. Первинні, асоційованні з антитілонейтрофільно-цитоплазматич-
- •3.2. Первинні, зумовлені антиендотеліальними клітинно-фіксовани-
- •3.3. Первинні імунокомплекснозалежні:
- •3.4. Вторинні, антитілозалежні:
- •3.5. Вторинні, асоційованні з імунними комплексами:
- •4. Системні васкуліти з переважаючими пошкодженнями дрібних су-
- •4.1. Первинні, асоційованні з клітинами до базальних мембран:
- •4.2. Первинні, асоційовані з антинейтрофільноцитоплазматичними
- •4.3. Первинні, асоційовані з імунними комплексами:
- •2 (Мелоксикам), які меншою мірою подразнюють слизові оболонки.
- •5. Велика кількість хвороб і багато клінічних симптомів у одного
- •1. Тривалість симптомів хвороби.
- •2. Зв'язок симптомів з подорожами, контактом з токсичними речо-
- •3. Локальний чи генералізований характер симптомів.
- •4. Зв'язок генералізації симптомів зі зниженням маси тіла, загаль-
- •5. Детальний терапевтичний анамнез хворого за органами і системами.
- •6. Спадковий анамнез.
- •7. Особливості способу життя.
- •8. Лікувальні заходи в анамнезі (променева терапія, гемодіаліз).
- •9. Недоношеність.
- •60 %, А, окрім того, еозинофілією зазвичай супроводжується серпоподіб-
- •138,0 Г/л, при цьому 93 % з них — еозинофіли. Перебіг злоякісний,
- •Алергічні хвороби
- •Vitro. Але, як і в інших галузях медицини, лабораторні методи не мо-
- •IgG) або підвищення активності т-лімфоцитів-супресорів, що веде до
- •10"6), Поступово збільшуючи дозу до появи слабопозитивної реакції.
- •10 Таблеток на добу або по 1 таблетці за 15-30 хв до контакту з потен-
- •Псевдоалерпя і параалергія
- •X. Найважливішим і найпоширенішим є гістаміновий варіант псев-
- •2. Розлади активації системи комплементу. При вродженій чи набу-
- •3. Розлади метаболізму арахідонової кислоти. Відомо, що продукти пе-
- •Клінічні форми алергічних хвороб
- •2 % Розчину допаміну; якщо його немає, можна застосувати 1 %
- •Клінічні симптоми бронхіальної астми різної тяжкості до початку лікування
- •2,4 Г/добу дає змогу тривалий час контролювати симптоми бронхіаль-
- •10 Мг на добу. Його вплив, очевидно, пов'язаний з блокуванням лейко-
- •4. Клініко-дієтологічні методи
- •Спектр алергенів при харчовій сенсибілізації у дітей (за а. Потьомкіною, 1990)
- •Спектр алергенів при харчовій сенсибілізації у дорослих
- •Найважливіші лібератори гістаміну (за в. Казьмірчук, 1996)
- •1 Капсулі (20 мг) 3-4 рази на добу.
- •9. Вплив ліків на екологію мікроорганізмів:
- •10. Вплив медикаментів на основні обмінні процеси в організмі.
- •11. Побічні реакції та ускладнення:
- •12. Побічні реакції і ускладнення змішаного генезу:
- •13. Побічний вплив ліків, обумовлений факторами зовнішнього сере-
- •Життєвої сенсибілізації".
- •Імунотерапія
- •2) Антилімфоцитарна сироватка і глобулін;
- •3) Моноклонові антитіла;
- •4) Високоселективні цитостатики (циклоспорин а, такролімус, гус-
- •II. Глюкокортикоїди.
- •III. "Малі" імунодепресанти:
- •1} Похідні 4-амінохінліни (делагіл, плаквеніл);
- •2) Пеніциламін і препарати золота;
- •3) Гепарини та інгібітори ферментів;
- •4) Колхіцин;
- •5) Нестероїдні протизапальні засоби (у великих дозах).
- •IV. Немедикаментозні методи імуносупресивного впливу:
- •1) Хірургічне втручання (спленектомія, синовектомія);
- •2) Іонізуюче опромінення (тотальне, локальне, екстракорпоральне)
- •3) Методи, що зумовлюють розвиток цитопенії (дренаж грудного про-
- •Імуностимулятори
- •1) Вакцини (живі, вбиті, рекомбінантні);
- •2) Анатоксини.
- •II. Пасивні:
- •1) Сироватки;
- •2) Імуноглобуліни;
- •3) Моноклонові антитіла..
- •II. З переважним впливом на гуморальну ланку: препарати кістково-
- •III. З переважним впливом на синтез інтерферону: нуклеїнові кисло-
- •IV. Препарати з комплексним впливом на імунну систему: рекомбі-
- •(В. Кресюн, 1993)
- •1000 Мг, 2000-1500-1000 мг тощо). Дози 2500 і 3000 мг на добу застосову-
- •Гусперимус.
- •0,5 Г тричі на добу (або у свічках чи клізмах) протягом 8-16 тижнів.
- •8 Років. Збільшення доз анти-сд20 мкат до максимальних забезпечи-
- •IgG, знайшов практичне.
- •Шуностимулятори
- •Зен, тимозин альфа (тимальфазии).
- •1. Інтерферони
- •2. Колонієстимулювальні фактори
- •3. Інтерлейкіни
- •4. Фактор некрозу пухлин (фнп)
- •5. Нейроцитокіни
- •6. Лейкоцитарні екстракти
- •Irs 19 (ipc 19) — новий імуностамулятор, який містить глюкопроте-
- •Ipc 19 застосовують при гострих, хронічних і рецидивних інфекці-
- •1 Інгаляції протягом ще 2-4 тижнів. З профілактичною метою засіб мо-
- •2 Доби після одноразового прийому (1-1,5 мг/кг) збільшує синтез ендо-
- •1870 P.). На сьогодні у світі застосовується близько 300 препаратів, які
- •1. Антибіотики
мою
(це правило рекомендоване для гемограми
та імунограми). Під-
твердженням
служать такі аргументи:
• імунний
гомеостаз у багатьох людей формується
на тлі генетично
детермінованих
особливостей чи дефектів функціонування
окре-
мих
компонентів імунної системи. Для
компенсації їх функціону-
вання
змінюється активність інших показників;
• адаптація
до екстремальних екологічних або
кліматичних умов, не-
раціонального
харчування і способу життя зумовлює
тривалі стій-
кі
зміни показників імунограми. Така
адаптація при наявності не-
обхідних
функціональних резервів може тривати
достатньо довго.
При
цьому зміни можуть мати виражені
індивідуальні особливості;
• існують
різні рівні інформативності показників
імунограми. Так,
вважається,
що при багатьох хворобах недостатньо
інформативни-
ми
є цифри абсолютного вмісту імуноцитів
(проте їх пріоритет
виявляється
при діагностиці лімфопроліферативних
станів, еози-
нофілій).
Вагомішим є відносний (процентний)
вміст клітин у пе-
риферичній
крові. Ще більшу інформацію несуть
показники спів-
відношення
(індекси взаємозв'язку), наприклад:
Т-лімфоцити/В-лі-
мфоцити,
Т-хелпери/Т-супресори, IgG/IgM
та
ін. Якщо вміст якогось
окремого
показника може змінюватися в широких
межах, навіть
під
впливом фізіологічних факторів, то
існують потужні регулято-
рні
механізми, які підтримують співвідношення
цих факторів як у
нормі,
так і при патології. Дуже цінними є
показники співвідно-
шення
у динаміці (наприклад, Т-лімфоцитів до
і після лікування).
ристика
кожного показника зокрема. Згідно з
концепцією Р. Петро-
ва,
імунна система діє за принципом "мобілів"
— рухомих, відносно
автономних,
але взаємозв'язаних ланок. Тому, при
однаковій реакції
системи
в цілому, окремі показники у різних
людей можуть реагува-
ти
індивідуально. Відповідно, однотипні
зміни якогось із показників
можуть
тлумачитися по-різному залежно від
стану інших показників.
но
обстежити пацієнта декілька разів
через певні проміжки часу.
Загалом,
аналіз імунограми в динаміці більш
інформативний як в
діагностичному,
так і у прогностичному плані, ніж
одноразове об-
стеження.
ків,
в той час як слабкі лише вказують на
індивідуальні особливості
реакції:
• аналіз
імунограми необхідно розпочинати з
виділення тих показ-
ників,
які максимально відрізняються від
нормальних величин;2. Показники імунограми найкраще порівнювати з індивідуальною нор-
3. Комплексний аналіз імунограми більш інформативний, ніж характе-
4. Якщо показники індивідуальної норми не відомі, особливо необхід-
5. Реальну інформацію в імунограмі несуть лише значні зсуви показни-
• вважається,
що їх зміни в межах 10-15 % є фізіологічними,
20-40 % —
характеризуються
як І ступінь імунопатологічних змін,
40-60 % — II
ступінь,
більше 60 % — III ступінь. Необхідно
наголосити, що ці
цифри
значною мірою умовні і повинні
співвідноситися з іншими
даними
(клінічними, анамнестичними, оцінюватися
в динаміці);
• на
підставі згрупування та аналізу
показників імунограми необхід-
но
виділити ведучий синдром. У висновку
необхідно вказати лише
найяскравіші
синдроми;
• відсутність
характерної зміни одного показника не
може змінюва-
ти
загальний висновок про синдром, особливо
при наявності спів-
звучних
до лабораторних змін клінічних симптомів;
• найчастіше
аналіз імунограми дає можливість робити
лише орієн-
товні,
а не безумовні діагностичні та
прогностичні висновки.
клінічних
даних;
• визначальною
завжди є клінічна картина захворювання;
• нормальна
імунограма при наявності клінічної
картини процесу
(запального,
онкологічного та ін.) трактується як
неадекватність
реакції
імунної системи;
• будь-яке
розходження клінічних та імунологічних
даних тлумачиться
як
фактор, який погіршує прогноз і свідчить
про тяжкий, неспри-
ятливий
перебіг хвороби. Як правило, це свідчить
про занадто сла-
бку,
або занадто сильну реакцію на пошкоджуючий
фактор ("чуже"),
ніж
потрібно для його нейтралізації;
• неадекватне
ослаблення імунної відповіді (гіпо-
чи анергія, зумов-
лена
мімікрією чужого або блокуванням чи
виснаженням імунних
.
механізмів) чи її
посилення (гіперергія, зумовлена зривом
регуля-
ції)
призводять до поглиблення патологічного
процесу;
*
своєчасне виявлення таких невідповідностей
є одним з найважливі-
ших
завдань імунологічного моніторингу.
Саме такі стани, у першу
чергу,
є показанням для проведення медикаментозної
імунокорекції.
Окрім
вищенаведених правил комплексного
аналізу клінічних і ла-
бораторних
даних, необхідно знати загальні
закономірності функціо-
нування
імунної системи. Слід пам'ятати, що
адекватна імунна відпо-
відь
забезпечується збалансованою роботою
багатьох компонентів.
Кожен
з цих компонентів залучений до роботи
певної ланки імунної
системи.
Загалом виділяють 2 головні ланки,
до
складу яких можна
умовно
включити практично всі фактори:
1)
клітинна;
2)
гуморальна.
Проте
часто виділяють ще декілька систем,
які
можуть діяти відно-
сно
незалежно:6. Висновки можна робити лише після порівняння імунологічних і
• систему
фагоцитів (макро- і мікрофаги);
• систему
факторів неспецифічної резистентності
(лізоцим, про-
пердин,
фібронектин, лактоферин, природні
антитіла, альтерна-
тивний
шлях активації комплементу);
• систему
комплементу;
• систему
інтерферонів;
• систему
нормальних кілерів (К- і NK-клітини,
а також інші кліти-
ни-"вбивці",
діяльність яких не залежить від
презентації антиге-
ну,
включаючи мастоцити, базофіли і
нейтрофіли у тих випадках,
коли
вони виконують кілерні функції).
Крім
того розрізняють декілька підсистем,
робота яких менш авто-
номна:
• тромбоцитарна;
• кінінова;
• гемостазу.
У
роботі кожної з них беруть участь
найрізноманітніші компонен-
ти
—
як клітинної (лімфоцити, моноцити,
нейтрофіли та ін.), так і
гуморальної
(імуноглобуліни, інтерлейкіни, селектини
тощо) природи.
Легко
помітити, що ті ж компоненти можуть
виконувати різні фун-
кції
у складі різних систем і підсистем
(наприклад, макрофаги в різних
умовах
можуть здійснювати і фагоцитоз, і
презентацію антигену, і кі-
лерні
функції). Залежно від шляху активації,
комплемент може діяти
як
самостійна функціональна одиниця
(альтернативний шлях) або у
співпраці
з антитілами в
гуморальній
ланці (класичний шлях). Кожна
система
діє значною мірою ізольовано, незалежно
від інших — тут до-
цільно
ще раз пригадати "теорію мобілів"
Р. Петрова. У ній обгрунто-
вана
можливість роботи функціональних
одиниць імунної системи як
напівавтономних
"мобілів", які різними шляхами
виконують однакові
завдання.
Завдяки
цьому функції різних систем і
підсистем
значною мірою
перекриваються
і дублюються таким чином, що навіть при
значному
чи
повному ушкодженні однієї з них,
кілька
інших можуть тривалий
час
компенсувати роботу ураженої системи.
При цьому системи, що
беруть
на себе роль страхування, будуть
працювати з помітним пере-
напруженням,
тобто поява
у
будь-який момент серйозного наванта-
ження
на
організм загалом або імунну
систему
зокрема, може
зумови-
ти
зрив
адаптації (стрес, вагітність,
пологи,
зміна кліматичних умов
проживання,
екологічні негаразди та
ін.).
Таким
чином, наявність дефекту в
роботі
окремої системи чи під-
системи
імунітету, як правило, не
призводить
до
появи
клінічно мані-
фестованого
захворювання, але
зумовлює збільшення
ризику
розвит-
ку
такого при дії на організм несприятливих
факторів існування.
При
цьому найважливішим є не стільки
кількісні показники клітинних
та
гуморальних факторів імунітету, як їх
функціональна
активність і якість
взаємозв'язків
окремих систем і підсистем між собою.
А
тому результати
імунологічного
обстеження з використанням традиційних
методів не ко-
релюють
з особливостями клінічного перебігу
деяких захворювань.
Достатньо
вагому роль відіграє також взаємодія
імунітету з іншими
системами
організму, у першу чергу — нервовою та
ендокринною, тобто
якість
функціонування нейроімуноендокринної
осі, яка
регулює пере-
біг
більшості процесів в організмі.
ФУНКЦІОНУВАННЯ
ІМУННОЇ СИСТЕМИ ПРИ ГОСТРОМУ
І
ХРОНІЧНОМУ ЗАПАЛЬНИХ ПРОЦЕСАХ
Залежно
від стану організму можна виділити
декілька режимів фун-
кціонування
імунної системи:
1.
Режим фізіологічного
спокою —
стан, коли імунна система перебу-
ває
у стані мінімальної активності
(динамічний спокій), а рівні пока-
зників
імунограми залишаються у межах норми.
Підтримка актив-
ності
імунної системи відбувається за рахунок
контакту з АГ умов-
но-патогенної
флори шкіри і слизових оболонок. Ця
активність може
значно
знижуватися у випадку позбавлення
макроорганізму контак-
ту
з мікроорганізмами. Такі суб'єкти
(гнотобіонти) вкрай чутливі до
інфікування
навіть банальною флорою. Інфекційний
процес у них
швидко
генералізується і часто закінчуються
летально.
2.
Режим фізіологічної
активності —
нормальне функціонування неском-
проментованої
імунної системи у відповідь на масивне
проникнення
в
організм генетично чужої інформації.
Цей тип реакції розвивається
при
більшості захворювань (переважно
гострих, рідше — хронічних,
рецидивних).
У межах цього нормального функціонування
може фо-
рмуватися
дисфункція імунної системи, переважно
транзиторна.
3.
Патологічне
функціонування, або
дисфункції
імунної системи —
розвивається
як поломка певної ланки або компонента
імунної сис-
теми,
коли механізми компенсації не спрацювали
через певні при-
чини
(несприятливі умови життя, занадто
глибокий дефект) і систе-
ма,
залишившись незбалансованою, не може
адекватно реагувати
на
чужорідне. Дефект компонентів може
бути спадковим (первин-
ним)
або набутим (вторинним).
.-""Запалення
—
це універсальна реакція організму на
пошкодження
(альтерацію),
інфікування
або антигенну стимуляцію, яка проявляєть-
ся
локальним позасудинним накопиченням
лейкоцитів, білків плазми і
рідини.
В нормі запальна реакція є невід'ємною
частиною захисних
властивостей
організму і має адаптивний характер.
Процес
запалення проходить два послідовних
етапи — ексудацію
(місцеві
гемодинамічні розлади з наступним
проникненням у позасу-
динний
простір рідини, білків та клітин імунної
системи) та репарацію
(проліферація
фібробластів і продукція позаклітинного
матриксу). Ме-
тою
першого етапу є знешкодження травмуючого
фактора, який зумо-
вив
альтерацію тканин, метою другого —
відновлення нормальної стру-
ктури
й функції ушкодженої тканини.
-
Ще зовсім недавно вважалося, що основою
запалення є міграція
лейкоцитів
у позасудинний простір під впливом
хемоатрактантних мо-
лекул,
які продукуються як самим організмом,
так і мікроорганізмами.
Проте
подальші дослідження поставили у центр
подій ендотеліальну
клітину
і
молекули
адгезії.
Дослідженнями
останніх років підтверджено, що лейкоцити
спря-
мовуються
до місця пошкодження стимульованим
ендотелієм. Такі ен-
дотеліальні
клітини набувають здатності "виловлювати"
лейкоцити з
току
крові. При цьому під впливом прозапальних
цитокінів (ІЛ-1, ФНП
тощо)
на ендотеліоцитах і лейкоцитах
синтезуються специфічні повер-
хневі
молекули:
• селектини
(homing-рецептори)
— структури на поверхні лімфо-
цита
або лейкоцита, які відповідають за
спорідненість даної кліти-
ни
з певним органом або тканиною (частіше
тією, де імуноцит
вперше
контактував з чужим антигеном);
• адресний
— молекули-партнери для селектинів на
мембранах клі-
тин
ендотелію судин у певних тканинах
(взаємодія адресина і се-
лектина
забезпечує вибіркову фіксацію конкретних
лейкоцита і
ендотеліоцита);
• інтегрини
— молекули клітинних мембран, які
забезпечують утри-
мання
цих клітин разом у необхідному місці
в тканинах.
Захоплені
лейкоцити активуються, внаслідок чого
контакт з ендо-
телієм
стає ще тіснішим (взаємодія інтегринів
з наступним "прилипан-
ням"),
а потім мігрують крізь судинну стінку.
Вже в тканинах на лімфо-
цити-"мігранти"
діють хемоатрактивні молекули, які
спрямовують ак-
тивовані
лейкоцити до місця вторгнення патогенного
агента.
Процес
репарації
у
різних тканинах має свої особливості,
але зага-
лом
нагадує процес загоєння шкіри. Початковий
етап репарації поля-
гає
в інфільтрації зони пошкодження
запальними, імунними і мезенхі-
мальними
клітинами.
На
наступному етапі відбувається
проліферація фібробластів під
впливом
факторів росту, зокрема тромбоцитарного
і трансформуючо-
го.
Характерно, що фактори росту гальмують
роботу імунних механіз-
мів,
попереджуючи пошкодження ними тканин
після знищення інфек-
ційної
причини запального процесу.
Примітки:
ΛΤ
—
лейкотрієн, ЕРФ — ендотеліальний
релаксуючий фактор,
ELAM
— молекули ендотеліально-лейкоцитарної
адгезії ("прилипаня"), ІСАМ —
молекули
міжклітинної адгезії, VCAM
— молекули адгезії клітин судин, МСР
—
моноцитарний
білок хемотаксису.
Далі
розпочинається етап продукції
позаклітинного матриксу —
переважно
колагену І і III типів, для заміщення
дефекту тканин. У зв'я-
зку
з цим процеси фіброзу і рубцювання
можна розглядати як норма-
льний
біологічний перебіг. Вони завершуються
ангіогенезом — "про-
ростанням"
новоутворених судин і ремоделюванням
матриксу.
Фактори
імунної системи відіграють значно
меншу роль на цьому
етапі
запалення. Вважається, що саме Т-лімфоцити
активують моноци-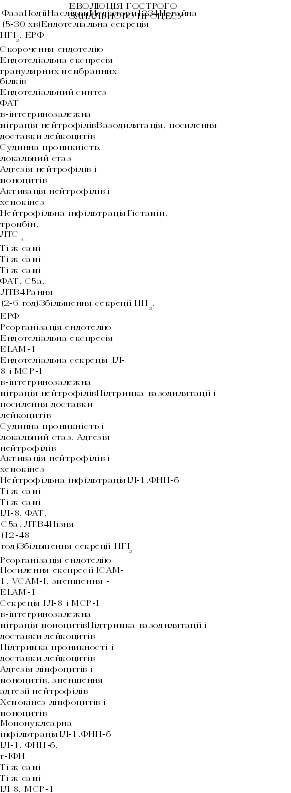
ти/макрофаги
та тромбоцити, які, у свою чергу,
забезпечують норма-
льну
проліферацію фібробластів і синтез
колагену.
Зовсім
інша картина виявляється у патологічних
умовах. Так, збіль-
шення
вмісту Т-лімфоцитів, переважно за
рахунок Т-хелперів і надмір-
ної
продукції прозапальних цитокінів,
виявляється при саркоїдозі, ін-
терстиційному
легеневому фіброзі, підгострому
гломерулонефриті тощо.
Всі
ці захворювання супроводжуються
надлишковим накопиченням
позаклітинного
матриксу.
Ремоделювання
матриксу здійснюється завдяки регуляції
його про-
дукції
і фізіологічного руйнування (деградації).
Зміни
в
імунограмі
при гострому запальному процесі
Кожному
з клінічних етапів гострого запального
процесу відповіда-
ють
певні, характерні зміни в імунограмі.
Якщо цих змін немає або
вони
неадекватні, то це, як правило, свідчить
про неадекватну реакцію
імунної
системи на запальний процес, що дає
змогу прогнозувати не-
сприятливі
висліди захворювання (хронізація,
розвиток ускладнень, ле-
тальний
випадок).
Інкубаційний
(латентний, прихований) період
характеризується
повною
відсутністю будь-яких клінічних ознак
захворювання. Зміни в
імунограмі
у цей період мінімальні. Єдиним суттєвим
зсувом є змен-
шення
процентного вмісту Т-лімфоцитів на тлі
зростання кількості 0-
клітин.
Вказані зміни відображають процес
мобілізації молодих форм
лімфоцитів
з депо на периферію — у запальний
орган-мішень. Як пра-
вило,
такі зміни на 1-3 доби випереджають появу
найперших клінічних
і
лабораторних проявів запального
процесу. Досить часто цей показ-
ник
застосовується для прогнозування
розвитку післяопераційних ускла-
днень,
особливо у хірургічних,
акушерсько-гінекологічних клініках.
У
період
загрози запальних ускладнень (наприклад,
післяопераційних),
суттєве
зниження вмісту Т-лімфоцитів на тлі
зростання кількості 0-
клітин
повинно стати сигналом до початку
протибактерійної терапії.
Продромальний
період характеризується
появою перших клініч-
них
симптомів, нетипових для якогось
конкретного захворювання (не-
специфічних),
а також вже значно глибшими змінами в
роботі імунної
системи:
• поглиблюються
зміни вмісту Т-лімфоцитів і 0-клітин,
що виникли
в
інкубаційному періоді;
• зменшується
число еозинофілів, або на короткий час
вони навіть
перестають
виявлятися у периферичній крові. Якщо
запальний
процес
розвивається на алергічному тлі (високий
первинний рі-
вень
еозинофілів), вміст цих клітин знижується
незначно;
• у
периферичній крові перестають виявлятися
базофіли. Проте
враховуючи
їх невелику кількість у нормі, цей
показник інформа-
тивний
лише при апаратних методах підрахунку
(на 1000 клітин).
Період
клінічного розпалу відзначається
найбільшим виявленням
симптомів
захворювання і формуванням відповідної
клінічної картини.
У
цей період умовно можна виділити:
— стадію
наростання клінічних явищ, для
якої характерні:
• поява
лейкоцитозу, який супроводжує запальний
процес, а його
вираження
пропорційне інтенсивності запального
процесу;
• нейтрофільоз,
як за рахунок викиду клітин з депо
(абсолютний),
так
і за рахунок зниження вмісту лімфоцитів
та еозинофілів (від-
носний
нейтрофільоз);
• зсув
лейкоцитарної формули вліво за рахунок
все більшого вики-
ду
з депо молодих і незрілих форм лейкоцитів;
• наростання
еозинопенії, при тяжких процесах —
часта анеозине-
мія;
• подальше
зменшення процентного вмісту Т-лімфоцитів
на тлі зро-
стання
кількості 0-клітин;
• наростання
відносного вмісту Т-хелперів стосовно
рівня Т-супре-
сорів.
За рахунок цього збільшується їх
співвідношення (імуноре-
гуляторний
коефіцієнт, теофіліновий коефіцієнт)
— один з найва-
жливіших
показників, рівень якого свідчить про
ступінь активації
"імунної
системи і зазвичай корелює з тяжкістю
процесу;
• наростання
адгезивної і фагоцитарної активності
нейтрофілів;
• зниження
індексу навантаження до мінімальних
цифр.
— стадію
плато (розгорнутої
клінічної картини захворювання, макси-
мальних
проявів запального процесу), якій
властиві;
• максимальні
значення фагоцитозу;
• моноцитоз
(як правило, з'являється на 5-7-й день
клінічних проя-
вів);
• поступове
зникнення відносного нейтрофільозу,
який змінюється
лімфоцитозом
(інтенсивність цього процесу вища при
вірусних
хворобах,
менш виражена — при бактерійних, майже
відсутня —
при
гнійних);
• посилення
зсуву лейкоцитарної формули вліво на
цьому етапі від-
бувається
пропорційно не стільки інтенсивністю
самого запально-
го
процесу, скільки — реакцією організму
на нього;
• стійке
підвищення ШОЕ, яке утримується аж до
завершення кліні-
чних
проявів або ненадовго "переживає"
їх;
• зниження
фагоцитарної активності нейтрофілів
при наростанні
або
стабільності їх адгезивних властивостей.
Зниження адгезивної
активності
свідчить про високий рівень інтоксикації.
