
- •Перелік умовних скорочень
- •Структура і функціонування імунної системи
- •Природні бар'єри
- •4) Розселення т- і в-лімфоцитів на периферії та індукція толерант-
- •5) Антигенозалежний етап диференціювання лімфоцитів (імуноге-
- •Дефіцит компонентів комплементу
- •2. Інтерферони
- •3. Фактори некрозу пухлин (фнп)
- •4. Інші цитокіни
- •Toll-like рецептори
- •2. Особливості механізмів набутого і вродженого імунітету.
- •3. Структура імунної системи. Основні органи і клітини.
- •4. Функції комплементу, його роль в нормі і при патології.
- •5. Основні механізми клітинної цитотоксичності.
- •6. Популяції і субпопуляції лімфоцитів. Cd-номенклатура.
- •7. Макрофаги, їх роль у специфічному і неспецифічному імунітеті.
- •8. Класи і функції імуноглобулінів. Роль імунних комплексів.
- •9. Типи цитокінів. Їх функції і біологічна роль.
- •10. Молекули міжклітинної адгезії.
- •Організація імунної відповіді
- •4. Стадія формування та підтримки імунологічної пам'яті. Відбувається
- •5. Відповідь при повторному контакті з антигеном. За рахунок існуван-
- •Дисфункції імунної системи
- •1. Розлади процесів перетравлення (кілінгу):
- •2. Розлади хемотаксису, міграції і дегрануляції:
- •3. Дефекти опсонізації і поглинання:
- •1. Вісім або більше випадків отиту протягом 1 року.
- •2. Два або більше випадків синуситів протягом 1 року.
- •3. Два або більше місяців призначення антибіотиків без значного
- •4. Дві пневмонії або більше протягом 1 року.
- •5. Значне відставання дитини у рості або у масі тіла.
- •6. Рецидивні глибокі абсцеси підшкірної клітковини або абсцеси
- •7. Персистентна молочниця ротової порожнини або інших ділянок
- •8. Потреба у внутрішньовенному введенні антибіотиків для досяг-
- •9. Дві "глибокі" інфекції або більше: менінгіти, остеомієліти, целю-
- •10. Первинні імунодефіцити в родинному анамнезі.
- •Клінічні синдроми, які часто виявляються:
- •Клінічні синдроми, які виявляються у частини хворих:
- •1. Алергічні захворювання.
- •2. Автоімунні захворювання.
- •3. Онкозахворювання.
- •4. Дисбактеріози.
- •5. Хроніосепсис.
- •III. Розлади обміну речовин та інтоксикації, зумовлені:
- •1. Ураженням детоксикаційних органів і систем (печінка, нирки).
- •2. Хронічним ураженням інших органів.
- •3. Ендокринопатіями.
- •4, Втратою крові, білків.
- •1. Екологічні і виробничі чинники.
- •2. Аліментарні фактори (дефіцит вітамінів, мікроелементів, якіс-
- •3. Інфекційні хвороби:
- •II. Зумовлені соціальними факторами:
- •1. Спосіб життя і шкідливі звички (куріння, алкоголь, урбанізація,
- •2. Надмірний рівень сумарного стресового навантаження.
- •3. Ятрогенії:
- •Імунопатологічні синдроми
- •1. Синдром швидкої втоми [втомливості] — екологічний імуноде-
- •2. Синдром хронічної втоми - стан з глибшими імунологічними
- •Оцінка імунного статусу людини
- •3. На сьогодні у клініках та імунологічних лабораторіях світу викорис-
- •1. Забираючи кров для імунологічного обстеження, необхідно макси-
- •2. Показники імунограми найкраще порівнювати з індивідуальною нор-
- •3. Комплексний аналіз імунограми більш інформативний, ніж характе-
- •4. Якщо показники індивідуальної норми не відомі, особливо необхід-
- •5. Реальну інформацію в імунограмі несуть лише значні зсуви показни-
- •6. Висновки можна робити лише після порівняння імунологічних і
- •Період реконвалесценції:
- •Трансплантаційна імунологія. Імуногенетика
- •1990 Р. Більше 18 тис. Американців потребували тансплантації органів
- •2. Dn і do локуси розміщені між dp і dq ділянками. Dn і do
- •//|Pp|dq |drhc2|BdC4Af210hAlC4b| 21-онвн tnFojTnFpHв[ с | а
- •1. Якщо лімфоцити донора і реципієнта змішати у культурі клітин, то в
- •2. Проте mlr зазвичай проводиться у вигляді односпрямованого тесту,
- •1. Протягом певного часу забирають кілька зразків сироватки кро-
- •2. Якщо хоча б в одному випадку виявляється лізис донорських
- •2. Гостре або пришвидшене відторгнення. Реакція опосередковується
- •3. Лабораторні: лейкоцитоз із еозинофілією і збільшенням шое, пока-
- •4, Імунологічні: важливими критеріями кризу є зростання співвідношен-
- •Генетика імунної відповіді
- •1. Пептиди, які зв'язуються з ніа-і класу, містять 8-10 амінокислот,
- •2. Молекули ніа-і класу синтезуються в цитозолі клітини, де зали-
- •9 Алельних варіантів. При цьому виявилося, що лише деякі з них пов'я-
- •50 Млн хворих на віл/снід, більшість із них, очевидно, помре протя-
- •3. Автоімунні ураження:
- •1) Пряма цитопатична дія вірусу. Вона підтверджується тим, що три-
- •2) Пригнічення продукції іл-2 — основного фактора росту і актива-
- •3) Поверхневий глікопротеїд віЛу др120, одночасно зв'язуючись з
- •4) Вірусні антигени та імунні комплекси активують так званий пе-
- •5) Можливе також ураження вірусом клітин-попередників т-лімфо-
- •6) Віруси цитомегалії та мікобактерії туберкульозу, які часто акти-
- •20 І більше разів рідше, ніж у віці 60-69 років. Очевидно, імунна систе-
- •Вакцини. Імунопрофілактика
- •1 Рік після трансплантації кісткового мозку можна застосувати вбиті
- •Хірургічна імунологія
- •Медіатори септичної запальної відповіді та їх антагоністи
- •2. Етіотропне лікування при сепсисі відіграє важливу, але не вирі-
- •3. Патогенетична терапія полягає у профілактиці і лікуванні син-
- •8 Год вводять біфідумбактерин, який пришвидшує формування біфідо-
- •70 % Випадків втрата яйцеклітини відбувається до імплантації [преім-
- •4. Потужним фактором імунологічного захисту плода є децидуальна
- •5. Після дозрівання трофобласта він сам починає продукувати імуносу-
- •6. Аменорея з гіпоестрогенією.
- •7. Олігоменорея.
- •8. Нерегулярний менструальний цикл з овуляцією.
- •9. Ановуляція.
- •10. Врождені аномалії.
- •11. Непрохідність маткових труб.
- •12. Злуковий процес в малому тазі.
- •13. Ендометріоз.
- •14. Набута патологія матки, цервікального каналу.
- •15. Набута патологія труб.
- •16. Набута патологія яйників.
- •17. Туберкульоз.
- •18. Імунологічні причини.
- •19. Ятрогенна причина.
- •20. Системні захворювання.
- •21. Причина не встановлена (немає лапароскопії).
- •22. Від'ємний посткоїтальний тест.
- •23. Відсутність видимої причини безпліддя.
- •1) Вторинний імунодефіцит;
- •2) Антигаметний (антиоваріальний) імунний конфлікт;
- •3} Антигаметний (антиспермальний) імунний конфлікт;
- •4) Високий рівень гістосумісності між подружжям.
- •1. Прискіпливо зібраний анамнез (див. Вище).
- •2. Огляд пацієнтки. Клінічна оцінка фертильності жінки при огляді вклю-
- •7) З метою імунореабілітації таким хворим часто призначають фізі-
- •8) З метою покращання регуляторних зв'язків між імунною та ен-
- •9} Для отримання достовірних результатів повторне імунологічне
- •1:32, Для сім'яної плазми — 1:64. Визначення титрів у динаміці дозволяє
- •Імунологія пухлин
- •6. Антологічні пухлини швидко розсмоктуються організмом у випадку,
- •7. Частота розвитку пухлин набагато вища у період новонародженості
- •8. Позитивні шкірні проби з пухлинними антигенами (екстракт з клі-
- •9. Зростання частоти виникнення пухлин у хворих, які отримують іму-
- •10. У пацієнтів з пригніченням функції клітинної ланки імунітету зрос-
- •1. Оцінка імунного статусу хворого. Окрім формування груп підвищено-
- •2. Виявлення специфічних антигенів пухлини. Метою таких обстежень
- •Основні ембріональні антигени
- •3) Активації імунної відповіді, оскільки як сама пухлина, так і цитоста-
- •1. Моноклонові антитіла. Основний принцип дії моноклонових анти-
- •2. Пухлиноінфільтруючі лімфоцити (til) — лімфоцити, активовані іп
- •Vitro у присутності клітин пухлини та іл-2 (їх ще іноді називають
- •3. Макрофагоактивуючі фактори, застосування яких забезпечує акти-
- •5. Перші серйозні досягнення в онкоімунології третього тисячоліття
- •Автоімунні хвороби
- •9 Разів, ревматоїдним артритом — утричі. Лише при анкілозуючому
- •10 До 15 типів автоантитіл різної специфіки.
- •Основні автоімунні процеси
- •4) Тироксин (трийодотиронін) — звичайно виступає в ролі гаптену,
- •5) Тетрайодотиронін — як правило, діє як гаптен;
- •6) Поверхневі мембранні антигени залози.
- •Класифікація системних васкулітів
- •2.3. Вторинні, асоційовані з імунними комплексами:
- •3. Системні васкуліти з переважним пошкодженням середніх та малих
- •3.1. Первинні, асоційованні з антитілонейтрофільно-цитоплазматич-
- •3.2. Первинні, зумовлені антиендотеліальними клітинно-фіксовани-
- •3.3. Первинні імунокомплекснозалежні:
- •3.4. Вторинні, антитілозалежні:
- •3.5. Вторинні, асоційованні з імунними комплексами:
- •4. Системні васкуліти з переважаючими пошкодженнями дрібних су-
- •4.1. Первинні, асоційованні з клітинами до базальних мембран:
- •4.2. Первинні, асоційовані з антинейтрофільноцитоплазматичними
- •4.3. Первинні, асоційовані з імунними комплексами:
- •2 (Мелоксикам), які меншою мірою подразнюють слизові оболонки.
- •5. Велика кількість хвороб і багато клінічних симптомів у одного
- •1. Тривалість симптомів хвороби.
- •2. Зв'язок симптомів з подорожами, контактом з токсичними речо-
- •3. Локальний чи генералізований характер симптомів.
- •4. Зв'язок генералізації симптомів зі зниженням маси тіла, загаль-
- •5. Детальний терапевтичний анамнез хворого за органами і системами.
- •6. Спадковий анамнез.
- •7. Особливості способу життя.
- •8. Лікувальні заходи в анамнезі (променева терапія, гемодіаліз).
- •9. Недоношеність.
- •60 %, А, окрім того, еозинофілією зазвичай супроводжується серпоподіб-
- •138,0 Г/л, при цьому 93 % з них — еозинофіли. Перебіг злоякісний,
- •Алергічні хвороби
- •Vitro. Але, як і в інших галузях медицини, лабораторні методи не мо-
- •IgG) або підвищення активності т-лімфоцитів-супресорів, що веде до
- •10"6), Поступово збільшуючи дозу до появи слабопозитивної реакції.
- •10 Таблеток на добу або по 1 таблетці за 15-30 хв до контакту з потен-
- •Псевдоалерпя і параалергія
- •X. Найважливішим і найпоширенішим є гістаміновий варіант псев-
- •2. Розлади активації системи комплементу. При вродженій чи набу-
- •3. Розлади метаболізму арахідонової кислоти. Відомо, що продукти пе-
- •Клінічні форми алергічних хвороб
- •2 % Розчину допаміну; якщо його немає, можна застосувати 1 %
- •Клінічні симптоми бронхіальної астми різної тяжкості до початку лікування
- •2,4 Г/добу дає змогу тривалий час контролювати симптоми бронхіаль-
- •10 Мг на добу. Його вплив, очевидно, пов'язаний з блокуванням лейко-
- •4. Клініко-дієтологічні методи
- •Спектр алергенів при харчовій сенсибілізації у дітей (за а. Потьомкіною, 1990)
- •Спектр алергенів при харчовій сенсибілізації у дорослих
- •Найважливіші лібератори гістаміну (за в. Казьмірчук, 1996)
- •1 Капсулі (20 мг) 3-4 рази на добу.
- •9. Вплив ліків на екологію мікроорганізмів:
- •10. Вплив медикаментів на основні обмінні процеси в організмі.
- •11. Побічні реакції та ускладнення:
- •12. Побічні реакції і ускладнення змішаного генезу:
- •13. Побічний вплив ліків, обумовлений факторами зовнішнього сере-
- •Життєвої сенсибілізації".
- •Імунотерапія
- •2) Антилімфоцитарна сироватка і глобулін;
- •3) Моноклонові антитіла;
- •4) Високоселективні цитостатики (циклоспорин а, такролімус, гус-
- •II. Глюкокортикоїди.
- •III. "Малі" імунодепресанти:
- •1} Похідні 4-амінохінліни (делагіл, плаквеніл);
- •2) Пеніциламін і препарати золота;
- •3) Гепарини та інгібітори ферментів;
- •4) Колхіцин;
- •5) Нестероїдні протизапальні засоби (у великих дозах).
- •IV. Немедикаментозні методи імуносупресивного впливу:
- •1) Хірургічне втручання (спленектомія, синовектомія);
- •2) Іонізуюче опромінення (тотальне, локальне, екстракорпоральне)
- •3) Методи, що зумовлюють розвиток цитопенії (дренаж грудного про-
- •Імуностимулятори
- •1) Вакцини (живі, вбиті, рекомбінантні);
- •2) Анатоксини.
- •II. Пасивні:
- •1) Сироватки;
- •2) Імуноглобуліни;
- •3) Моноклонові антитіла..
- •II. З переважним впливом на гуморальну ланку: препарати кістково-
- •III. З переважним впливом на синтез інтерферону: нуклеїнові кисло-
- •IV. Препарати з комплексним впливом на імунну систему: рекомбі-
- •(В. Кресюн, 1993)
- •1000 Мг, 2000-1500-1000 мг тощо). Дози 2500 і 3000 мг на добу застосову-
- •Гусперимус.
- •0,5 Г тричі на добу (або у свічках чи клізмах) протягом 8-16 тижнів.
- •8 Років. Збільшення доз анти-сд20 мкат до максимальних забезпечи-
- •IgG, знайшов практичне.
- •Шуностимулятори
- •Зен, тимозин альфа (тимальфазии).
- •1. Інтерферони
- •2. Колонієстимулювальні фактори
- •3. Інтерлейкіни
- •4. Фактор некрозу пухлин (фнп)
- •5. Нейроцитокіни
- •6. Лейкоцитарні екстракти
- •Irs 19 (ipc 19) — новий імуностамулятор, який містить глюкопроте-
- •Ipc 19 застосовують при гострих, хронічних і рецидивних інфекці-
- •1 Інгаляції протягом ще 2-4 тижнів. З профілактичною метою засіб мо-
- •2 Доби після одноразового прийому (1-1,5 мг/кг) збільшує синтез ендо-
- •1870 P.). На сьогодні у світі застосовується близько 300 препаратів, які
- •1. Антибіотики
Пухлину
визначають як патологічний процес, що
характеризується
нестримним
розмноженням клітин, яке не контролюється
регулятор-
ним
впливом організму. Злоякісні пухлини,
на відміну від доброякіс-
них,
характеризуються, крім того, ще й
анаплазією (втратою диферен-
ціювання),
інвазивним ростом і метастатичним
поширенням.
Доведено,
що кожна "нормальна" соматична
клітина людського ор-
ганізму
має здатність до обмеженого числа
клітинних поділів, який вимі-
рюється
так званою межею Хейфліка (близько 100
мітозів). Нещодавно
виявили,
що це обмеження зумовлене роботою
спеціального біологічно-
го
молекулярного годинника, який контролює
процес апоптозу — гене-
тично
запрограмованої клітинної смерті (на
противагу некрозу — руй-
нуванню
клітини, обумовленому впливом запалення,
ішемії та ін.). Ме-
ханізм
обмеження розміщений у теломерах —
ділянках на обох кінцях
кожної
хромосоми, в яких сотні разів повторюються
"беззмістовні" три-
плети.
Тривалий час вважалося, що вони не
відіграють ніякої ролі, аж
доки
дослідницькі групи, очолювані Накамурою
і Мейєрсоном, не ви-
явили,
що при кожному мітозі розміри теломери
щоразу вкорочуються
на
50-200 нуклеотидних пар. Після приблизно
80-100 мітозів запас без-
змістовних
триплетів вичерпується і активується
ген апоптозу.
Проте
під час ембріонального розвитку і у
статевих клітинах діє
специфічний
фермент — теломераза, який функціонує
як "фіксатор"
теломери,
попереджуючи її щоразове вкорочення
при мітозах і відтво-
рюючи,
за необхідністю, втрачену довжину
хромосоми. Такий же шлях
до
вічної молодості "вибрали" пухлини.
Вважається, що більшість типів
атипових
клітин (більше 90 %) можуть певним чином
"вимикати" ген
апоптозу,
"вмикаючи" ген, який контролює
активність теломерази
(hTRT).
Цікаво,
що теломераза належить до класу
ензимів-зворотніх
транскриптаз,
за допомогою яких переписують свою
генетичну інфор-
мацію
в людський геном РНК-віруси (в тому
числі вірус імунодефіциту
людини).
Тобто з'явився ще один факт, який, з
одного боку, вносить
певні
уточнення у вірусну теорію онкогенезу,
а з іншого — дає шанси
сподіватися
на ефективність деяких ліків, що
застосовуються у ліку-
ванні
СНІДу (інгібіторів зворотної транскриптази
— індінавіру, ламіву-
дину,
азидотимідину), при певних типах пухлин.
Згідно
з новими даними, теломераза є не лише
перспективою для
продовження
тривалості людського життя, але і
"винуватцем" багатьох
вроджених
захворювань, у тому числі деяких
первинних імунодефіци-
тів.
У соматичних клітинах організму
активність теломерази заблоко-
вана
ще до народження, тобто процес старіння
і шлях назустріч смерті
у
кожної людини починається ще в
материнській утробі.Імунологія пухлин
Для
блокування активності теломерази і
активації апоптозу в органі-
змі
функціонують певні системи, які, однак,
перестають спрацьовувати
у
випадку злоякісних пухлин. На сьогодні
вважається, що відміна
апоп-
тозу
є ключовим рушійним фактором онкогенезу.
Характерно,
що ати-
пові
клітини практично повністю втрачають
чутливість до внутрішньо-
клітинних
індукторів апоптозу, і значною мірою
— до зовнішніх.
ОСНОВНІ
ВІДМІННОСТІ МІЖ ВИДАМИ КЛІТИННОЇ СМЕРТІ
Форма
клітинної
смерті
Апоптоз
Некроз
Порушення
цілості клітинної
мембрани
На
останніх етапах, процесу На
ранніх стадіях
Автономність процесу
Так,
стимуляція ззовні необов'язкова Ні,
стимуляція ззовні обов'язкова
Самообмеженість
процесу Так Ні
Фактори,
які
обмежують
процес
Самообмежується (генетичні) Запальні
зміни у тканинах Поширеність Обмежений Поширений
Запуск
процесу Генетично
детермінований Випадковий
Причини
Досягнення
межі Хейфліка,
вплив цитокінів
Ішемія,
продукти розпаду клітин, токсини,
крайні температури тощо
Апоптотичні
зміни, які відбуваються у клітині, не
залежать ні від
типу
клітини, ні від тривалості її життя.
Апоптоз однаково перебігає як
у
клітинах м'язового епітелію, які живуть
лише декілька днів, так і в
нейронах
і остеобластах, що живуть десятки років.
Зміни,
які відбуваються в клітині під час
апоптозу, можна розділи-
ти
на 2 фази:
1.
Фаза зворотних змін, під час яких процес
апоптозу можна зупи-
нити,
а клітинні структури будуть відновлені.
2.
Незворотна фаза, під час якої руйнуються
клітинні структури, а
з
клітини утворюється апоптотичне тільце.
Процеси,
які відбуваються під час першої фази
апоптозу, визнача-
ють
тип загибелі клітини (апоптотичний
або некротичний тип). Вони
залежать
від причини, яка запустила апоптоз
(старіння клітини, вплив
зовнішніх
токсичних або цитокінових факторів).
Перебіг другої фази
однаковий
в усіх випадках.
Найскладніший
механізм цитокінового
апоптозу — апоптозу,
інду-
кованого
цитокінами, серед яких — фактор некрозу
пухлин, деякі ін-
терлейкіни,
Fas-структури,
які взаємодіють з відповідними
рецептора-
ми
на поверхні клітини. Групу таких
рецепторів образно назвали "діля-
нкою
(доменом) смерті" (death
domain).
Сигнал
з рецептора передається
на
каскад з 10 протеаз-каспаз, причому ддя
кожного виду рецепторів
активується
своя гілка каскаду. Останніми в ланцюгу
активуються фо-
сфоліпаза
і транслоказа — ці два ферменти
запускають перебудову
клітинної
мембрани.
Індукція
цитокінового апоптозу — це один з
перспективних шляхів
до
подолання резистентності пухлини.
Можливості цього методу поки
що
обмежуються автономією пухлини в
організмі, нечутливістю ати-
пових
клітин до індукторів апоптозу.
Затримка
апоптозу в клітинах-мішенях може статися
під впливом
екзогенних
онкогенів фізичного (радіоактивне
випромінювання, ульт-
рафіолет),
хімічного (бензпірени, вільні радикали)
або біологічного (ві-
руси,
бактерії) походження. Класичним прикладом
є чіткий зв'язок
Helicobacter
pylori з
раком шлунка.
Вплив
вірусів на онкогенез залежить від
декількох факторів:
• наявність
специфічних до вірусу антигенів на
клітинах-мішенях,
які
забезпечують органну або тканинну
специфічність онкогенезу;
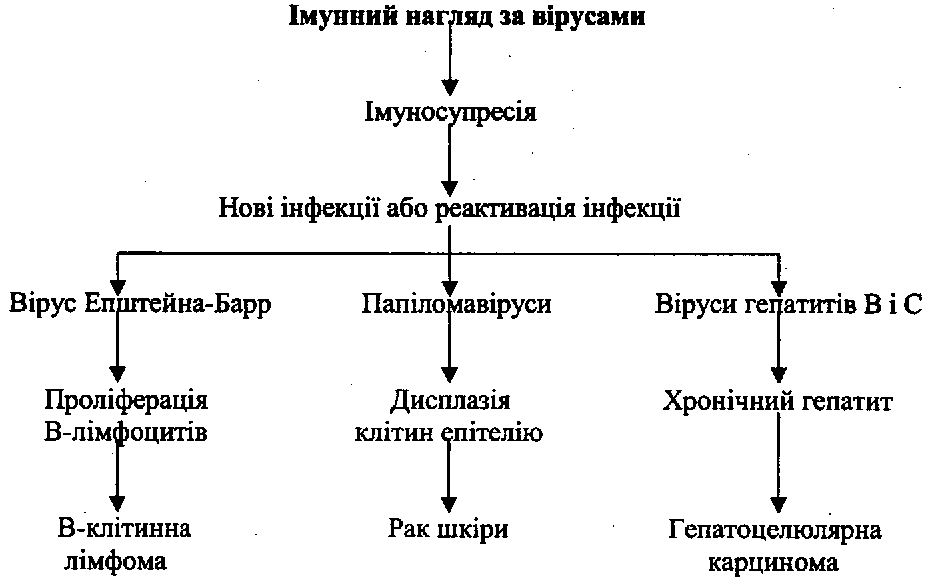
• здатність
вірусу стимулювати проліферацію
клітин-мішеней, а не
їх
руйнування;
• вплив
підсилювальних або синергічних факторів
(ультрафіолето-
ве
проміння, хімічні канцерогени, інші
віруси). Так, коінфекція
аденовірусами
посилює онкогенність вірусу Епштейна-Барр;
ві-
руси
простого герпесу, імунодефіциту людини
і Епштейна-Барр
взаємно
активують канцерогенність один одного;
• наявність
імунного дефекту, який забезпечує
вислизання вірусу
з-під
імунного нагляду і його тривалу
персистенцію в організмі;
• функціональна
недостатність механізмів протипухлинного
нагля-
ду,
що дає змогу новоутвореній пухлинній
клітині уникнути зни-
щення
і дати початок цілому клонові клітин,
Іноді саме вірусні
білки
мають таку дію. Так, віруси герпесу і
Епштейна-Барр при-
гнічують
гени-супресори онкогенезу.
Проте
автономність пухлин від організму до
певної міри віднос-
на,
бо вони повністю залежать від кисню і
поживних речовин, які
отримують
з кровотоку. З іншого боку, постійно
відбувається взає-
модія
на рівні "пухлина-організм", причому
цей контакт в основно-
му
здійснюється за рахунок імунних
механізмів. Після робіт Пауля
Ерліха,
який вперше відтворив модель пухлинного
росту, імунологі-
чна
теорія успішно конкурувала з
вірусно-генетичною і канцероген-
ною
теоріями. Згідно з сучасними уявленнями,
ці теорії гармонійно
поєднуються.
Наявність
імунної відповіді на пухлину
підтверджується такими
фактами:
1.
Тривалий розвиток і ріст багатьох
пухлин з періодами "завмирання"
росту.
Часто після такого періоду відбувається
раптове метастазу-
вання
і настає смерть пацієнта.
2.
Зворотний розвиток пухлин, що, однак,
клінічно спостерігається не-
часто
(переважно при меланомах і нейробластомах).
3.
Інфільтрація пухлин лімфоцитами і
макрофагами. При карциномах
in
situ
ступінь мононуклеарної інфільтрації
корелює з частотою ви-
живання
і прогнозом.
4.
Метастатичні клітини присутні практично
в усіх пацієнтів із злоякі-
сними
пухлинами, а проте самі метастази
виникають далеко не в
кожного,
тобто частота імплантації і росту
таких клітин невисока.
Зокрема,
атипові клітини у регіональних венах
виявляються в кож-
ного
третього хворого, що менше за частоту
розвитку інших осере-
дків
росту. Після онкооперацій атипові
клітини виявляють у крові
переважної
більшості хворих, проте післяопераційні
метастази ви-
никають
не в усіх.
5.
Синтез антитіл до антигенів пухлини.
