
- •Перелік умовних скорочень
- •Структура і функціонування імунної системи
- •Природні бар'єри
- •4) Розселення т- і в-лімфоцитів на периферії та індукція толерант-
- •5) Антигенозалежний етап диференціювання лімфоцитів (імуноге-
- •Дефіцит компонентів комплементу
- •2. Інтерферони
- •3. Фактори некрозу пухлин (фнп)
- •4. Інші цитокіни
- •Toll-like рецептори
- •2. Особливості механізмів набутого і вродженого імунітету.
- •3. Структура імунної системи. Основні органи і клітини.
- •4. Функції комплементу, його роль в нормі і при патології.
- •5. Основні механізми клітинної цитотоксичності.
- •6. Популяції і субпопуляції лімфоцитів. Cd-номенклатура.
- •7. Макрофаги, їх роль у специфічному і неспецифічному імунітеті.
- •8. Класи і функції імуноглобулінів. Роль імунних комплексів.
- •9. Типи цитокінів. Їх функції і біологічна роль.
- •10. Молекули міжклітинної адгезії.
- •Організація імунної відповіді
- •4. Стадія формування та підтримки імунологічної пам'яті. Відбувається
- •5. Відповідь при повторному контакті з антигеном. За рахунок існуван-
- •Дисфункції імунної системи
- •1. Розлади процесів перетравлення (кілінгу):
- •2. Розлади хемотаксису, міграції і дегрануляції:
- •3. Дефекти опсонізації і поглинання:
- •1. Вісім або більше випадків отиту протягом 1 року.
- •2. Два або більше випадків синуситів протягом 1 року.
- •3. Два або більше місяців призначення антибіотиків без значного
- •4. Дві пневмонії або більше протягом 1 року.
- •5. Значне відставання дитини у рості або у масі тіла.
- •6. Рецидивні глибокі абсцеси підшкірної клітковини або абсцеси
- •7. Персистентна молочниця ротової порожнини або інших ділянок
- •8. Потреба у внутрішньовенному введенні антибіотиків для досяг-
- •9. Дві "глибокі" інфекції або більше: менінгіти, остеомієліти, целю-
- •10. Первинні імунодефіцити в родинному анамнезі.
- •Клінічні синдроми, які часто виявляються:
- •Клінічні синдроми, які виявляються у частини хворих:
- •1. Алергічні захворювання.
- •2. Автоімунні захворювання.
- •3. Онкозахворювання.
- •4. Дисбактеріози.
- •5. Хроніосепсис.
- •III. Розлади обміну речовин та інтоксикації, зумовлені:
- •1. Ураженням детоксикаційних органів і систем (печінка, нирки).
- •2. Хронічним ураженням інших органів.
- •3. Ендокринопатіями.
- •4, Втратою крові, білків.
- •1. Екологічні і виробничі чинники.
- •2. Аліментарні фактори (дефіцит вітамінів, мікроелементів, якіс-
- •3. Інфекційні хвороби:
- •II. Зумовлені соціальними факторами:
- •1. Спосіб життя і шкідливі звички (куріння, алкоголь, урбанізація,
- •2. Надмірний рівень сумарного стресового навантаження.
- •3. Ятрогенії:
- •Імунопатологічні синдроми
- •1. Синдром швидкої втоми [втомливості] — екологічний імуноде-
- •2. Синдром хронічної втоми - стан з глибшими імунологічними
- •Оцінка імунного статусу людини
- •3. На сьогодні у клініках та імунологічних лабораторіях світу викорис-
- •1. Забираючи кров для імунологічного обстеження, необхідно макси-
- •2. Показники імунограми найкраще порівнювати з індивідуальною нор-
- •3. Комплексний аналіз імунограми більш інформативний, ніж характе-
- •4. Якщо показники індивідуальної норми не відомі, особливо необхід-
- •5. Реальну інформацію в імунограмі несуть лише значні зсуви показни-
- •6. Висновки можна робити лише після порівняння імунологічних і
- •Період реконвалесценції:
- •Трансплантаційна імунологія. Імуногенетика
- •1990 Р. Більше 18 тис. Американців потребували тансплантації органів
- •2. Dn і do локуси розміщені між dp і dq ділянками. Dn і do
- •//|Pp|dq |drhc2|BdC4Af210hAlC4b| 21-онвн tnFojTnFpHв[ с | а
- •1. Якщо лімфоцити донора і реципієнта змішати у культурі клітин, то в
- •2. Проте mlr зазвичай проводиться у вигляді односпрямованого тесту,
- •1. Протягом певного часу забирають кілька зразків сироватки кро-
- •2. Якщо хоча б в одному випадку виявляється лізис донорських
- •2. Гостре або пришвидшене відторгнення. Реакція опосередковується
- •3. Лабораторні: лейкоцитоз із еозинофілією і збільшенням шое, пока-
- •4, Імунологічні: важливими критеріями кризу є зростання співвідношен-
- •Генетика імунної відповіді
- •1. Пептиди, які зв'язуються з ніа-і класу, містять 8-10 амінокислот,
- •2. Молекули ніа-і класу синтезуються в цитозолі клітини, де зали-
- •9 Алельних варіантів. При цьому виявилося, що лише деякі з них пов'я-
- •50 Млн хворих на віл/снід, більшість із них, очевидно, помре протя-
- •3. Автоімунні ураження:
- •1) Пряма цитопатична дія вірусу. Вона підтверджується тим, що три-
- •2) Пригнічення продукції іл-2 — основного фактора росту і актива-
- •3) Поверхневий глікопротеїд віЛу др120, одночасно зв'язуючись з
- •4) Вірусні антигени та імунні комплекси активують так званий пе-
- •5) Можливе також ураження вірусом клітин-попередників т-лімфо-
- •6) Віруси цитомегалії та мікобактерії туберкульозу, які часто акти-
- •20 І більше разів рідше, ніж у віці 60-69 років. Очевидно, імунна систе-
- •Вакцини. Імунопрофілактика
- •1 Рік після трансплантації кісткового мозку можна застосувати вбиті
- •Хірургічна імунологія
- •Медіатори септичної запальної відповіді та їх антагоністи
- •2. Етіотропне лікування при сепсисі відіграє важливу, але не вирі-
- •3. Патогенетична терапія полягає у профілактиці і лікуванні син-
- •8 Год вводять біфідумбактерин, який пришвидшує формування біфідо-
- •70 % Випадків втрата яйцеклітини відбувається до імплантації [преім-
- •4. Потужним фактором імунологічного захисту плода є децидуальна
- •5. Після дозрівання трофобласта він сам починає продукувати імуносу-
- •6. Аменорея з гіпоестрогенією.
- •7. Олігоменорея.
- •8. Нерегулярний менструальний цикл з овуляцією.
- •9. Ановуляція.
- •10. Врождені аномалії.
- •11. Непрохідність маткових труб.
- •12. Злуковий процес в малому тазі.
- •13. Ендометріоз.
- •14. Набута патологія матки, цервікального каналу.
- •15. Набута патологія труб.
- •16. Набута патологія яйників.
- •17. Туберкульоз.
- •18. Імунологічні причини.
- •19. Ятрогенна причина.
- •20. Системні захворювання.
- •21. Причина не встановлена (немає лапароскопії).
- •22. Від'ємний посткоїтальний тест.
- •23. Відсутність видимої причини безпліддя.
- •1) Вторинний імунодефіцит;
- •2) Антигаметний (антиоваріальний) імунний конфлікт;
- •3} Антигаметний (антиспермальний) імунний конфлікт;
- •4) Високий рівень гістосумісності між подружжям.
- •1. Прискіпливо зібраний анамнез (див. Вище).
- •2. Огляд пацієнтки. Клінічна оцінка фертильності жінки при огляді вклю-
- •7) З метою імунореабілітації таким хворим часто призначають фізі-
- •8) З метою покращання регуляторних зв'язків між імунною та ен-
- •9} Для отримання достовірних результатів повторне імунологічне
- •1:32, Для сім'яної плазми — 1:64. Визначення титрів у динаміці дозволяє
- •Імунологія пухлин
- •6. Антологічні пухлини швидко розсмоктуються організмом у випадку,
- •7. Частота розвитку пухлин набагато вища у період новонародженості
- •8. Позитивні шкірні проби з пухлинними антигенами (екстракт з клі-
- •9. Зростання частоти виникнення пухлин у хворих, які отримують іму-
- •10. У пацієнтів з пригніченням функції клітинної ланки імунітету зрос-
- •1. Оцінка імунного статусу хворого. Окрім формування груп підвищено-
- •2. Виявлення специфічних антигенів пухлини. Метою таких обстежень
- •Основні ембріональні антигени
- •3) Активації імунної відповіді, оскільки як сама пухлина, так і цитоста-
- •1. Моноклонові антитіла. Основний принцип дії моноклонових анти-
- •2. Пухлиноінфільтруючі лімфоцити (til) — лімфоцити, активовані іп
- •Vitro у присутності клітин пухлини та іл-2 (їх ще іноді називають
- •3. Макрофагоактивуючі фактори, застосування яких забезпечує акти-
- •5. Перші серйозні досягнення в онкоімунології третього тисячоліття
- •Автоімунні хвороби
- •9 Разів, ревматоїдним артритом — утричі. Лише при анкілозуючому
- •10 До 15 типів автоантитіл різної специфіки.
- •Основні автоімунні процеси
- •4) Тироксин (трийодотиронін) — звичайно виступає в ролі гаптену,
- •5) Тетрайодотиронін — як правило, діє як гаптен;
- •6) Поверхневі мембранні антигени залози.
- •Класифікація системних васкулітів
- •2.3. Вторинні, асоційовані з імунними комплексами:
- •3. Системні васкуліти з переважним пошкодженням середніх та малих
- •3.1. Первинні, асоційованні з антитілонейтрофільно-цитоплазматич-
- •3.2. Первинні, зумовлені антиендотеліальними клітинно-фіксовани-
- •3.3. Первинні імунокомплекснозалежні:
- •3.4. Вторинні, антитілозалежні:
- •3.5. Вторинні, асоційованні з імунними комплексами:
- •4. Системні васкуліти з переважаючими пошкодженнями дрібних су-
- •4.1. Первинні, асоційованні з клітинами до базальних мембран:
- •4.2. Первинні, асоційовані з антинейтрофільноцитоплазматичними
- •4.3. Первинні, асоційовані з імунними комплексами:
- •2 (Мелоксикам), які меншою мірою подразнюють слизові оболонки.
- •5. Велика кількість хвороб і багато клінічних симптомів у одного
- •1. Тривалість симптомів хвороби.
- •2. Зв'язок симптомів з подорожами, контактом з токсичними речо-
- •3. Локальний чи генералізований характер симптомів.
- •4. Зв'язок генералізації симптомів зі зниженням маси тіла, загаль-
- •5. Детальний терапевтичний анамнез хворого за органами і системами.
- •6. Спадковий анамнез.
- •7. Особливості способу життя.
- •8. Лікувальні заходи в анамнезі (променева терапія, гемодіаліз).
- •9. Недоношеність.
- •60 %, А, окрім того, еозинофілією зазвичай супроводжується серпоподіб-
- •138,0 Г/л, при цьому 93 % з них — еозинофіли. Перебіг злоякісний,
- •Алергічні хвороби
- •Vitro. Але, як і в інших галузях медицини, лабораторні методи не мо-
- •IgG) або підвищення активності т-лімфоцитів-супресорів, що веде до
- •10"6), Поступово збільшуючи дозу до появи слабопозитивної реакції.
- •10 Таблеток на добу або по 1 таблетці за 15-30 хв до контакту з потен-
- •Псевдоалерпя і параалергія
- •X. Найважливішим і найпоширенішим є гістаміновий варіант псев-
- •2. Розлади активації системи комплементу. При вродженій чи набу-
- •3. Розлади метаболізму арахідонової кислоти. Відомо, що продукти пе-
- •Клінічні форми алергічних хвороб
- •2 % Розчину допаміну; якщо його немає, можна застосувати 1 %
- •Клінічні симптоми бронхіальної астми різної тяжкості до початку лікування
- •2,4 Г/добу дає змогу тривалий час контролювати симптоми бронхіаль-
- •10 Мг на добу. Його вплив, очевидно, пов'язаний з блокуванням лейко-
- •4. Клініко-дієтологічні методи
- •Спектр алергенів при харчовій сенсибілізації у дітей (за а. Потьомкіною, 1990)
- •Спектр алергенів при харчовій сенсибілізації у дорослих
- •Найважливіші лібератори гістаміну (за в. Казьмірчук, 1996)
- •1 Капсулі (20 мг) 3-4 рази на добу.
- •9. Вплив ліків на екологію мікроорганізмів:
- •10. Вплив медикаментів на основні обмінні процеси в організмі.
- •11. Побічні реакції та ускладнення:
- •12. Побічні реакції і ускладнення змішаного генезу:
- •13. Побічний вплив ліків, обумовлений факторами зовнішнього сере-
- •Життєвої сенсибілізації".
- •Імунотерапія
- •2) Антилімфоцитарна сироватка і глобулін;
- •3) Моноклонові антитіла;
- •4) Високоселективні цитостатики (циклоспорин а, такролімус, гус-
- •II. Глюкокортикоїди.
- •III. "Малі" імунодепресанти:
- •1} Похідні 4-амінохінліни (делагіл, плаквеніл);
- •2) Пеніциламін і препарати золота;
- •3) Гепарини та інгібітори ферментів;
- •4) Колхіцин;
- •5) Нестероїдні протизапальні засоби (у великих дозах).
- •IV. Немедикаментозні методи імуносупресивного впливу:
- •1) Хірургічне втручання (спленектомія, синовектомія);
- •2) Іонізуюче опромінення (тотальне, локальне, екстракорпоральне)
- •3) Методи, що зумовлюють розвиток цитопенії (дренаж грудного про-
- •Імуностимулятори
- •1) Вакцини (живі, вбиті, рекомбінантні);
- •2) Анатоксини.
- •II. Пасивні:
- •1) Сироватки;
- •2) Імуноглобуліни;
- •3) Моноклонові антитіла..
- •II. З переважним впливом на гуморальну ланку: препарати кістково-
- •III. З переважним впливом на синтез інтерферону: нуклеїнові кисло-
- •IV. Препарати з комплексним впливом на імунну систему: рекомбі-
- •(В. Кресюн, 1993)
- •1000 Мг, 2000-1500-1000 мг тощо). Дози 2500 і 3000 мг на добу застосову-
- •Гусперимус.
- •0,5 Г тричі на добу (або у свічках чи клізмах) протягом 8-16 тижнів.
- •8 Років. Збільшення доз анти-сд20 мкат до максимальних забезпечи-
- •IgG, знайшов практичне.
- •Шуностимулятори
- •Зен, тимозин альфа (тимальфазии).
- •1. Інтерферони
- •2. Колонієстимулювальні фактори
- •3. Інтерлейкіни
- •4. Фактор некрозу пухлин (фнп)
- •5. Нейроцитокіни
- •6. Лейкоцитарні екстракти
- •Irs 19 (ipc 19) — новий імуностамулятор, який містить глюкопроте-
- •Ipc 19 застосовують при гострих, хронічних і рецидивних інфекці-
- •1 Інгаляції протягом ще 2-4 тижнів. З профілактичною метою засіб мо-
- •2 Доби після одноразового прийому (1-1,5 мг/кг) збільшує синтез ендо-
- •1870 P.). На сьогодні у світі застосовується близько 300 препаратів, які
- •1. Антибіотики
утворення
Т- і В-клітин пам'яті та підтримання їх
популяції протягом
дуже
тривалого часу: від року до десятиліть.
Стадія триває аж до на-
ступного
контакту з антигеном. Тривалість пам'яті
та її напруженість
залежать
від багатьох факторів: антигенних
властивостей збудника,
токсину
чи відповідних вакцин, анатоксинів,
інфікуючої дози, трива-
лості
контакту (перенесена хвороба, кратність
вакцинації та ін.), ста-
ну
імунної системи на час контакту з
антигеном та генетично обумо-
влених
індивідуальних особливостей імунної
відповіді. Імунологічна
пам'ять
може бути короткочасною (при поворотному
тифі, шигельоз),
тривалою
(сибірка, лептоспіроз) або навіть
пожитгєвою (поліомієліт,
кір,
коклюш). У деяких випадках пам'ять може
бути неефективною
внаслідок
швидкої мінливості збудника (грип) або
значного розмаїття
збудників
деяких захворювань (гострі кишкові
інфекції).
ня
клітин пам'яті імунна відповідь
мобілізується значно швидше і ефе-
ктивніше,
ніж при первинному контакті. Для
досягнення ефекторної
стадії
немає необхідності у тривалій стадії
індукції. Мобілізація клі-
тинної
ланки полягає у швидшому наростанні
числа антигеноспеци-
фічних
Т-кілерів. При повторній активації
гуморальних механізмів
практично
не утворюються ІдМ, антитілоутворення
розпочинається з
різкого
підвищення синтезу IgG.
Характерно,
що продукція антитіл
класу
G
розпочинається
практично відразу, а не через 1,5-2 тижні
після
контакту з антигеном (як при первинній
відповіді).
ТИПИ
ТА ОСОБЛИВОСТІ Π
РОТИ
ІНФЕКЦІЙНОГО ІМУНІТЕТУ
Визначають
3 принципові ефекторні механізми
імунного захисту:
■ >зинофільний,
В-лімфоцитарний (гуморальний) і
Т-кілерний (клітин-
ИЙ).
У
протигельмінтозному
імунітеті
домінує еозинофільна ефекторна
шка.
Т-хелпер-2
є ключовою фігурою у розвитку як алергії
негайного
ипу,
так і протипаразитарної імунної
відповіді. Клітини Лангерганса у
пкірі
і слизових оболонках вловлюють мінімальні
кількості розчинних
штигенів,
після чого мігрують у лімфатичні вузли.
Там вони перетво-
рюються
в дендритні клітини і презентують
антиген Т-хелперам-2, сто-
млюючи
їх за допомогою ІЛ-1. Т-хелпери-2 продукують
кілька типів
інтерлейкінів:
за допомогою ІЛ-4,
-13
і -16 вони стимулюють утворення
й
активність мастоцитів ("опасистих"
клітин) та ІдЕ, ІЛ-5 — активність
еозинофілів,
ІЛ-10 — пригнічують активність
Т-хелперів-1, синтез ІЛ-2
та
ІФН.4. Стадія формування та підтримки імунологічної пам'яті. Відбувається
5. Відповідь при повторному контакті з антигеном. За рахунок існуван-
Еозинофіли
належать до ефекторних клітин імунної
відповіді. Фік-
суючись
через Fc-рецептор
ІдЕ до личинок гельмінтів, вони виділяють
високоактивні
речовини. При дегрануляції еозинофілів
звільняються
катіонні
білки, пероксидаза, головний лужний
білок — вони пошко-
джують
паразита, руйнуючи його кутикулу.
Мастоцити
і базофіли, які теж активуються
Т-хелперами-2, не бе-
руть
важливої участі у пошкодженні паразитів.
Але виділяючи значну
кількість
медіаторів запалення (більше 10
інтерлейкінів, гістамін, лей-
котрієни,
фактор некрозу пухлин та ін.), ці клітини
сприяють активні-
шій
роботі еозинофілів. Надлишок біологічно
активних речовин нейт-
ралізується
за рахунок зв'язувальної функції
альбуміну, активності де-
яких
ферментів (гістаміназа, фосфоліпази)
або інгібіторів ферментів
(інгібітори
протеолізу). Ці механізми запобігають
надмірній активації
механізмів
гіперчутливості та ушкодженню тканин.
За
допомогою ІЛ-3, -4 і -6 Т-хелпери-2 стимулюють
дегрануляцію
мастоцитів
і еозинофілів. Цитокіни, що виділяються
при цьому, вто-
ринно
пришвидпгують розмноження і дозрівання
Т-хелперів-2.
В-лімфоцит
під впливом ІЛ-4 перетворюється у
плазматичну кліти-
ну
і набуває здатності синтезувати
імуноглобуліни, зокрема ІдЕ (реагі-
ни)
та IgG2a.
Реагіни
можуть відразу фіксуватися на антигенах
личин-
ки
— тоді до їх Fc-фрагмента
приєднуються еозинофіли. Можливий
варіант,
при якому ІдЕ спочатку фіксуються
Fc-фрагментами
до масто-
цитів,
а вже потім — до антигенів найпростіших.
Т-кілерний
механізм практично не задіяний у
протипаразитарному
імунітеті.
Цікаво, що Т-супресори (CDS-лімфоцити),
виділяючи ІЛ-4 та
ІЛ-10,
пригнічують активність Т-хелперів-1,
але при цьому можуть сти-
мулювати
Т-хелпери-2, продукуючи ІЛ-5 та ІЛ-13.
Гельмінти
використовують чимало механізмів, щоб
уникнути впли-
ву
імунної системи. Серед них — втрата
антигенів, наявність антиге-
нів,
спільних з антигенами господаря, сорбція
на поверхні личинки чи
дорослого
паразита антигенів господаря. Крім
того, паразити виділя-
ють
імуносупресивні речовини, а також
ініціюють реакції гіперчутли-
вості.
Останні спотворюють імунну відповідь.
Вказані особливості ство-
рюють
сприятливі умови не тільки для тривалого
виживання збудника,
але
і для розвитку інших інфекцій,
новоутворів, істинних, псевдо- і
параалергічніх
реакцій.
Протибактерійний
імунітет здебільшого
реалізується через гумо-
ральну
ланку (синтез циркулювальних антитіл)
як до самих бактерій,
так
і до їх токсинів, особливо у разі
продукції ними екзотоксину.
Спільний
вплив імуноглобулінів та системи
комплементу веде до
незворотного
пошкодження цитолеми бактерійної
клітини. Особливо
чутливою
до такого впливу комплементу є оболонка
грамнегативних
бактерій
— соматичний полісахарид у їх стінці
є потужним імуноге-
ном.
Специфічна відповідь на інкапсульовані
бактерії (клебсієла, ме-
нінгококи,
стрептококи) теж значною мірою залежить
від рівня анти-
тіл
проти антигенів клітинної мембрани.
Антитіла
можуть утворюватися не лише проти самих
бактерій, але
і
проти їх токсинів. А якщо мікроорганізм
продукує екзотоксин, то
антитоксичний
імунітет може відіграти провідну роль
у захисті органі-
зму
від інфекції (дифтерія, правець,
ботулізм). Вакцинація проти диф-
терії
чи правця теж спрямована на утворення
саме антитоксичного
імунітету.
Проте навіть достатньо напружений
антитоксичний імунітет
не
захищає людину від самого захворювання,
а лише від його усклад-
нень.
Так, успішна вакцинація проти дифтерії
лише різко знижує ймо-
вірність
розвитку міокардиту і поліневриту.
Крім
безпосередньої участі в нейтралізації
бактерій та їх токсинів,
антитіла
сприяють їх елімінації іншим чином.
Дуже важливою їх фун-
кцією
є опсонізація
—
здатність посилювати фагоцитоз бактерій.
При
цьому
антитіла взаємодіють одночасно з
антигенами бактерії (за допо-
могою
Fab-фрагмента)
і макрофага (за допомогою Fc-фрагмента).
Крім
того,
імуноглобуліни нейтралізують
антифагоцитарні фактори бакте-
рійної
стінки та речовини, які продукуються
збудником і блокують мі-
грацію
макрофагів та їх активність.
Клітинний
імунітет має важливе значення лише у
захисті від тих
бактерій,
які мають внутрішньоклітинний етап у
розвитку або є обліга-
тними
внутрішньоклітинними паразитами, як
мікобактерії, токсоплаз-
ми,
хламідії. Нейтралізація збудника
можлива тільки за тої умови, якщо
клітина,
у якій він паразитує, буде зруйнована
клітинами-кілерами.
Для
таких захворювань також характерна
гіперчутливість сповіль-
неного
типу. її наявність часто свідчить
підтвердженням активної клі-
тинної
відповіді проти даних збудників та
використовується у клінічній
практиці
для виявлення захворювання (наприклад,
туберкулінова про-
ба).
При цьому вираження шкірних проявів
при пробах, як правило,
корелює
з активністю процесу. Хоч варто зауважити,
що механізм гі-
перчутливості
не має суттєвого значення для елімінації
збудника.
Бактерійні
інфекції часто зумовлюють формування
вторинного іму-
нодефіциту,
або його поглиблення, якщо він вже
існував. Так, значне
зниження
вмісту і функціональної активності
Т-лімфоцитів описане
при
туберкульозі, лепрі, сифілісі.
Пневмо-,
гоно- і менінгококи пригнічують
активність фагоцитозу.
У
випадку їх поєднання з герпесвірусом
чи червоним пласким лишаєм
спостерігають
також пригнічення Т-ланки імунітету.
Можливо, у цьо-
му
випадку спостерігається лише посилення
розмноження персистент-
них
вірусів внаслідок супресії клітинних
механізмів, спричиненої ко-
ковою
інфекцією. Пригнічення активності
Т-лімфоцитів виявлені та-
кож
при кашлюкові, скарлатині, бруцельозі
тощо.
Специфічні
зміни в імунітеті спостерігаються
також при стрепто-
коковій
і стафілококовій інфекціях. На тлі
пригнічення Т-ланки імуні-
тету
(здебільшого Т-супресорів) спостерігається
поліклональна актива-
ція
В-лімфоцитів з можливістю синтезу
автоантитіл в осіб з генетично
детермінованою
слабкістю імуносупресорних механізмів.
Ці зміни мо-
жуть
призвести до формування ревмокардиту,
скарлатинозних уражень
серця,
ранніх постінфекційних нефритів,
артритів і васкулітів.
У
противірусному
захисті
одним з найважливіших є саме клітин-
ний
механізм захисту. Гуморальні механізми
ефективні лише після ін-
дукованої
вірусом загибелі інфікованих клітин
(це властиво для рино-,
ентеровірусів,
вірусів грипу) і виходом вірусу у
позаклітинний простір.
Проте
значна кількість вірусів позбавлена
прямої цитопатичної дії, тобто
їх
внутрішньоклітинне паразитування не
зумовлює загибелі клітини. А
деякі
— навіть стимулюють клітинний поділ
(гепаднавіруси, вірус Еп-
штейна-Барр).
Зрозуміло, що в такому випадку вірус
стає мішенню для
гуморальних
факторів лише протягом короткого
моменту переходу з
однієї
клітини в іншу. При деяких вірусних
інфекціях (герпес, цитоме-
галія)
збудник переходить з клітини в клітину
по цитоплазматичних
містках,
не руйнуючи інфікованих клітин. У таких
випадках клітинний
механізм
імунітету стає не просто важливим, а
домінуючим.
Специфічні
Т-кілери з'являються в організмі через
2-3 доби після
контакту
з вірусом, хоч їх противірусна активність
сягає максимуму
аж
наприкінці першого тижня. Т-кілери
розпізнають на поверхні інфі-
кованої
вірусом клітини комплекс "вірусний
антиген + HLA-I".
Суттєву
роль при вірусних інфекціях відіграють
також Т-ефектори
гіперчутливості
сповільненої дії. На відміну від
Т-кілерів, вони стиму-
люються
через Т-хелпери 2-го типу і реагують
переважно на антигени,
представлені
HLA-II.
Ще
одна принципова різниця полягає у
способі
знищення
інфікованих вірусом клітин. Т-кілер
здійснює його внаслі-
док
безпосереднього контакту, а Т-ефектори
гіперчутливості — на від-
стані,
виділяючи медіатори-лімфотоксини.
К-лімфоцити теж можуть
руйнувати
інфіковані вірусом клітини, але
тільки тоді, коли останні
вже
"помічені" зафіксованими на них
імуноглобулінами.
Важливе
значення у клітинній ланці захисту
мають також макрофа-
ги.
Проте вони швидше виконують роль
"прибиральників", добиваючи
клітини-мішені,
що були попередньо пошкоджені іншими
факторами
імунітету
або мічені антитілами. Інтенсивне
руйнування клітин і контакт
імунної
системи зі значною кількістю "спотворених"
антигенів, що ма-
ють
детермінанти, властиві як вірусу, так
і тканинам організму, може
призвести
до автосенсибілізації. За наявності
HLA-обумовленої
схильно-
сті
(генетично зумовлена слабкість
супресорних механізмів, що стриму-
ють
імунну відповідь) це веде до формування
автоімунних захворювань.
Імуноглобуліни
можуть зв'язувати і знешкоджувати
вірусні частин-
ки
тільки тоді, коли вони перебувають поза
клітиною. Утворені в ре-
зультаті
цього імунні комплекси досить швидко
поглинаються і пере-
травлюються
макрофагами. У деяких випадках (малі
розміри комплек-
сів,
слабкість фагоцитарної ланки, ураження
печінки та ін.) такі
комплекси
можуть тривало циркулювати в організмі
і фіксуватися на
стінках
дрібних судин з наступною активацією
комплементу і розвит-
ком
так званого імунокомплексного запалення.
На сьогодні вважаєть-
ся,
що саме персистентні та латентні вірусні
інфекції зумовлюють ура-
ження
судин і прогресування атеросклерозу.
Імуноглобуліни
можуть також зв'язуватися з вірусними
білками на
поверхні
інфікованих клітин. Інколи це призводить
до руйнування клі-
тини
внаслідок активації комплементу. Проте
частіше інфікована клі-
тина-мішень
знищується вже макрофагами або
Κ-клітинами,
які мають
рецептори
до Fc-фрагмента
імуноглобулінів. А СЗа і С5а фрагменти,
які
утворилися в результаті активації
комплементу, ініціюють запаль-
ний
процес та міграцію імуноцитів у вогнище
запалення.
Найважливішим
гуморальним фактором захисту від
вірусної інфе-
кції
є система інтерферонів, і, передусім,
γ-інтерферон.
Він продуку-
ється
Т-лімфоцитами у відповідь на вірусну
агресію і зменшує інтенси-
вність
синтезу вірусних білків в інфікованих
клітинах і вразливість до
вірусів
здорових клітин. Основними точками
впливу інтерферону є
пригнічення
транскрипції і трансляції генетичної
інформації вірусу.
Генетично
обумовлений високий рівень синтезу
інтерферону відіграє
вирішальну
роль у нечутливості деяких людей,
наприклад, до грипу.
Внаслідок
швидкої антигенної мінливості цього
вірусу, антигено-
специфічні
фактори захисту спрацьовують занадто
пізно, коли захво-
рювання
вже у розпалі. Тому саме інтерферон є
основним фактором
захисту
організму при грипі.
Протигрибковий
імунітет
забезпечується здебільшого клітинними
факторами.
Гіперчутливість сповільненого типу і
гуморальні фактори
стають
швидше свідками інфекції, ніж реальним
механізмом захисту.
Яскравим
свідченням цього є різке зростання
частоти мікозів із
віком,
коли ослабляється робота саме Т-ланки
імунітету, і принципова
неможливість
безрецидивного вилікування мікозів у
старшому віці без
супутньої
імунокорекції. Різко збільшується
ризик розвитку грибко-
вих
захворювань при патологіях, які глибоко
уражають клітинні меха-
нізми
імунної відповіді (СНІД, наркоманія,
саркоїдоз).
Лише
при глибоких мікозах формується сильна
імунна відповідь. У
випадку
поверхневих мікозів передусім реагують
механізми першої лі-
Механізми
реалізації імунної відповіді та алергії
(КЛ
- клітина Лангерганса, ДК - дендритна
клітина, МФ - макрофаг, Т-х - Т-хелпер, В
- В-
лімфоцит,
Т-к - Т-кілер, NK
- природній кілер, Κ
- кілер, Маст - мастоцит, ПК - плазматична
клітина,
Еоз - еозинофіл, АГ - антиген або алерген,
ПК - пухлинна клітина, В - клітина,
інфікована
вірусом, Γ
-
грибок, Б - бактерія).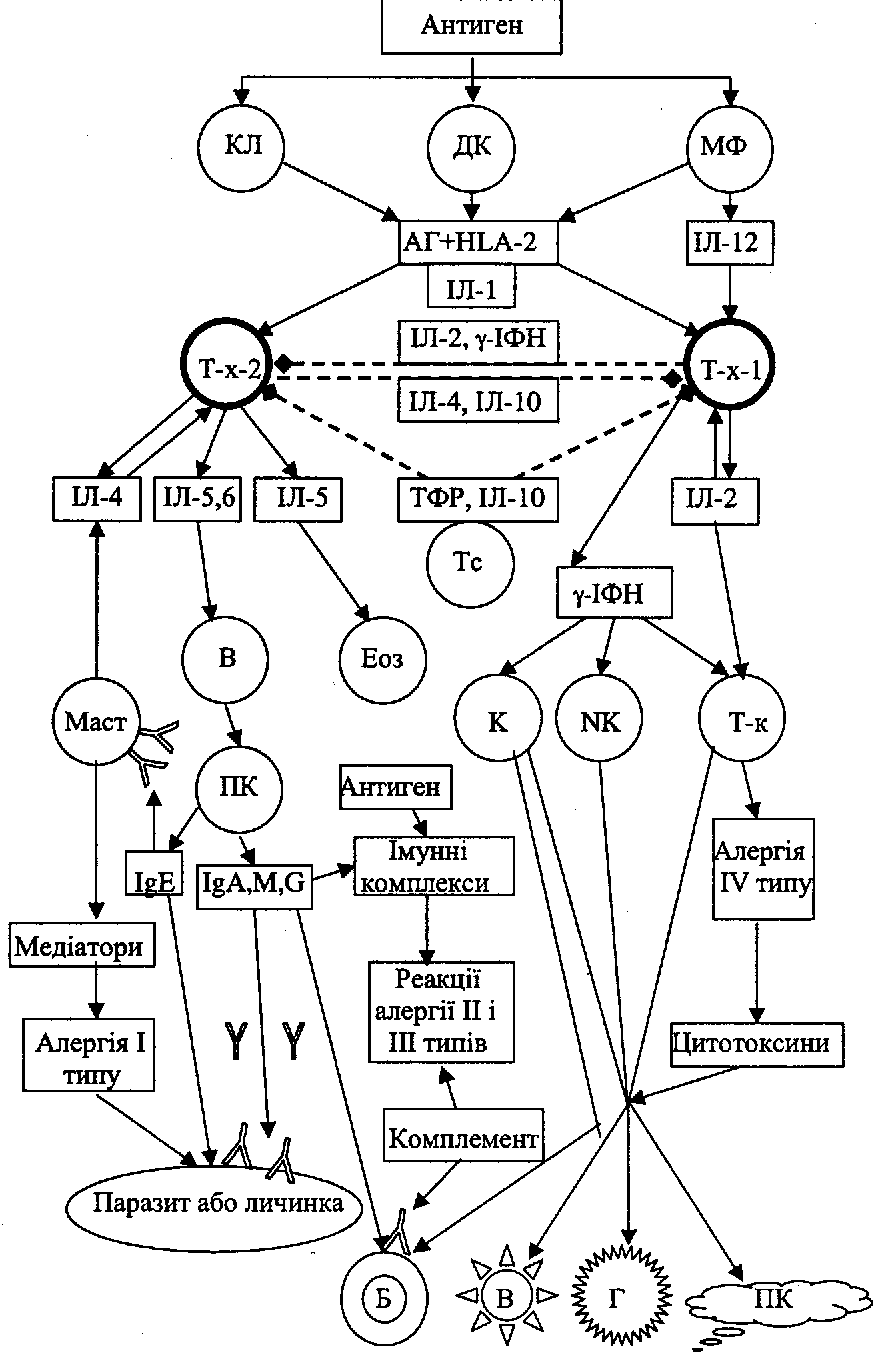
нії
захисту. їх формування поверхневих
мікозів може зумовитися навіть
факторами,
що пригнічують лише локальні механізми
імунної відповіді.
Так,
занадто тривале перебування шкіри у
неприродних умовах (вода зі
значною
концентрацією антисептиків, щільно
облягаюче взуття при си-
льній
пітливості та ін.) сприяє формуванню
стійких вогнищ поверхневої
мікотичної
інфекції — "стопи атлета", "стопи
плавця", "стопи солдата".
Протипротозоиний
Імунітет теж
забезпечується здебільшого за
рахунок
клітинних механізмів, оскільки
найпростіші належать до вну-
трішньоклітинних
збудників. Як і при мікозах, спостерігається
постій-
на
антигенна мінливість і низька напруженість
імунітету.
Наявність
лише клітинної відповіді (при слабкій
гуморальній) при-
зводить
до формування нестерильного імунітету
чи хронізації інфекції.
Ситуація
ускладнюється ще й тим, що деякі
найпростіші специфічно
пригнічують
імунну відповідь — це спостерігається
при малярії, лейш-
маніозі,
трипаносомозі, шистосомозі. Плазмодій
малярії пригнічує фу-
нкцію
макрофагів, шистосоми і трипаносоми
— надмірно посилюють
функцію
Т-супресорів. Плазмодії і трипаносоми,
крім того, зумовлю-
ють
поліклональну активацію В-лімфоцитів,
що порушує нормальний
процес
утворення антитіл.
Принципова
можливість протипріонового
імунітету на
сьогодні за-
перечується
більшістю дослідників, оскільки пріонові
білки і нормальні
білки
організму відрізняються лише за
конформацією, послідовність їх
амінокислотних
залишків та просторова орієнтація не
відрізняються.
ЗАПИТАННЯ
ДЛЯ САМОКОНТРОЛЮ
1.
Основні етапи Імунної відповіді, їх
характеристика.
2.
Особливості протигельмінтозного і
протипротозойного імунітету.
3.
Протибактерійний імунітет, механізми
його реалізації.
4.
Противірусний захист, його ефекторні
механізми.
5.
Особливості протигрибкового імунітету.
6,
Протипротозойний імунітет, механізми
його реалізації.
7.
Можливість протипріонового імунітету.
8.
Роль дисбалансу Т-хелперів 1-го і 2-го
типів при імунопатології.
