
- •Патологическая физиология
- •Глава 1. Общее учение о болезни 92
- •Глава 6. Патологическая физиология периферического (органного) кровообращения 695
- •Глава 12. Патологическая физиология 1237
- •.Краткие сведения об истории патологической физиологии
- •Экспериментально-физиологическое, физико-химическое направление
- •.Часть первая общая нозология
- •Глава 1. Общее учение о болезни
- •1.1. Здоровье и болезнь
- •1.1.1. Норма и здоровье
- •1.1.2. Определение сущности болезни
- •1.1.3. Патологическая реакция, патологический процесс, патологическое состояние
- •1.2. Общие вопросы учения об этиологии болезней
- •1.3. Общие вопросы учения о патогенезе болезней
- •1.4. Исходы болезни
- •На повреждение
- •2.1. Общая патология клетки
- •2.1.1. Повреждение клеток в патологии
- •2.1.2. Нарушение функций клеточных структур
- •Кусочки ткани Выделенные митохондрии
- •Время переживания органа при 24°с (мин)
- •2.1.3. Механизмы нарушения барьерной функции биологических мембран
- •СюТоксическое действие
- •Токсическое действие
- •2.1.4. Другие причины нарушения барьерных свойств липидного слоя мембран
- •Глава 1. Общее учение о болезни 92
- •Глава 6. Патологическая физиология периферического (органного) кровообращения 705
- •Глава 12. Патологическая физиология 1247
- •2.1.5. Нарушение электрической стабильности липидного слоя
- •2.2. Общие реакции организма на повреждение
- •2.2.1. Общий адаптационный синдром (стресс)
- •2.2.2. Активация протеолитических систем плазмы крови
- •I Фактор Хагемана Калликреин j I Прекалликреин
- •2.2.4. Кома
- •2.2.5. Ответ острой фазы
- •2.2.5.2. Главные медиаторы ответа острой фазы
- •3.1. Реактивность организма
- •3.2. Виды реактивности
- •3.5. Резистентность
- •3.6. Факторы, влияющие на реактивность
- •3.7. Роль наследственности
- •Гидрооксифенил виноградная кислота
- •Фенилпиро- виноградная кислота
- •Гомоге нти зи н о вая кислота
- •Гомогентизиноксидаза (алкаптонурия)
- •4.1. Основные представления о строении
- •4.2. Общая стратегия иммунной защиты
- •4.3. Иммунодефицитные состояния
- •4.3.1. Первичные иммунодефициты
- •4.3.2. Вторичные иммунодефициты
- •4.4. Аутоиммунные процессы
- •4.5. Лимфопролиферативные процессы
- •5.1. Взаимоотношение аллергии и иммунитета
- •5.3. Специфические аллергические реакции
- •5.3.1. Аллергические реакции I типа (анафилактические)
- •5.3.2. Аллергические реакции II типа
- •5.3.3. Аллергические реакции III типа
- •5.3.4. Аллергические реакции IV типа
- •Характеристика повышенной чувствительности немедленного и замедленного типов
- •5.4. Атопия. Атонические и псевдоатопические заболевания
- •5.4.1. Механизмы развития
- •5.4.2. Механизмы обратимой обструкции дыхательных путей
- •5.5. Псевдоаллергия
- •5.5.1. Гистаминовый тип псевдоаллергии
- •5.5.2. Нарушение активации системы комплемента
- •5.5.3. Нарушения метаболизма арахидоновой кислоты
- •Глава 6. Патологическая физиология периферического (органного) кровообращения и микроциркуляции
- •Состояние кровотока в микрососудах при артериальной гиперемии, ишемии, капиллярном стазе и венозном застое крови,
- •Признаки расстройства периферического кровообращения (в.В. Воронин, модификация г.И. Мчедлишвили)
- •6.1. Артериальная гиперемия
- •6.3. Нарушение реологических свойств крови, вызывающее стаз в микрососудах
- •6.4. Венозный застой крови
- •Превалирование резорбция вал фильтрацией я оды а микрооо- суддк мозга
- •6.6. Кровоизлияние в мозг
- •7.1. Нарушение микроциркуляции
- •7.2. Воспалительные экссудаты
- •7.3. Эмиграция лейкоцитов периферической крови
- •7.4. Фагоцитоз
- •7.5. Специализированные функции нейтрофилов, моноцитов
- •7.6. Медиаторы воспаления
- •7.7. Исходы воспаления
- •8.1. Этиология
- •8.3. Функция органов и систем
- •9.1. Нарушение обмена белков
- •9.1.1. Нарушение расщепления и всасывания белков
- •9.1.4. Патология межуточного обмена белков (нарушение обмена аминокислот)
- •9.1.5. Изменение скорости распада белка
- •9.1.6. Патология конечного этапа обмена белков
- •9.2. Нарушение обмена липидов
- •9.2.1. Нарушение транспорта липидов и перехода их в ткани
- •9.2.2. Роль нарушений липидного обмена в патогенезе атеросклероза
- •9.2.3. Жировая инфильтрация и жировая дистрофия
- •9.3. Нарушение обмена углеводов
- •9.3.3. Нарушение регуляции углеводного обмена
- •9.4. Нарушение водного баланса
- •9.4.1. Основы регуляции водного баланса
- •9.4.2. Формы нарушения водного баланса
- •9.4.2.1. Увеличение объема внеклеточной жидкости (гиперволемия)
- •9.4.2.2. Уменьшение объема внеклеточной жидкости (гиповолемия)
- •9.5. Нарушение электролитного баланса
- •Организма человека
- •9.5.1. Нарушение баланса натрия
- •9.5.2. Нарушение баланса калия
- •9.5.3. Нарушение баланса кальция
- •9.5.4. Нарушение баланса фосфатов
- •9.5.5. Нарушение баланса магния
- •9.6. Нарушение кислотно-основного баланса
- •9.6.1. Основы регуляции кислотно-основного баланса
- •0A* й к * 5 сз" 5 неш Лшкжы Анионы КаикшыКат ионы
- •9.6.2. Основные показатели коб
- •9.6.3. Формы нарушения кислотно-основного баланса
- •9.6.3.1. Респираторный ацидоз
- •9.6.3.2. Метаболический ацидоз
- •9.6.3.3. Респираторный алкалоз
- •9.6.3.4. Метаболический алкалоз
- •9.6.3.5. Смешанные нарушения кислотно-основного баланса
- •10.2. Компенсаторно-приспособительные реакции при гипоксии
- •10.3. Нарушение обмена веществ
- •10.4. Коррекция гипоксии: необходим избыток или недостаток кислорода?
- •11.1. Механизмы клеточного деления
- •11 »2. Патофизиология клеточного деления
- •11.2.1. Активация онкогенов
- •11.2.2. Инактивация генов-супрессоров
- •11.2.3. Нарушение апоптоза
- •11.2.4. Нарушение механизмов репарации днк
- •11.3. Опухолевый рост
- •11.3.2. Этиология опухолей
- •11.3.3. Свойства опухолевых клеток in vitro
- •11.3.4. Межклеточная кооперация
- •11.3.5. Свойства злокачественных опухолей
- •11.3.6. Взаимоотношения опухоли и организма
- •11.3.7. Механизмы резистентности опухолей к терапевтическим воздействиям
- •.Часть третья нарушение функций органов и систем
- •Глава 12. Патологическая физиология нервной системы
- •12.1. Общие реакции нервной системы на повреждение
- •12.2. Нарушение функции нервной системы,
- •12.3. Метаболические энцефалопатии
- •12.4. Повреждение мозга,
- •12.5. Расстройства функций нервной системы, обусловленные повреждением миелина
- •12.6. Нарушение нервных механизмов управления движениями
- •12.6.1. Расстройства движений,
- •12.6.1.1. Болезни моторных единиц
- •12.6.1.2. Расстройства движений
- •12.6.1.3. Нарушение движений при повреждении мозжечка
- •12.6.1.4. Нарушение движений
- •13.1. Нарушение механизмов регуляции артериального давления
- •13.2. Расстройства функций мочевого пузыря
- •13.5. Вегетативные расстройства,
- •15.1. Нарушение центральных механизмов регуляции
- •15.2. Патологические процессы в железах
- •15.3. Периферические (внежелезистые) механизмы нарушения активности гормонов
- •15.4. Роль аутоаллергических (аутоиммунных) механизмов в развитии эндокринных нарушений
- •1]ДиОТипиЧесИиЕ ahtuteaa
- •16.1. Нарушение функций гипофиза
- •16.1.1. Недостаточность функции гипофиза
- •16.1.2. Гиперфункция передней доли гипофиза
- •16.2. Нарушение функций надпочечников
- •16.2.1. Кортикостероидная недостаточность
- •16.2.2. Гиперкортикостероидизм
- •16.2.3. Гиперфункция мозгового слоя надпочечников
- •16.3. Нарушение функций щитовидной железы
- •16.3.1. Гипертиреоз
- •16.3.2. Гипотиреоз
- •16.4. Нарушение функций околощитовидных желез
- •16.5. Нарушение функций половых желез
- •17.1. Краткие сведения
- •17.2. Атеросклероз
- •17.2.1. Теории происхождения
- •17.2.2. Регресс атеросклероза
- •17.3. Нарушение коронарного кровотока
- •17.3.1. Ишемия миокарда
- •17.3.2. Оглушенный и бездействующий миокард
- •17.4.Артериальная гипертензия
- •Гипертоническая болезнь!
- •17.4.1. Патогенез гипертонической болезни
- •17.4.2. Вторичная артериальная гипертензия
- •17.6. Механизмы развития сердечной недостаточности
- •17.6.2. Диастолическая форма сердечной недостаточности
- •17.7. Механизмы развития аритмий
- •17.7.1. Нарушение образования импульсов
- •17,7,2, Риэнтри
- •17.7.3. Нарушение проводимости
- •Внешнего дыхания
- •18.1. Определение понятия «дыхательная недостаточность»
- •18.2. Оценка функций внешнего дыхания придыхательной недостаточности
- •18.3. Патофизиологические варианты дыхательной недостаточности
- •18.3.1. Центрогенная дыхательная недостаточность
- •18.3.2. Нервно-мышечная дыхательная недостаточность
- •18.3.3. «Каркасная» дыхательная недостаточность
- •18.3.4. Механизмы дыхательной недостаточности при патологии дыхательных путей
- •18.3.5. Паренхиматозная дыхательная недостаточность
- •18.4. Показатели газового состава крови при дыхательной недостаточности
- •18.4.1. Гипоксемическая (I типа) дыхательная недостаточность
- •18.4.2. Гиперкапнически-гипоксемический (вентиляционный) тип дыхательной недостаточности
- •19.1. Основы регуляции клеточного цикла
- •19.2. Патология красной крови
- •19.2.1. Анемии
- •19.2.2. Эритроцитозы
- •19.4. Патология белой крови
- •19.4.1. Лейкоцитопении
- •19.4.2. Лейкоцитоз
- •19.5. Лейкозы (гемобластозы, лейкемии)
- •20.1. Факторы, свертывающие кровь
- •VIll/vWf I
- •20.2. Геморрагические синдромы
- •20.4. Синдром диссеминированного
- •20.5. Методы оценки нарушений системы гемокоагуляции
- •21.1. Нарушение лимфообразования
- •Глава 1. Общее учение о болезни 92
- •Глава 6. Патологическая физиология периферического (органного) кровообращения 705
- •Глава 12. Патологическая физиология 1247
- •21.2. Недостаточность транспорта лимфы
- •21.3. Нарушение свертывания лимфы
- •21.4. Роль лимфатической системы в развитии отека
- •21.5. Функции лимфатической системы при развитии воспаления
- •22.1. Нарушение функций пищевода
- •22.2. Нарушение функций желудка
- •22.2.1. Нарушения секреции соляной кислоты и пепсина
- •22.2.2. Нарушение слизеобразующей функции желудка
- •22.2.3. Патофизиологические механизмы язвенной болезни
- •22.2.4. Нарушение двигательной функции желудка
- •22.3. Патофизиологические механизмы болей в животе
- •22.4. Нарушение экзокринной функции поджелудочной железы
- •22.4.1. Патофизиологические механизмы развития острого панкреатита
- •22.4.2. Патофизиологические механизмы развития хронического панкреатита
- •22.5. Нарушение функций кишечника
- •22.5.1. Нарушение переваривания и всасывания в кишечнике
- •22.5.2. Нарушения двигательной функции кишечника
- •23.1. Печеночно-клеточная недостаточность
- •23.2. Патофизиологические механизмы синдрома портальной гипертензии
- •23.3. Патофизиологические механизмы желтухи
- •24.1. Нарушение клубочковой фильтрации
- •24.2. Нарушение функций канальцев
- •24.3. Изменение состава мочи
- •24.4. Нефротический синдром
- •24.5. Острая почечная недостаточность
- •24.6. Хроническая почечная недостаточность
- •24.7. Мочекаменная болезнь
18.3.3. «Каркасная» дыхательная недостаточность
Основной механизм развития ДН при заболеваниях этой группы связан с уменьшением податливости грудной клетки (легочного каркаса). При этом дыхательные мышцы оказываются не в состоянии обеспечить полноценные экскурсии грудной клетки и соответственно легочной ткани.
Ограничение податливости грудной клетки может отмечаться при выраженном кифосколиозе и других аномалиях позвоночного столба или ребер, анкилозирующем спондилите (воспалительном заболевании межпозвоночных и реберно-позвоночных суставов), ожирении (при увеличении массы тела более 130 кг), а также в результате некоторых хирургических вмешательств (торакопластика) или травматических повреждений грудной клетки. При окончатом переломе ребер по нескольким линиям вероятность развития ДН особенно велика, поскольку при этом во время вдоха поврежденный участок грудной клетки обычно совершает парадоксальное движение внутрь (флотирующая грудная клетка),
Выраженный фиброз (заболевания плевры), скопление воздуха, жидкости в плевральных полостях, также могут приводить к развитию ДН. Податливость грудной клетки можеттакже уменьшаться при ограничении подвижности диафрагмы, обусловленной патологией брюшной полости (напряженный асцит, массивные опухоли, значительные увеличения печени и селезенки и т.д.).
Изменения функциональных показателей при этом характеризуются рестриктивным вариантом нарушения легочной вентиляции. Например, при выраженном кифосколиозе будет отмечаться снижение показателей TLC, VC и FRC.
18.3.4. Механизмы дыхательной недостаточности при патологии дыхательных путей
Развитие ДН при заболеваниях дыхательных путей обусловлено повышением резистивного сопротивления воздушному потоку (Rew). При этом нарушается вентиляция пораженных участков легкого, увеличивается резистивная работа дыхания, а утомление и слабость дыхательных мышц могут быть результатом неустранимой обструкции ДП.
В связи с тем что сопротивление дыхательных путей (согласно закону Пуазейля) изменяется обратно пропорционально четвертой степени радиуса их просвета, даже небольшое сужение дыхательных путей может значительно увеличить их сопротивление и, следовательно, работу дыхания в целом. Особенно это касается патологии верхних дыхательных путвй (расположенных выше бифуркации трахеи), на долю которых в норме приходится до 80 % сопротивления. Например, при сужении просвета трахеи новорожденного с 6 до 4 мм общее сопротивление дыхательных путей возрастает почти на 500 %,
Если дыхательные пути в месте сужения ригидны, воздушный поток уменьшается в равной степени как на вдохе, так и на выдохе. Такой вариант обструкции носит название фиксированной. Если же просвет дыхательных путей меняется во время дыхательного цикла, то воздушный поток будет возрастать в одну и уменьшаться — в другую фазу дыхания. В этом случае обструкция дыхательных путей называется вариабельной.
При патологии внутригрудных дыхательных путей положительное плевральное давление на выдохе будет уменьшать, а на вдохе — отрицательное внутриплевральное давление —- увеличивать их просвет (рис. 18.3).
При патологии внегрудных дыхательных путей на вдохе отрицательное давление, создаваемое в дыхательных путях, будет ниже окружающего (атмосферного) давления, что приведет к их сужению. Напротив, на
Выдох Вдох Выдох Вдох
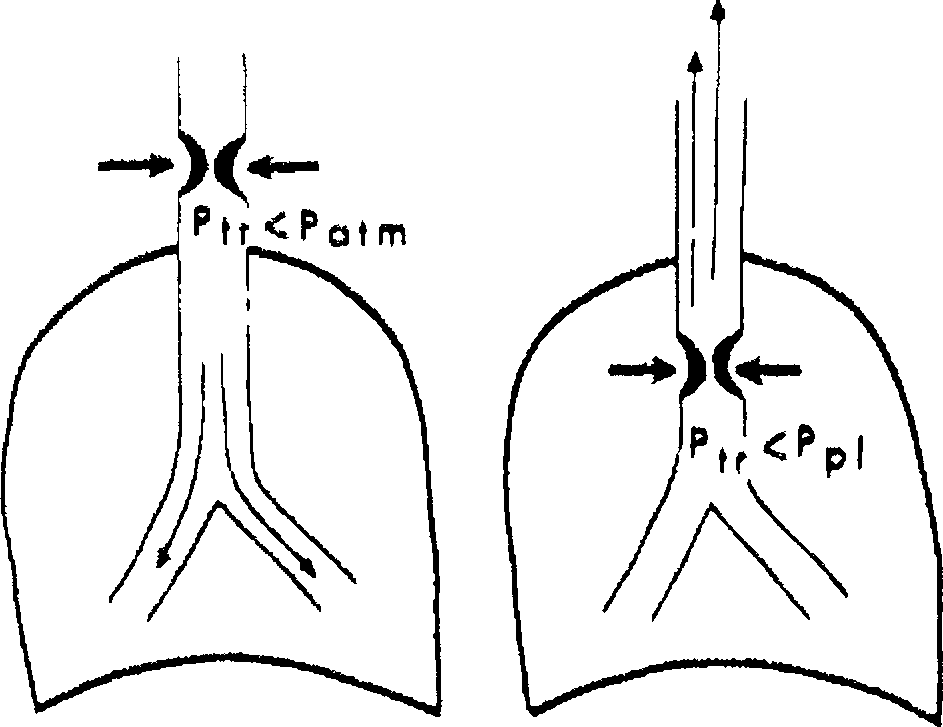
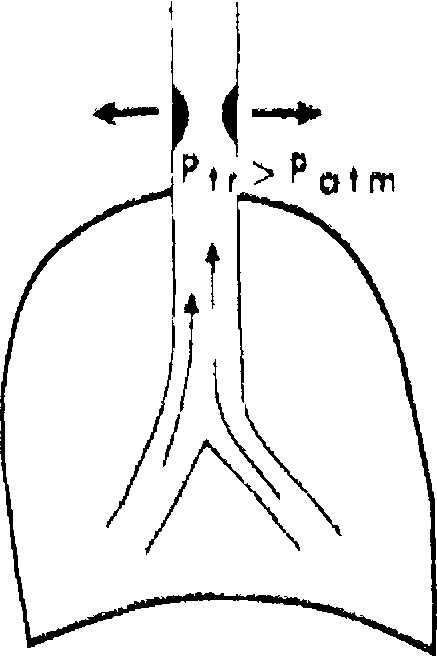
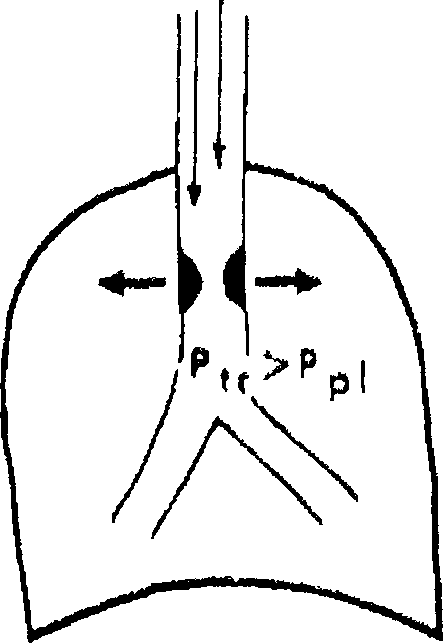
Рис, /8.3. Влияние фаз дыхания на степень обструкции дыхательных путей, А — вариабельная внегрудная обструкция; Б — вариабельная внутригрудная
обструкция
.
Рис.
18.4.
Основные механизмы обструкции дыхательных
путей.
А Б В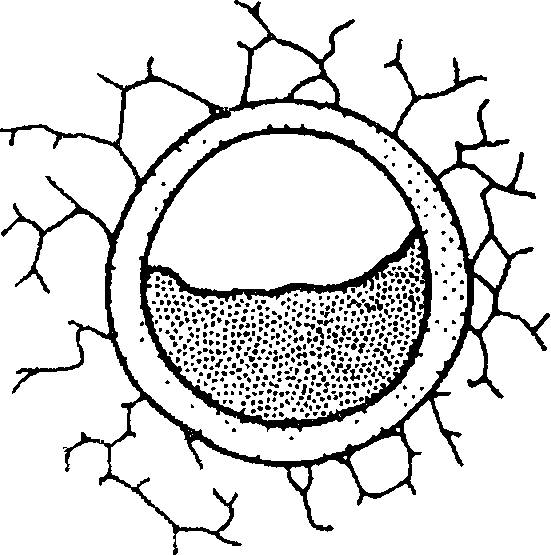
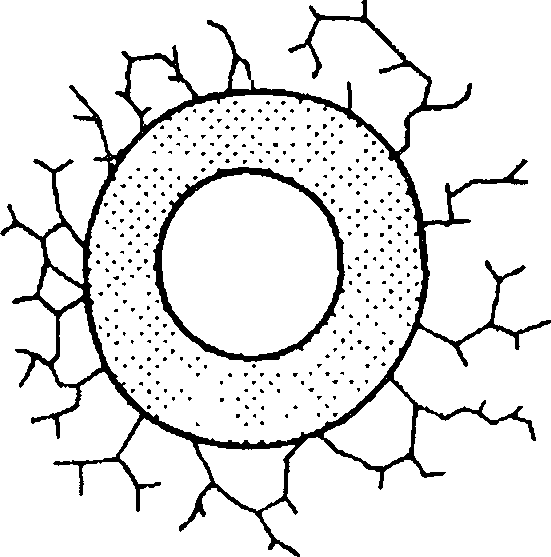
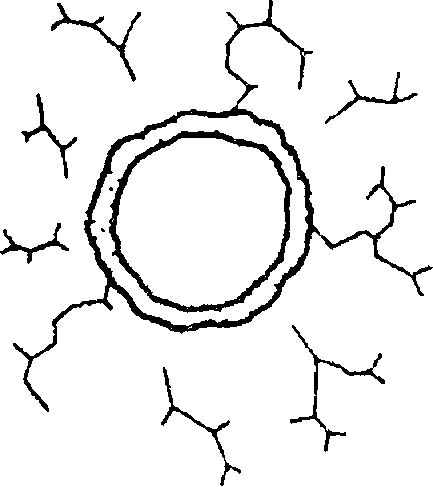
А — внутрипросветная обструкция; Б — спазм бронхов; В — перибронхиальная
обструкция.
выдохе вследствие положительного давления, создаваемого в дыхательных путях, их просвет увеличится и степень обструкции уменьшится.
Повышение сопротивления дыхательных путей (или обструктивный вариант нарушения функций внешнего дыхания) может быть обусловлено различными механизмами.
Скопление большого количества секрета с измененными реологическими свойствами (мокроты) в просвете бронхов — нередкая причина обструкции при хронических воспалительных процессах в бронхах (хроническом бронхите). Уменьшение просвета бронхов может быть также вызвано аслирацией инородных тел, а также экзофитно растущими опухолями трахеи и бронхов.
В основе избыточного образования мокроты (гиперкринии) при хроническом бронхите лежит перестройка слизеобразующего аппарата бронхиального дерева (бокаловидных клеток и слизистых желез), вызываемая загрязнением окружающего воздуха или чаще курением. Кроме того, образование большого количества мокроты нарушает эффективность работы реснитчатого эпителия трахеи и бронхов (мукоцилиарного эскалатора), в норме эвакуирующего слизь из дыхательных путей со скоростью 6—20 мм/мин. При этом основным механизмом очистки дыхательных путей становится кашель.
Иногда избыточная задержка секрета вдыхательных путях является следствием нарушений, связанных с генетически обусловленной патологией, например при синдроме неподвижных ресничек (синдроме Карта- генера) или легочном муковисцидозе (кистозном фиброзе). При синдроме неподвижных ресничек различные генетические нарушения структуры (описано более 20) и функции реснитчатого аппарата эпителиальных клеток организма (например, отсутствие в структуре ресничек нитей особого белка динеина при синдроме Картагенера) ведут не только к нарушению мукоцилиарного транспорта, но и к частому развитию хронического синусита, образованию бронхоэктазов, бесплодию и обратному расположению внутренних органов (situs inversus).
При муковисцидозе к избыточному скоплению вязкой мокроты в дыхательных путях приводит нарушение процессов гидратации (разжи
жения) бронхиального секрета в связи с генетическим дефектом (их описано более 200) особого транспортного белка — трансмембранного регулятора муковисцидоза (CFTR — от англ. cystic fibrosis transmembrane regulator), который обеспечивает транспорт ионов хлора через апикальную часть мембраны эпителиальных клеток бронхов. Вследствие этого дефекта анионы хлора задерживаются в клетках, усиливают абсорбцию катионов натрия и воды, «высушивая» слизь, продуцируемую всеми эк- зокринными железами организма.
Повышение тонуса гладкой мускулатуры — бронхоспазм является основой обструкций дыхательных путей при бронхиальной астме, возникающей в ответ на воздействие аллергенов. Бронхоконстрикции, индуцированной выделение медиаторов (гистамин, лейкотриены), сопутствует также отек слизистой бронхов, связанный с привлечением клеток, способствующих воспалительной реакции.
Утолщение и фиброзные изменения бронхов, наблюдаемые при многолетных воспалительных процессах в бронхах или длительно и часто рецидивирующих бронхоспастических реакциях, также могут обусловить обструкцию дыхательных путей.
Перибронхиальная обструкция дыхательных путей может быть локализованной, например при сдавлении дыхательных путей извне увеличенным лимфатическим узлом, опухолью, расширенным сосудом или генерализованной. Генерализованная перибронхиальная обструкция дыхательных путей возможна при эмфиземе легких, характеризующейся деструкцией и расширением воздушных пространств, расположенны дис- тальнее терминальных бронхиол. В основе ее развития лежит дисбаланс протеазно-антипротеазной системы легочной ткани, при котором уменьшение антипротеазной (например, при врожденной недостаточности фермента альфа-1 -антитрипсина) или увеличение протеазной активности (например, активации фермента нейтрофильной эластазы в результате курения) ведет к разрушению эластических волокон соединительнотканного остова легких.
Основной механизм экспираторной обструкции при эмфиземе легких рассматривается на модели дыхательной системы, в которой легкие представлены эластическим шаром, а дыхательные пути — открытой в атмосферу трубкой, содержащей коллабируемый сегмент При этом легкие и дыхательные пути заключены в общую камеру — гоудную клетку (рис. 18.5).
В норме внешнее давление, оказываемое на дыхательные пути, в большой мере будет определяться плевральным давлением. Когда плевральное давление становится резко положительным, например при форсированном выдохе, дыхательные пути сдавливаются извне и только благодаря противодействующему давлению внутри дыхательных путей они не спадаются полностью. Два основных фактора определяют уровень внутреннего противодействующего давления в дыхательных путях: давление эластической отдачи легочной ткани и плевральное давление, сдавливающие альвеолы, порождающие экспираторный поток.
Рис.
18.5.
Схематическое изображение легких,
демонстрирующее механизм
динамической компрессии дыхательных путей. Альвеолярное давление складывается из двух составляющих — плеврального давления (Рр! = 20 см вод. ст.) и давления эластической отдачи легочной ткани (Ре| - 10 см вод. ст.).
EPP (equal pressure point) — точка равного давления.
При возникновении воздушного потока отмечается постепенное падение давления внутри дыхательных путей (закон Бернулли), и по их ходу возникает некая точка (местоположение которой зависит от объема легких), в которой внутреннее давление равно внешнему, т.е. плевральному давлению (так называемая точка равного давления). При увеличении силы выдоха и, следовательно, величины плеврального давления последнее в равной степени будет влиять как на альвеолы, так и на дыхательные пути, заключенные внутри грудной клетки.
Движущим давлением в этом случае становится разница давления в альвеолах и точке равного давления, т.е. давление эластической отдачи легочной ткани. При большем усилии выдоха растущее альвеолярное (движущее) давление будет нивелироваться ростом внешнего давления, сдавливающего дыхательные пути. Следовательно, в норме давление эластической отдачи легких является важнейшей детерминантой экспираторного потока, в то время как плевральное давление, зависящее от экспираторного усилия дыхательных мышц, влияет на него в значительно меньшей степени, по крайней мере в конечной части экспираторного потока, где он практически перестает зависеть от усилия.
При эмфиземе легких, вследствие деструкции альвеолярных перегородок снижается давление эластической отдачи легочной ткани или ее эластичность, т.е. способность противодействовать растяжению. Следствием снижения эластичности является уменьшение движущего давления, которое способствует «выталкиванию» воздуха из альвеол во время выдоха. Кроме того, снижение эластической отдачи легочной ткани способствует усилению экспираторного сужения (коллапса) мелких бронхов. В норме легочная паренхима оказывает растягивающее воздействие на дыхательные пути, создавая для них своеобразный внешний каркас. При деструкции межальвеолярных перегородок уменьшается их радиальная тракция, поддерживающая просвет дыхательных путей. Во время выдоха положительное плевральное давление легко сдавливает мелкие бронхи, что ведет к их коллапсу и задержке воздуха в легочной ткани с развитием ее гипервоздушности («воздушная ловушка»).
Наиболее точным методом оценки бронхиального сопротивления является метод плетизмографии тела, при котором одновременно измеряются легочные объемы.
При исследовании функции внешнего дыхания выявляется обструк- тивный тип нарушений со снижением показателей FVC, FEV^ отношения FEV/FVC и MEF25_76.
Величина TLC при этом, как правило, остается в пределах нормы, если ни сила инспираторных мышц, ни эластичность легочной ткани не изменяются. Величина FRC, определяющаяся взаимодействием эластической отдачи легких и грудной клетки, также обычно не меняется, хотя при увеличении частоты дыхания и, следовательно, недостатке времени для осуществления полного выдоха респираторная система не успевает достигнуть состояния покоя (равновесия) и FRC может увеличиваться. При заболеваниях мелких бронхов величина RV, как правило, возрастает вследствие раннего экспираторного закрытия дыхательных путей.
